专利药羟基喜树碱戊二酸单脂体外抗肝癌活性研究
2021-08-02王靳琎黄慧敏陈琴华
魏 英,王靳琎,黄慧敏,陈琴华
0 引言
肝癌是世界上第五大常见癌症,严重威胁着人类健康,5年生存率较低 (约15%,偏远地区仅为2%)[1]。手术是原发性肝癌的首选治疗方法,但80%~90%的患者确诊时已发生广泛的肝内和肝外转移,错过手术时机。放化疗可有效提高局部控制率,改善远期生存率。
羟基喜树碱(Hydroxy camptothecin,HCPT)是一种广谱的抗肿瘤药,是从喜树的皮、果实中提取得到的一类色氨酸-萜烯生物碱,属于细胞周期特异性药物,主要作用于DNA合成期(S期),对原发性肝癌具有治疗作用[2-4]。HCPT为水不溶和脂难溶性药物,很难通过生物膜进入组织和细胞,半衰期非常短,而且药物稳定性非常差,分子内部的内酯环结构容易在中性和碱性条件下开环,降低药物活性,不易发挥长效抗肿瘤作用[5-6]。课题组根据前药原理,在HCPT的10位引入戊二酸基团对其结构进行适当修饰,得到羟基喜树碱戊二酸单酯(Hydroxy camptothecin glutaric acid monoester,HCPT-GCM)偶合物(见图1),并申请了专利,专利号为:201610692633.2。HCPT-GCM的水溶性(20.17 μg/ml)远大于HCPT(4.64 μg/ml)。本研究以HCPT为对照,观察细胞对HCPT和HCPT-GCM的摄取情况;不同浓度的HCPT-GCM作用于肝癌H22细胞株,初步探讨HCPT-GCM对肝癌细胞株增殖抑制作用,现报到如下。
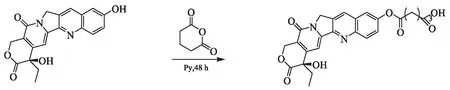
图1 HCPT-GCM的结构(在HCPT的10位引入戊二酸基团)
1 材料与方法
1.1 细胞株及试剂 人肝癌细胞株H22 购于武汉大学典型培养物保藏中心,羟基喜树碱购于北京索莱宝科技有限公司,HCPT-GCM由课题组合成,胎牛血清、细胞计数Kit-8试剂盒购购于美国Sigma公司,RPMI-1640培养液购于美国Gibco公司。
1.2 主要实验仪器 全波长酶标仪购于美国Biotek公司,生物安全柜购于中国Heal Force公司,CO2培养箱购于法国Thermo公司,荧光显微镜购于德国Carl zeiss AG公司,高效液相色谱仪(Agilent 1260 InfinityⅡ)。
1.3 细胞培养 用含10%胎牛血清的RPMI-l640培养液,在37 ℃、5% CO2条件下常规培养人肝癌细胞株H22,当细胞覆盖80%~90%瓶底后,用0.25%的胰酶-EDTA消化传代,进行各项实验。
1.4 细胞摄取实验 50.0 μM的HCPT-GCM、HCPT分别作用于H22细胞0.5、4 h后。1份用冷PBS溶液清洗3次,4%多聚甲醛固定15 min,PBS溶液清洗3次,PI染色15 min,荧光显微镜观察细胞对2种药物的摄取情况;羟基喜树碱被细胞摄取后,在360 nm的激发光波的作用下发射出440 nm的光波,荧光显微镜下可观察到蓝紫色荧光颗粒[7];PI 被细胞摄取后,460~550 nm光波激发后,显微镜下可观察到红色荧光,通过比较细胞内紫蓝色荧光颗粒的多少,直观判断细胞对2种药物的摄取情况。另1份用冷的PBS 溶液清洗3次,每孔加入1 ml细胞裂解液,室温裂解1 h,收集溶液加入20 μl磷酸缓冲液;12 000 r/m离心10 min,取20 μl上清液注入高效液相色谱仪(HPLC)测定药物浓度,计算细胞对药物的摄取情况。
1.5 MTT试验 体外常规培养人肝癌细胞株H22,调整细胞密度为1×104/ml,96孔板中培养24 h后,每孔分别加入含不同浓度(0、0.125、0.25、0.5、1.0、2.5、5.0、10.0、25.0、50.0 μM)的HCPT-GCM及HCPT的培养液,每个浓度设5个平行孔,作用48 h后,细胞计数Kit-8试剂盒490 nm波长下测定吸光值OD,计算HCPT-GCM及HCPT对人肝癌细胞株H22的增殖抑制率。
1.6 细胞周期试验 体外常规培养人肝癌细胞株H22,调整细胞密度为1×104/ml,6孔板中培养24 h后,每孔分别加入含不同浓度(0、1.0、2.5、5.0 μM)的HCPT-GCM的培养液,每个浓度设3个平行孔,作用24 h后,按照说明书收集细胞,75%冷乙醇固定,冷PBS清洗细胞,PI染色,流式细胞仪分析周期。
2 结果
2.1 细胞对药物的摄取情况 50.0 μM的HCPT-GCM和HCPT分别作用于H22细胞0、0.5、4 h后,荧光显微镜下显示,HCPT-GCM处理组细胞内蓝紫色荧光颗粒较HCPT处理组多(见图2),表明HCPT-GCM更易通过细胞膜进入细胞内发挥作用。HPLC法结果也显示,HCPT-GCM处理组细胞内药物浓度较HCPT处理组高,HCPT-GCM更易进入细胞(见图3)。

图2 肝癌H22细胞对HCPT-GCM和HCPT的摄取情况(×200)
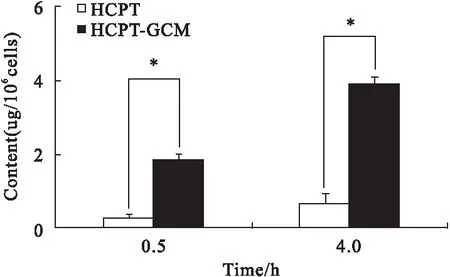
图3 肝癌H22细胞对HCPT-GCM和HCPT的摄取情况(HPLC法)
2.2 药物对细胞增殖的抑制作用 不同浓度的HCPT-GCM及HCPT分别作用于H22细胞48h后,各浓度的2种药物对H22细胞增殖均有一定的抑制作用,药物浓度小于5.0 μM时,随着药物浓度的增加对细胞增殖的抑制率增强,大于5.0 μM时,随着药物浓度的增加对细胞增殖的抑制作用改变不明显;药物浓度为0.5、1.0、2.5、5.0 μM时,HCPT-GCM对H22细胞的增殖抑制作用较HCPT强,差异具有统计学意义(P<0.05,见表1)。以上结果表明,2种药物对肝癌细胞株H22均有明显的增殖抑制作用,且HCPT-GCM的抑制作用更强。

表1 HCPT-GCM对肝癌H22细胞增殖的抑制作用
2.3 HCPT-GCM对H22细胞周期的作用 0、1.0、2.5、5.0 μM的HCPT-GCM作用于H22细胞24 h后,PI染色,流式细胞仪检测细胞周期。与对照组相比较,1.0、2.5、5.0 μM的HCPT-GCM组细胞G2/M期显著减少,S期显著增加,细胞周期阻滞在S期(图4,表2)。

图4 HCPT-GCM对肝癌H22细胞细胞周期的影响

表2 HCPT-GCM对肝癌H22细胞细胞周期的影响
3 讨论
羟基喜树碱是一种细胞周期特异性抗肿瘤药,通过抑制DNA拓扑异构酶I,对多种肿瘤具有较强的抗肿瘤活性[8-9]。研究证明,HCPT对原发性肝癌具有治疗的作用[10-11]。但HCPT为水不溶和脂难溶性药物,半衰期非常短,分布半衰期为5 min左右,消除半衰期为30 min,难以通过生物膜进入组织和细胞,不易发挥长效抗肿瘤作用[12];HCPT包含细胞毒作用的内酯环,水溶性极差,一般将其制成水溶性钠盐针剂;当pH<5时,以羟基内酯环的结构存在,在较高pH环境下,迅速水解成羧酸形结构,丧失活性[13-16]。为达到治疗目的,实际用量远超理论用量,使得药物胃肠道反应、肾毒性和骨髓抑制等毒副作用较大[17-19]。因此,对HCPT进行局部修饰、有效提高水溶性、克服转运过程中失效等问题具有重要意义。HCPT-GCM偶合物是在HCPT的10位引入戊二酸基团对其结构进行适当修饰得到的,目前对HCPT-GCM的研究尚处在起始阶段。
喜树碱被细胞摄取后,在360 nm的激发光波的作用发射出440 nm的光波,荧光显微镜下可观察到蓝紫色的荧光[7]。本课题组应用喜树碱的这一特点做了细胞摄取实验,结果显示,50.0 μM的HCPT-GCM和HCPT分别作用于肝癌H22细胞0.5、4 h后,H22细胞在2个时间点对HCPT-GCM的吞噬作用均较HCPT强,证明HCPT-GCM更易通过细胞膜进入细胞内;同时,HPLC法药物浓度测定进一步证明HCPT-GCM较HCPT更易进入细胞内。这与前期专利申请的研究结果相符,HCPT-GCM的溶解度远大于HCPT。
MTT试验结果显示,0.5、1.0、2.5、5.0 μM的HCPT-GCM和HCPT分别作用于肝癌细胞株H22 48 h后,HCPT-GCM对H22细胞的增殖抑制作用较HCPT强,表明HCPT-GCM对肝癌细胞株H22具有更强的体外抑制作用。当浓度大于5.0 μM时,随着药物浓度的增加对细胞增殖的抑制作用增加不明显,表明,HCPT-GCM最佳作用浓度小于5.0 μM。
羟基喜树碱是细胞周期特异性抗肿瘤药,根据MTT实验结果,选取对细胞增殖抑制率较好的药物浓度(1.0、2.5、5.0 μM)的HCPT-GCM作用于H22肝癌细胞株24 h,流式细胞术结果显示,细胞G2期减少,S期显著增加,细胞阻滞在S期,表明,HCPT-GCM使H22细胞周期停止于S期,干扰了细胞DNA的复制,从而抑制了细胞的增殖。
综上所述,HCPT-GCM较HCPT更易通过细胞膜,且HCPT-GCM对肝癌细胞株H22的增殖抑制作用较HCPT强;HCPT-GCM作用于细胞周期,使细胞周期停止于S期,干扰DNA的复制是其抑制细胞增殖的作用机制之一。HCPT-GCM作为一个专利药,其稳定性、体内药物代谢动力学、组织分布、生物安全性、体内外抗肝癌活性及其原理等相关问题,课题组后期将做进一步的研究报道。
