KIF11通过激活Wnt/β-catenin通路调控高糖诱导的人视网膜微血管内皮细胞损伤△
2022-12-29韩昌婧段雪娟
韩昌婧 徐 丽 段雪娟 艾 欣
糖尿病视网膜病变(DR)是糖尿病患者常见的微血管并发症之一,它可能导致患者严重的视力障碍甚至失明[1]。近年来,随着糖尿病的发病率逐渐增加,DR成了威胁中青年人群视力的常见因素[2]。DR的发病机制相当复杂,与视网膜炎症、视网膜血管渗透性增加以及血-视网膜屏障破坏有关。这些过程会引起视网膜微血管内皮细胞无序地增殖和迁移以及毛细血管形成,最终导致视网膜新生血管形成[3-5]。KIF11是一种纺锤体驱动蛋白,在纺锤体双极性的形成和维持中发挥重要作用[6]。近年来的研究发现,KIF11在多种肿瘤中过度表达,与肿瘤的发生发展密切相关[7-8]。下调KIF11可抑制肿瘤细胞的增殖和迁移[9]。Shao等[10]分析GSE60436数据库发现,KIF11在增生型DR视网膜组织中表达上调,且可能与血管生成和视网膜血管内皮细胞的增殖有关。但是KIF11在DR中的作用还未见报道。因此,本研究拟通过高糖诱导人视网膜微血管内皮细胞(HRMECs)损伤建立DR模型,分析KIF11在DR中的作用和机制。
1 材料与方法
1.1 材料HRMECs(中科院细胞库),DMEM培养基(美国Gibco公司),胎牛血清(美国Hyclone公司),LiCl、总RNA提取试剂盒、通用逆转录PCR试剂盒(M-MLV)和Real-time PCR试剂盒(北京索莱宝公司),Lipofectamine 3000(美国Invitrogen公司),CCK-8试剂盒(美国MedChemExpress公司),Transwell小室(美国BD公司),RIPA裂解液和BCA蛋白浓度测定试剂盒(上海碧云天公司),抗KIF11、缺氧诱导因子-1α(HIF-1α)、β-catenin、cyclin D1和c-Myc兔单克隆抗体(美国Cell signaling technology公司),抗VEGF小鼠单克隆抗体(美国Santa Cruz公司),抗GAPDH鼠单克隆抗体、HRP标记的山羊抗小鼠IgG和山羊抗兔IgG二抗(北京康为试剂公司)。KIF11 siRNA序列(si-KIF11)、对照序列(si-NC)和Real-time PCR引物序列由上海生工生物工程股份有限公司合成,ABI 7500 Real-time PCR仪和NanoDrop 2000C超微量分光光度计(美国Thermo Fisher Scientific公司),Tanon 4600 全自动化学发光图像分析系统(上海天能科技有限公司)。
1.2 方法
1.2.1 细胞培养和分组将HRMECs培养在含体积分数10%胎牛血清的DMEM培养基中,置于37 ℃,含体积分数5% CO2恒温细胞培养箱中培养。正常培养24 h后,将细胞随机分成4组:正常组、高糖组、高糖+si-NC组、高糖+si-KIF11组。正常组细胞在含5 mmol·L-1葡萄糖的DMEM培养基中培养;高糖组细胞在含30 mmol·L-1葡萄糖的培养基中培养;高糖+si-NC组和高糖+si-KIF11组先使用Lipofectamine 3000将100 nmol·L-1si-NC或100 nmol·L-1si-KIF11分别转染至细胞中,6 h后更换为完全培养基继续培养48 h,然后再给予含30 mmol·L-1葡萄糖的培养基继续孵育24 h。
另外,将正常培养的HRMECs随机分成高糖组、高糖+si-KIF11组、高糖+si-KIF11+NC组和高糖+si-KIF11+LiCl组来验证KIF11是否通过Wnt/β-catenin通路发挥作用。高糖组和高糖+si-KIF11组细胞处理方法同前。高糖+si-KIF11+NC组和高糖+si-KIF11+LiCl组在转染si-KIF11后分别加入20 mmol·L-1NaCl或20 mmol·L-1LiCl孵育2 h后给予含30 mmol·L-1葡萄糖的培养基继续孵育24 h。
1.2.2 CCK-8法检测细胞活力将HRMECs按照每孔1×103个接种到96孔板中,培养箱中培养24 h,分组处理后,每孔中加入10 μL CCK-8溶液继续孵育2 h,用酶标仪检测各孔在450 nm波长处的吸光度。
1.2.3 Transwell实验检测细胞迁移将分组处理后的HRMECs用胰蛋白酶消化后,无血清的DMEM培养基稀释成浓度为105个·mL-1的细胞悬液。取200 μL细胞悬液加入到Transwell上室,下室加入含不同浓度的葡萄糖及体积分数20%胎牛血清的培养基。在细胞培养箱中孵育24 h后,用棉签轻轻地将上层未迁移的细胞擦掉,下层PBS清洗后,40 g·L-1多聚甲醛固定30 min,结晶紫染色20 min,然后于显微镜下观察拍照并对细胞进行计数。实验重复3次。
1.2.4 Real-time PCR检测细胞分组处理后,弃培养基,冰冷的PBS清洗细胞3次,用总RNA提取试剂盒提取细胞的总RNA,将总RNA沉淀溶解到无RNA酶的水中。然后根据试剂盒说明书配制20 μL的反应体系,将1 μg总RNA逆转录成cDNA。取1 μL cDNA根据Real-time PCR试剂盒说明书操作,进行PCR扩增。KIF11、VEGF和HIF-1α mRNA水平根据公式2-△△Ct计算,以GAPDH为内参,引物序列见表1。实验重复3次。

1.2.5 Western blot检测细胞分组处理后,加入100 μL RIPA裂解液裂解30 min,4 ℃条件下15 000 r·min-1离心10 min,吸取含总蛋白的上清液,用BCA试剂盒测定蛋白浓度后,每个样品取30 μg进行聚丙烯酰胺凝胶电泳。将分离的蛋白转移至PVDF膜上后,用50 g·L-1脱脂奶粉对膜进行封闭,之后加入提前稀释好的一抗KIF11(11000)、HIF-1α(11000)、β-catenin(11000)、cyclin D1(1800)、c-Myc(1800)、VEGF(1600)和GAPDH (12000)在4 ℃过夜孵育。用TBST充分洗膜3次,加入二抗(15000)室温孵育1 h。用ECL发光液对蛋白条带进行显色,并用ImageJ软件分析各个蛋白条带的吸光度。以GAPDH为内参,计算目的蛋白的表达量。实验重复3次。
1.3 统计学分析采用SPSS 19.0软件对数据进行统计分析,计量资料用均数±标准差表示。多组间数据的比较采用单因素方差分析,并用LSD-t方法进行两两比较。检验水准:α=0.05。
2 结果
2.1 KIF11在高糖诱导的HRMECs中表达增加Real-time PCR和Western blot检测KIF11 mRNA和蛋白表达,结果见图1。高糖组HRMECs的KIF11 mRNA和蛋白表达均较正常组显著升高(均为P<0.05),高糖+si-KIF11组HRMECs的KIF11 mRNA和蛋白表达均低于高糖组(均为P<0.05),而高糖+si-NC组与高糖组HRMECs的KIF11 mRNA和蛋白表达相比差异均无统计学意义(均为P>0.05)。

图1 各组HRMECs的KIF11 mRNA和蛋白表达 A:Real-time PCR检测结果;B:Western blot检测结果;C:KIF11蛋白相对表达量。1:正常组;2:高糖组;3:高糖+si-NC组;4:高糖+si-KIF11组。与正常组相比,*P<0.05;与高糖组相比,#P<0.05。
2.2 降低KIF11表达对高糖诱导的HRMECs增殖的影响CCK-8法检测结果显示,正常组、高糖组、高糖+si-NC组和高糖+si-KIF11组HMRECs细胞活力分别为100.0%±4.0%、149.3%±6.5%、148.4%±8.5%、110.0%±5.6%。两两比较结果显示,高糖组HRMECs细胞活力较正常组增加(P<0.05),高糖+si-KIF11组HRMECs细胞活力低于高糖组(P<0.05),而高糖+si-NC组与高糖组HRMECs细胞活力相比差异无统计学意义(P>0.05)。
2.3 降低KIF11表达对高糖诱导的HRMECs迁移的影响Transwell实验检测结果显示,正常组、高糖组、高糖+si-NC组和高糖+si-KIF11组迁移细胞数分别为(48.3±4.7)个、(103.4±8.1)个、(100.3±9.1)个、(60.0±6.2)个。两两比较结果显示,高糖组HRMECs迁移细胞数较正常组增多(P<0.05),高糖+si-KIF11组HRMECs迁移细胞数低于高糖组(P<0.05),而高糖+si-NC组与高糖组HRMECs迁移细胞数相比差异无统计学意义(P>0.05)(图2)。

图2 各组HRMECs迁移情况 A:正常组;B:高糖组;C:高糖+si-NC组;D:高糖+si-KIF11组。
2.4 降低KIF11表达对高糖诱导的HRMECs血管生成相关因子表达的影响Real-time PCR和Western blot检测血管生成相关因子VEGF和HIF-1α mRNA和蛋白表达,结果见图3。与正常组相比,高糖组HRMECs的VEGF、HIF-1α mRNA和蛋白相对表达量均显著升高(均为P<0.05);高糖+si-KIF11组HRMECs的VEGF、HIF-1α mRNA和蛋白相对表达量均低于高糖组(均为P<0.05),而高糖+si-NC组与高糖组相比,HRMECs的VEGF、HIF-1α mRNA和蛋白相对表达量差异均无统计学意义(均为P>0.05)。
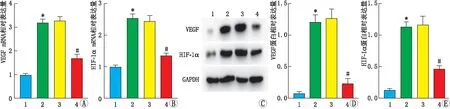
图3 各组HRMECs的VEGF、HIF-1α mRNA和蛋白表达 A:VEGF mRNA相对表达量;B:HIF-1α mRNA相对表达量;C:Western blot检测结果;D:VEGF蛋白相对表达量;E:HIF-1α蛋白相对表达量。1:正常组;2:高糖组;3:高糖+si-NC组;4:高糖+si-KIF11组。与正常组相比,*P<0.05;与高糖组相比,#P<0.05。
2.5 降低KIF11表达对Wnt/β-catenin通路的影响Western blot检测Wnt/β-catenin通路的活化情况,结果见图4。与正常组相比,高糖组HRMECs的β-catenin及下游分子cyclin D1和c-Myc蛋白相对表达量均显著升高(均为P<0.05);高糖+si-KIF11组HRMECs的β-catenin、cyclin D1和c-Myc蛋白相对表达量均低于高糖组(均为P<0.05),而高糖+si-NC组与高糖组相比,HRMECs的β-catenin、cyclin D1和c-Myc 蛋白相对表达量差异均无统计学意义(均为P>0.05)。
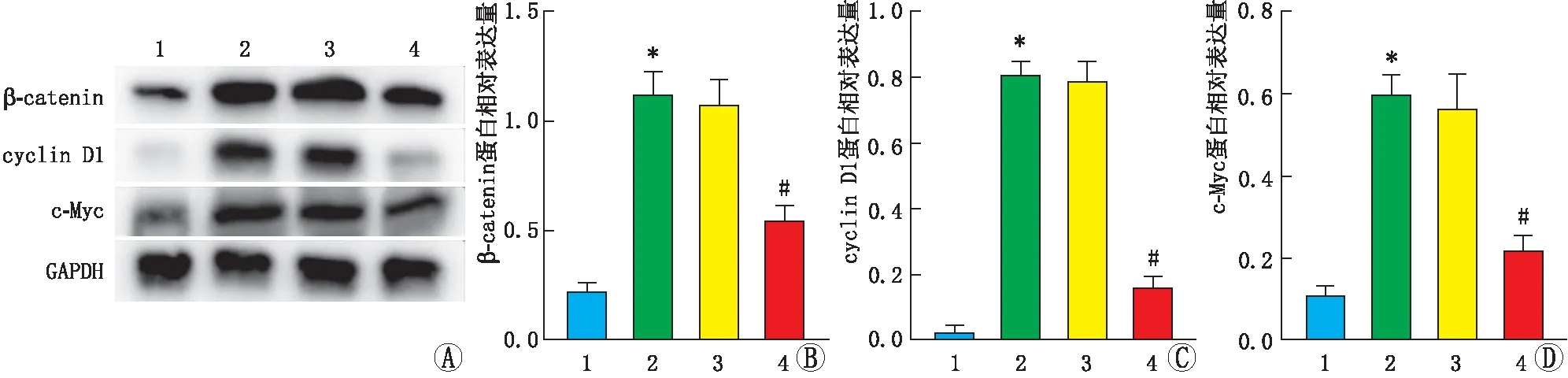
图4 各组HRMECs的β-catenin、cyclin D1和c-Myc蛋白表达 A:Western blot检测结果;B:β-catenin蛋白相对表达量;C:cyclin D1蛋白相对表达量;D:c-Myc蛋白相对表达量。1:正常组;2:高糖组;3:高糖+si-NC组;4:高糖+si-KIF11组。与正常组相比,*P<0.05;与高糖组相比,#P<0.05。
2.6 Wnt/β-catenin通路激活剂可逆转KIF11下调对高糖诱导的HRMECs损伤的影响CCK-8检测和Transwell检测结果显示,高糖组、高糖+si-KIF11组、高糖+si-KIF11+NC组和高糖+si-KIF11+LiCl组HRMECs细胞活力分别为100.0%±5.3%、65.1%±5.6%、66.7%±6.4%、90.3%±5.7%,迁移细胞数分别为(106.0±7.5)个、(59.7±4.6)个、(57.7±7.0)个、(94.6±8.4)个。经统计学处理,高糖+si-KIF11+LiCl组细胞活力和迁移细胞数均较高糖+si-KIF11组增加(均为P<0.05)。Western blot检测结果显示,与高糖+si-KIF11组相比,高糖+si-KIF11+LiCl组HRMECs的VEGF和HIF-1α蛋白相对表达量均显著升高(均为P<0.05)。高糖+si-KIF11+NC组与高糖+si-KIF11组相比,HRMECs的细胞活力、迁移细胞数、VEGF和HIF-1α蛋白相对表达量差异均无统计学意义(均为P>0.05)(图5)。

图5 LiCl对各组HRMECs的迁移及VEGF、HIF-1α蛋白表达的影响 A:Transwell检测细胞迁移;B:Western blot检测结果;C:VEGF蛋白相对表达量;D:HIF-1α蛋白相对表达量。2:高糖组;4:高糖+si-KIF11组;5:高糖+si-KIF11+NC组;6:高糖+si-KIF11+LiCl组。与高糖组相比,*P<0.05;与高糖+si-KIF11组相比,#P<0.05。
3 讨论
DR是与糖尿病相关的慢性、严重的眼部并发症,并且DR患者出现糖尿病相关的其他微血管和大血管并发症的风险增加[11]。高血糖与DR的病理变化密切相关,可诱导血管新生、炎症、氧化应激和细胞增殖[11]。VEGF是DR血管病理变化中一个重要的血管生成因子[12]。VEGF在多种视网膜细胞中表达,如视网膜血管内皮细胞、视网膜色素上皮细胞、Müller细胞、星形胶质细胞和神经节细胞[13]。在DR发病过程中,视网膜血管内皮细胞在血管形成中反应最为迅速[14]。过表达VEGF是引起血管新生和血管渗漏的主要因素。VEGF可通过自分泌信号促进人视网膜血管内皮细胞的增殖、迁移和管腔形成,在视网膜中也可通过旁分泌信号调节血管生成过程中与其他细胞的合作[15]。HIF-1α是调控VEGF表达的一个重要转录因子,在视网膜血管内皮细胞中可被高糖诱导表达[16]。因此,本研究通过体外高糖诱导HRMECs损伤来探究DR的分子机制。本研究中,经高糖处理后HRMECs的增殖、迁移能力增加,且血管生成相关因子VEGF和HIF-1α表达上调,这表明体外模型建立成功。
KIF11基因位于10q24.1,其结构在多个物种间具有保守性,主要由运动结构域、内部茎结构域和尾部结构域组成。研究证实,KIF11是调控细胞有丝分裂的一个重要分子[7]。近年来的研究显示,KIF11在多种肿瘤细胞中表达增加,参与了肿瘤的发展进程[7-8]。KIF11与肿瘤发展中血管生成也存在一定联系,如Luo等[17]等研究显示,KIF11在肾母细胞瘤中表达升高;KIF11过表达不仅与瘤细胞的增殖有关,还与VEGF表达和瘤内微血管密度有关[17]。Exertier等[18]研究发现,KIF11抑制剂可减弱肿瘤细胞增殖,损伤内皮细胞血管生成能力。KIF11在增生型DR组织中表达上调,且其表达量与血管生成和视网膜血管内皮细胞增殖相关基因表达有关[10]。因此,本研究通过体外实验探究了KIF11在DR中的作用。结果发现,KIF11在高糖诱导的HRMECs中表达上调,这与其在增生型DR组织中的表达趋势一致[10]。下调KIF11表达显著降低了高糖诱导的HRMECs的增殖、迁移以及VEGF和HIF-1α表达,这表明下调KIF11可抑制高糖诱导的HRMECs损伤,这主要与其血管生成被抑制有关。
本研究进一步探究了KIF11可能的作用机制。经典Wnt/β-catenin信号通路在胚胎生成和成体组织稳态中是一个进化保守的调节通路[19-20]。它对于包括眼在内的多种器官的血管形态形成至关重要。Wang等[21]研究发现,Wnt/β-catenin信号通路异常能引起多种眼科疾病。Wnt/β-catenin通路的过度活化与DR中的视网膜炎症和血管生成有关[22]。Pei等[23]研究表明,KIF11可通过激活Wnt/β-catenin通路增加乳腺癌细胞的自我更新。因此,本研究进一步探究了KIF11是否通过Wnt/β-catenin通路在高糖诱导的HRMECs损伤中发挥作用。结果发现,下调KIF11显著降低了高糖诱导的β-catenin及下游分子cyclin D1和c-Myc蛋白水平。LiCl通过抑制GSK-3β稳定游离的细胞质β-catenin蛋白,从而激活经典Wnt/β-catenin信号通路[22]。本研究使用LiCl进一步验证发现,与高糖+si-KIF11组相比,高糖+si-KIF11+LiCl组HRMECs细胞活力和迁移细胞数均显著增加,且VEGF和HIF-1α蛋白表达水平均显著上调。这表明KIF11在高糖诱导的HRMECs中是通过活化Wnt/β-catenin通路发挥作用的。
综上,本研究发现,KIF11在高糖诱导的HRMECs中表达增加,降低KIF11表达可通过阻止Wnt/β-catenin通路活化,抑制高糖诱导的细胞增殖、迁移和血管生成。本研究进一步阐明了DR的发病机制,并为DR的治疗提供新的理论基础。抑制KIF11可能是未来治疗DR的新策略。
