丹酚酸B对高糖诱导的视网膜Müller细胞凋亡、自噬及AMPK信号通路的影响
2022-03-11杨效竹
唐 霞 代 艳 杨效竹
糖尿病视网膜病变(DR)是糖尿病最常见且严重的并发症之一,也是老年人视力受损的主要原因之一[1-2]。目前对DR的治疗包括视网膜激光光凝术和玻璃体切割术,但这些只能缓解症状,不能从根本上阻止疾病的进展。因此,确定DR的机制并探索治疗DR患者的新方法非常重要。Müller细胞是视网膜中最常见的胶质细胞类型,跨越整个神经视网膜层,在维持视网膜的生理功能方面发挥着重要作用[1,3-4]。近年来,人们逐渐认识到Müller细胞的变性和凋亡与DR的发病机制有关,然而,具体机制尚不完全清楚。慢性高血糖可诱导Müller细胞凋亡,导致谷氨酸循环异常和视网膜微环境改变,加速神经元凋亡,导致DR视力下降,抑制Müller细胞凋亡可能是预防DR病理变化的一种治疗策略[5]。有研究表明,丹酚酸B可通过抗脂质过氧化、抗氧自由基产生、提高细胞耐缺氧能力等预防糖尿病诱导的视网膜病变[6-8]。本研究旨在探究丹酚酸B对高糖诱导的视网膜Müller细胞凋亡、自噬及AMPK信号通路的影响,从AMPK-自噬-凋亡角度解析丹酚酸B防治DR的潜在机制。
1 材料与方法
1.1 主要仪器与试剂AMR-100型多功能酶标仪(杭州奥盛仪器有限公司);6010可见-紫外分光光度计(美国安捷伦上海分析仪器厂);ABI 7500型Real-time PCR系统(美国Applied Bio-Systems Instruments公司);丹酚酸B(上海禾午生物科技有限公司);成骨分化培养基(Cyagen Bioscience公司);MTT(Sigma-Aldrich美国公司);胎牛血清、10 g·L-1苯基甲烷磺酰氟、Hoechst 33258染色(Beyotime 公司);兔抗大鼠Bax、AMPK、Bcl-2、p-AMPK单克隆抗体(武汉博士德公司);兔抗鼠GS抗体(美国Abcam公司);山羊抗兔IgG抗体(Bioker公司);RIPA组织裂解液(南京碧云天生物制剂公司);Trizol试剂(美国Invitrogen公司);逆转录试剂盒、实时定量PCR反应体系试剂盒(美国Promega公司)。AMPK抑制剂Dorsomorphin (DS;亦名Compound C或 BML-275)、AMPK激活剂AICAR(美国Selleck公司)。
1.2 Müller细胞提取、培养及鉴定取出生4~7 d的SD大鼠5只(体重25~45 g,购自北京维通利华生物科技有限公司),腹腔注射戊巴比妥钠麻醉后取出眼球,在碘伏及含100 U·mL-1青、链霉素混合液的D-Hank液中各浸泡10 min,D-Hank液冲洗,去除眼球外筋膜组织,沿角膜缘后1 mm剪开眼球壁,去除眼前节及玻璃体,分离视网膜,将视网膜剪成小碎片,2.5 g·L-1胰蛋白酶-EDTA消化液消化20 min,吸管吹打,用含体积分数10%胎牛血清、10 g·L-1青、链霉素混合液的RPMI-1640培养液终止消化,铜网过滤,将过滤液离心,弃上清液,沉淀物加细胞培养液吹打稀释,接种于塑料培养瓶中,置于37 ℃、体积分数5%CO2培养箱中培养,每3 d换液1次,去除悬浮细胞,待细胞贴壁达到80%融合后按12传代。
取第2代细胞接种于放置经多聚赖氨酸处理的盖玻片的六孔板内,细胞贴壁后弃培养液,PBS液清洗;40 g·L-1多聚甲醛固定10 min,PBS液清洗;体积分数0.5% Triton穿孔15 min,PBS液清洗;体积分数5%山羊血清封闭30 min,加Müller细胞特异性标志物谷氨酰胺合成酶一抗(1200) 4 ℃过夜,PBS液漂洗;加山羊抗兔IgG二抗( 1500) 37 ℃杂交1 h,PBS液漂洗;加DAPI染核,PBS液漂洗,甘油封片,光镜和荧光显微镜下观察计数。
1.3 实验分组取第3代或第4代Müller细胞随机分为对照组、高糖组、高糖+丹酚酸B组、高糖+DS组、高糖+DS+丹酚酸B组、高糖+AICAR组和高糖+AICAR+丹酚酸B组。对照组细胞给予5 mmol·L-1低浓度葡萄糖孵育;高糖组细胞给予35 mmol·L-1高浓度葡萄糖孵育;高糖+丹酚酸B组细胞在35 mmol·L-1葡萄糖基础上同时给予40 μmol·L-1丹酚酸B孵育;高糖+DS组细胞在35 mmol·L-1葡萄糖基础上同时给予10 μmol·L-1DS孵育;高糖+DS+丹酚酸B组细胞在35 mmol·L-1葡萄糖基础上同时给予40 μmol·L-1丹酚酸B和10 μmol·L-1DS孵育;高糖+AICAR组细胞在35 mmol·L-1葡萄糖基础上同时给予1 mmol·L-1AICAR孵育;高糖+AICAR+丹酚酸B组细胞在35 mmol·L-1葡萄糖基础上同时给予1 mmol·L-1AICAR和40 μmol·L-1丹酚酸B孵育。
1.4 检测指标与检测方法
1.4.1 MTT法检测细胞活力细胞分组处理后48 h,分别加入1 g·L-1MTT于37 ℃、体积分数5% CO2中孵育5 h,去除MTT后,继续孵育1 h,加入1 mL异丙醇,于570 nm波长下测量各组细胞光密度。
1.4.2 Hoechst 33258染色观察细胞形态各组细胞以每孔5×104个接种于24孔板,培养24 h后,在40 g·L-1多聚甲醛中固定30 min,PBS液轻轻冲洗细胞3次,每孔加入1 mL Hoechst 33258于37 ℃ 染色45 min,PBS缓冲液轻轻冲洗细胞3次,荧光显微镜下观察各组细胞凋亡情况。
1.4.3 Western blot检测蛋白表达各组细胞培养7 d后,采用1 mL预冷RIPA组织裂解液裂解细胞,添加10 g·L-1苯基甲烷磺酰氟蛋白酶抑制剂和磷酸酶抑制剂制备细胞总蛋白。用BCA法测定蛋白浓度。20 μg蛋白在100 g·L-1SDS-PAGE凝胶上电泳,然后转移到聚偏二氟乙烯膜上。在TBS-Tween 20中用50 g·L-1脱脂牛奶封闭后,4 ℃一抗(兔抗大鼠Beclin1、LC3-I、LC3-II、p-AMPK、AMPK、Bax和Bcl-2单克隆抗体,稀释度均为11000)孵膜。然后用TBS-Tween 20洗涤3次,每次15 min,再与二抗山羊抗兔IgG抗体(1500)室温孵育2 h,利用Image Lab软件对各组蛋白灰度值进行检测和量化。实验重复3次。
1.4.4 qRT-PCR检测自噬相关基因Beclin1和LC3-II mRNA表达各组细胞培养18 d后,Trizol试剂提取细胞总RNA,6010可见-紫外分光光度计检测各组细胞RNA含量及质量,使用高效cDNA逆转录试剂盒制备cDNA,qRT-PCR检测Beclin1、LC3-II mRNA表达,并使用2-ΔΔCt方法计算各组细胞mRNA相对表达量。引物序列:Beclin1上游引物为3’-GATCCACTGAGCACCGA-5’,下游引物为3’-CTCACCTGGTGGCATTGTG-5’;LC3-II上游引物为3’-CCAAGCGGAGACAGAAAC-5’,下游引物为3’-CCCAGGTCAGGGGATCTT-5’;β-actin上游引物为3’-ACGGTCAGGCATCACTATC-5’,下游引物为3’-TGCCACAGGATCCATACC-5’。实验重复3次。
1.5 统计学处理采用SPSS 22.0进行统计学分析,计量资料均用均数±标准差表示,多组样本均数间比较采用方差分析,组间两两比较采用t检验。 检验水准:α=0.05。
2 结果
2.1 Müller细胞的鉴定光镜下可见,细胞形态呈不规则梭形;荧光显微镜下可见,Müller细胞特异性标志物谷氨酰胺合成酶被标记为红色,细胞核被标记为蓝色,确定所获得的细胞为Müller细胞,满足研究需求(图1)。

A:光镜下观察;B:荧光显微镜下观察。图1 Müller细胞鉴定结果
2.2 MTT法检测结果MTT法检测结果显示,对照组、高糖组、高糖+丹酚酸B组、高糖+DS组、高糖+DS+丹酚酸B组、高糖+AICAR组和高糖+AICAR+丹酚酸B组Müller细胞活力分别为(100±22)%、(59±33)%、(98±2)%、(62±2)%、(63±3)%、(89±4)%和(91±5)% 。与对照组比较,高糖组Müller细胞的活力明显降低,差异具有统计学意义(t=8.914,P<0.01)。与高糖组比较,高糖+DS组和高糖+DS+丹酚酸B组Müller细胞活力无显著变化(t=0.194、0.404,均为P>0.05),高糖+丹酚酸B组、高糖+AICAR组和高糖+AICAR+丹酚酸B组Müller细胞活力均显著增加(t=8.114、7.004、5.144,均为P<0.01)。与高糖+丹酚酸B组比较,高糖+DS+丹酚酸B组Müller细胞活力显著降低(t=7.404,P<0.01),高糖+AICAR+丹酚酸B组Müller细胞活力无明显变化(t=0.124,P>0.05)。
2.3 Hoechst 33258染色结果Hoechst 33258染色结果显示,与对照组比较,高糖组Müller细胞的细胞核浓缩和DNA片段化显著增加;与高糖组比较,高糖+丹酚酸B组、高糖+AICAR组Müller细胞的细胞核浓缩和DNA片段化显著减少,高糖+DS组、高糖+DS+丹酚酸B组Müller细胞的细胞核浓缩和DNA片段化无显著变化;与高糖+丹酚酸B组比较,高糖+DS+丹酚酸B组Müller细胞的细胞核浓缩和DNA片段化显著增加,高糖+AICAR +丹酚酸B组Müller细胞的细胞核浓缩和DNA片段化无显著变化(图2)。

A:对照组;B:高糖组;C:高糖+丹酚酸B组;D:高糖+DS组;E:高糖+DS+丹酚酸B组;F:高糖+AICAR组;G:高糖+AICAR+丹酚酸B组。白色箭头示发生细胞核浓缩和DNA片段化的Müller细胞。图2 Hoechst 33258染色检测各组细胞凋亡情况
2.4 各组细胞Bax及Bcl-2蛋白表达情况Western blot检测结果显示,与对照组比较,高糖组、高糖+DS组和高糖+DS+丹酚酸B组Müller 细胞中Bcl-2蛋白表达均显著减少,而Bax蛋白表达均显著增加(均为P<0.01),高糖+丹酚酸B组、高糖+AICAR组和高糖+AICAR+丹酚酸B组Müller 细胞中Bcl-2和Bax蛋白表达差异均无统计学意义(均为P>0.05)。与高糖组比较,高糖+丹酚酸B组、高糖+AICAR组、高糖+AICAR+丹酚酸B组Müller细胞中Bcl-2蛋白表达均显著增加,而Bax蛋白表达均显著减少(均为P<0.01),高糖+DS组、高糖+DS+丹酚酸B组Müller细胞中Bcl-2和Bax蛋白表达差异均无统计学意义(均为P>0.05)。与高糖+丹酚酸B组比较,高糖+DS+丹酚酸B组Müller细胞中Bcl-2蛋白表达显著减少,而Bax蛋白表达显著增加(均为P<0.05),高糖+AICAR+丹酚酸B组Müller细胞中Bcl-2和Bax蛋白表达差异均无统计学意义(均为P>0.05)(图3)。
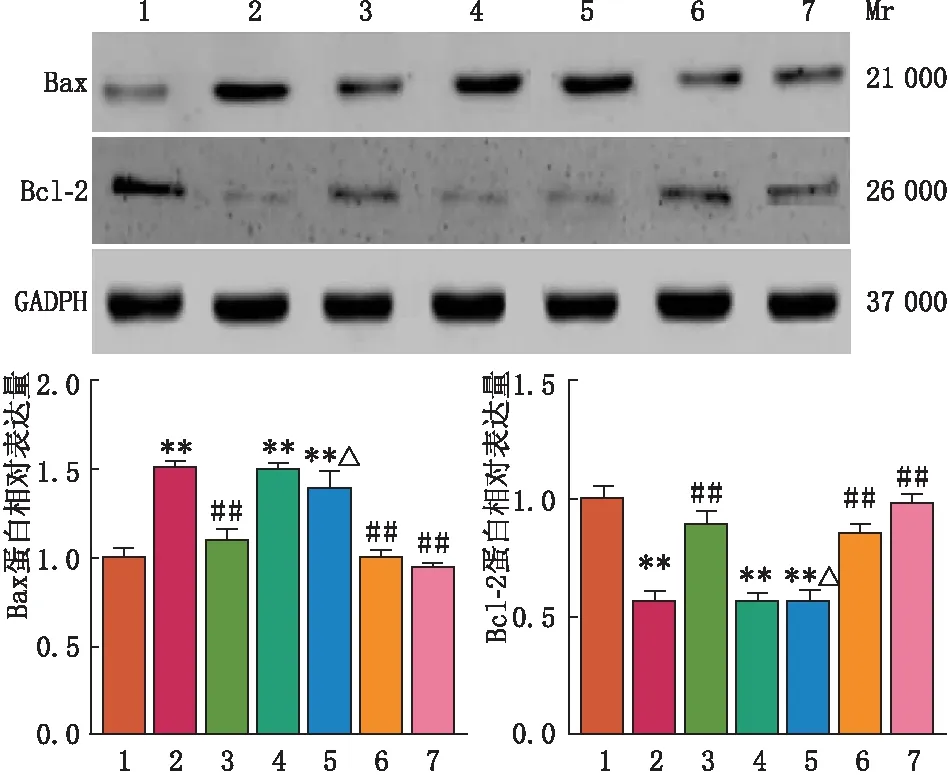
1:对照组;2:高糖组;3:高糖+丹酚酸B组;4:高糖+DS组;5:高糖+DS+丹酚酸B组;6:高糖+AICAR组;7:高糖+AICAR+丹酚酸B组。与对照组比较,**P<0.01;与高糖组比较,##P<0.01;与高糖+丹酚酸B组比较,△P<0.05。图3 Western blot检测各组细胞中Bax和Bcl-2蛋白表达情况
2.5 各组细胞Beclin1和LC3-II mRNA表达情况与对照组比较,高糖组、高糖+DS组和高糖+DS+丹酚酸B组Müller细胞中Beclin1和LC3-II mRNA表达均显著减少(均为P<0.01),高糖+丹酚酸B组、高糖+AICAR组和高糖+AICAR+丹酚酸B组Müller细胞中Beclin1和LC3-II mRNA表达均无显著变化(均为P>0.05)。与高糖组比较,高糖+丹酚酸B组、高糖+AICAR组、高糖+AICAR+丹酚酸B组Müller细胞中Beclin1和LC3-II mRNA表达均显著增加(均为P<0.05),高糖+DS组、高糖+DS+丹酚酸B组Müller细胞中Beclin1和LC3-II mRNA表达均无显著变化(均为P>0.05)。与高糖+丹酚酸B组比较,高糖+DS+丹酚酸B组Müller细胞中Beclin1和LC3-II mRNA表达均显著减少(均为P<0.05),高糖+AICAR+丹酚酸B组Müller细胞中Beclin1和LC3-II mRNA表达均无显著变化(均为P>0.05)(表1)。
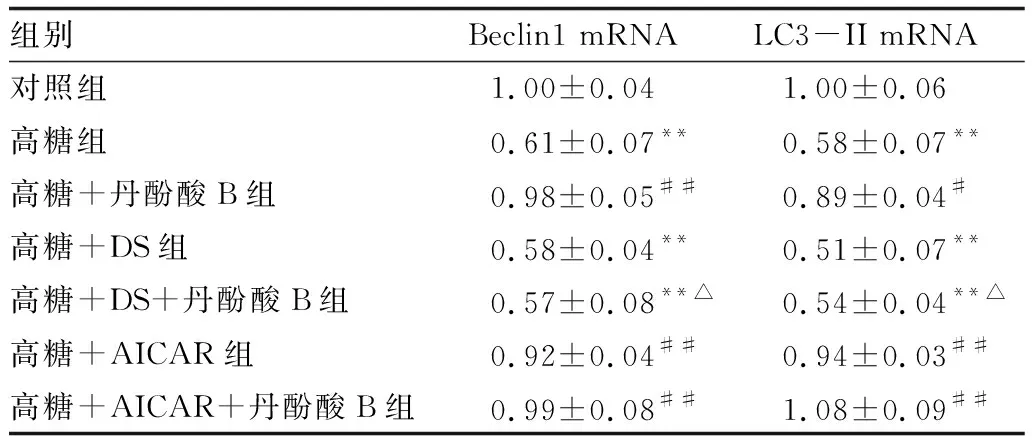
表1 各组细胞Beclin1和LC3-II mRNA表达情况
2.6 各组细胞Beclin1及LC3蛋白表达情况与对照组比较,高糖组、高糖+DS组和高糖+DS+丹酚酸B组Müller细胞中Beclin1和LC3-II 蛋白表达均显著减少(均为P<0.01),高糖+丹酚酸B组、高糖+AICAR组和高糖+AICAR+丹酚酸B组均无显著变化(均为P>0.05)。与高糖组比较,高糖+丹酚酸B组、高糖+AICAR组、高糖+AICAR+丹酚酸B组Müller细胞中Beclin1和LC3-II 蛋白表达均显著增加(均为P<0.05),高糖+DS组、高糖+DS+丹酚酸B组Müller细胞中Beclin1和LC3-II蛋白表达均无显著变化(均为P>0.05)。与高糖+丹酚酸B组比较,高糖+DS+丹酚酸B组Müller细胞中Beclin1和LC3-II蛋白表达均显著减少(均为P<0.05),高糖+AICAR+丹酚酸B组Müller细胞中Beclin1和LC3-II 蛋白表达均无显著变化(均为P>0.05)。各组细胞间LC3-I蛋白表达差异均无统计学意义(均为P>0.05)(图4)。
2.7 各组细胞AMPK及p-AMPK蛋白表达情况与对照组比较,高糖组、高糖+DS组和高糖+DS+丹酚酸B组Müller细胞中p-AMPK蛋白表达均显著减少(均为P<0.01),高糖+丹酚酸B组、高糖+AICAR组和高糖+AICAR+丹酚酸B组均无显著变化(均为P>0.05)。与高糖组比较,高糖+丹酚酸B组、高糖+AICAR组、高糖+AICAR+丹酚酸B组Müller细胞中p-AMPK蛋白表达均显著增加(均为P<0.01),高糖+DS组、高糖+DS+丹酚酸B组Müller细胞中p-AMPK蛋白表达均无显著变化(均为P>0.05)。与高糖+丹酚酸B组比较,高糖+DS+丹酚酸B组Müller细胞中p-AMPK蛋白表达均显著减少(均为P<0.05),高糖+AICAR+丹酚酸B组Müller细胞中p-AMPK蛋白表达无显著变化(P>0.05)。各组细胞间AMPK蛋白表达差异均无统计学意义(均为P>0.05)(图5)。

1:对照组;2:高糖组;3:高糖+丹酚酸B组;4:高糖+DS组;5:高糖+DS+丹酚酸B组;6:高糖+AICAR组;7:高糖+AICAR+丹酚酸B组。与对照组比较,**P<0.01;与高糖组比较,#P<0.05,##P<0.01;与高糖+丹酚酸组比较,△P<0.05。图4 Western blot检测各组细胞中Beclin1和LC3蛋白表达情况

1:对照组;2:高糖组;3:高糖+丹酚酸B组;4:高糖+DS组;5:高糖+DS+丹酚酸B组;6:高糖+AICAR组;7:高糖+AICAR+丹酚酸B组。与对照组比较,**P<0.01;与高糖组比较,##P<0.01;与高糖+丹酚酸B组比较,△P<0.05。图5 Western blot检测各组细胞中AMPK和p-AMPK蛋白表达情况
3 讨论
DR是一种严重的糖尿病微血管并发症,约占所有失明致病因素的5%,高血糖会增加视网膜及其毛细血管中的炎症反应、细胞凋亡和氧化应激紊乱等[5,9-10]。有研究表明,从中药丹参提取的丹酚酸B化合物可通过增加细胞自噬水平来减少细胞凋亡从而防治糖尿病并发症,如糖尿病性白内障、糖尿病肾病、糖尿病心脏病和糖尿病脑病等[6]。AMPK信号转导主要由丝氨酸/苏氨酸激酶介导,参与调节细胞生长、分化及能量代谢平衡等诸多方面。本研究结果亦表明,丹酚酸B调节Müller细胞自噬及抗Müller细胞凋亡的机制可能是通过激活AMPK信号通路来实现的,为靶向AMPK信号通路开发治疗DR新药提供依据[11]。本研究结果表明,AMPK信号通路与高血糖诱导的Müller细胞凋亡密切相关,此外,增强AMPK活性可起到抗细胞凋亡作用。当AMPK被磷酸化时,它可以靶向激活下游许多分子通路的活性。Kubota等[11]研究证实,DR小鼠视网膜中p-AMPK的表达下调,激活AMPK通路,可能是DR一种有前景的治疗策略。本研究结果表明,高血糖抑制了p-AMPK蛋白表达,丹酚酸B干预后促进了p-AMPK蛋白表达,丹酚酸B对AMPK通路的活化作用进一步被AMPK激动剂(AICAR)和AMPK抑制剂(DS)证实。
Müller细胞凋亡的特点是细胞变圆、膜起泡、细胞骨架塌陷、细胞质浓缩和碎裂、核固缩、染色质浓缩和碎裂以及凋亡小体的形成,这些细胞碎片会被巨噬细胞或邻近细胞迅速吞噬[12-13]。高血糖显著增加了Müller细胞的细胞核浓缩和DNA片段化,促进了Müller细胞的细胞凋亡,经过丹酚酸B处理后,Müller细胞的凋亡被显著抑制,凋亡细胞的数量显著减少,抑制AMPK信号转导显著增加了核凝聚并降低了丹酚酸B的抗凋亡作用,激活AMPK信号转导减少了凋亡细胞的数量并促进了丹酚酸B的抗凋亡作用。高血糖抑制Müller细胞Bcl-2表达,促进Bax表达,诱导Müller细胞凋亡,丹酚酸B处理抑制了Bax表达,促进了Bcl-2表达,从而抑制了Müller细胞的凋亡。抑制AMPK信号转导显著增加了Bax表达,而抑制了Bcl-2表达,降低了丹酚酸B的抗凋亡作用,提示丹酚酸B抗细胞凋亡作用是由AMPK信号通路介导的。Müller细胞自噬和凋亡异常在DR的发病机制和/或病程进展中起着关键作用。自噬是一种细胞内自我降解过程,负责去除、降解和回收细胞质蛋白和细胞器,它涉及一系列连续的事件,包括双膜形成、伸长、囊泡成熟和最终将目标物质输送到溶酶体[1,3,14-16]。本研究结果表明,与对照组比较,高糖组Müller细胞中Beclin1和LC3-II 蛋白表达显著减少,提示高血糖抑制Müller细胞自噬;丹酚酸B可通过激活自噬保护Müller细胞避免其凋亡。相关研究表明,自噬激动剂雷帕霉素(mTOR蛋白特异性抑制剂)可以抑制DR引起的氧化应激紊乱,改善代谢异常,激活细胞的自噬,可能在DR发生发展过程中发挥保护作用[3-4]。本研究中我们探讨了丹酚酸B是否可以保护培养的原代大鼠视网膜Müller细胞免受高糖诱导的细胞凋亡,并探讨其调控AMPK信号转导和细胞自噬潜在的分子机制,为中医药干预DR提供依据[17-18]。
综上,本研究结果表明,高血糖通过抑制AMPK信号通路抑制细胞自噬而诱导Müller细胞凋亡,导致DR发生发展。丹酚酸B可通过激活AMPK信号通路增强细胞自噬而抑制Müller细胞凋亡,维持细胞活力,促使细胞存活,从而对DR起到积极治疗作用。本研究结果为临床防治DR提供了参考和依据。
