芍药二酮对糖尿病视网膜病变大鼠血管损伤及NLRP3活性的影响
2021-08-02冯雪艳张慧芹范玉香刘时文
冯雪艳,张慧芹,李 幸,范玉香,刘时文
糖尿病性视网膜病变(Diabetic retinopathy,DR)是一种以炎症和血管生成途径为特征的视网膜微血管疾病[1]。它是糖尿病最常见的并发症,也是导致成人失明的主要原因之一[2]。越来越多的研究发现,糖尿病引起的视网膜损害与慢性低级别炎症状态下的相关通路和介质有关,这导致血视网膜屏障的通透性增加,导致缺血事件,驱动血管生成进入视网膜[3]。预计到2030年全球糖尿病患者总数将增加至3.66亿人,成为全球健康的主要威胁之一。在糖尿病的血管并发症方面,35%的糖尿病患者有某种形式的DR,7%的患者有增生性DR(Proliferative DR,PDR),7%的患者有糖尿病黄斑水肿,10%的患者处于视觉威胁阶段[4]。因此,寻找有效预防DR的措施和治疗药物是目前研究的热点。
芍药二酮是一种从芍药根中分离得到的新萜类化合物[5],其具有抑制人单核细胞白细胞介素-1β(IL-1β)、环氧合酶(CO)、血栓烷A合成酶(TX)和5-脂氧合酶(LO)活性的作用[6]。近几年有研究发现,芍药二酮减轻了氧化应激和炎症介导的血管和肝脏疾病[7],而炎症在DR发病机制中起着关键的作用[8]。因此,提示芍药二酮可能对DR具有治疗作用。
本研究旨在探索芍药二酮对链脲佐菌素诱导的糖尿病视网膜病变的治疗效果和可能的作用机制,尤其是对视网膜血管炎性和血管通透性的影响,进一步为DR的临床用药提供更直接的实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 8周龄SPF级雄性SD大鼠,体重180~220 g,购自河北省实验动物中心。大鼠被置于受控环境(21~23 ℃,12 h光照/12 h黑暗周期,湿度55%~60%)中,以标准的鼠粮和随意饮水喂养。所有动物实验操作均严格遵循国家卫生研究院实验室动物护理和使用指南中所述的方法。
1.1.2 药品和试剂 芍药二酮购自北京范德生物科技有限责任公司,需用柠檬酸缓冲液(pH=7.4)进行溶解。伊文思蓝染料购自北京Solarbio公司,使用前将伊文思蓝染料溶解在生理盐水中,配制成浓度为45 mg/ml的溶液。戊巴比妥钠购自中国北京国药集团股份有限公司。荧光素(AK-FLUOR)购自Sigma公司。TRIzol购自美国Invitrogen公司。SYBR Premix EX TaqTMI试剂盒购自TaKaRa公司。所有引物均在上海生工合成。一抗NLRP3、含半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1)、白细胞介素-8(Interleukin-8,IL-1β)、凋亡相关斑点样蛋白(Apoptosis-associated speck-like protein containing a CARD,ASC)、GAPDH抗体购自Abcam公司。一抗血小板-内皮细胞粘附分子(Platelet endothelial cell adhesion molecule-1,PECAM-1)、细胞间黏附分子-1(Intercellular cell adhesion molecule-1,ICAM-1)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)和荧光二抗Alexa Fluor 568购自Thermo Fisher 公司。二抗Goat Anti-Rabbit IgG Antibody(H&L)购自金斯瑞生物科技公司。
1.2 方法
1.2.1 糖尿病大鼠模型的建立[9]随机选取8周龄的SD大鼠40只进行造模,先给予高脂高糖的饲料连续喂养4周,4周后,大鼠禁食不禁水12 h,称重并腹腔注射60 mg/kg链脲佐菌素(STZ)。STZ给药48 h后,采集大鼠尾部静脉血进行检测,血糖超过16.7 mmol/L的大鼠为糖尿病,用于糖尿病大鼠模型。
1.2.2 分组及药物干预 将造模成功的大鼠给予芍药二酮灌胃治疗。随机分为4组(n=10),分别是模型组,芍药二酮低(25 mg/kg)、中(50 mg/kg)、高(100 mg/kg)剂量组,另设对照组(n=10),同时给予对照组和模型组等体积的柠檬酸缓冲液灌胃。每天1次,连续4周。
1.2.3 组织的收集 末次给药24 h后,一部分小鼠经腹腔注射戊巴比妥酸进行麻醉处死,取其左右眼的视网膜组织,左眼的视网膜组织保存至-80 ℃,待后续蛋白质的收集;右眼的视网膜组织固定在4%的甲醛溶液中24 h,再进行15% EDTA脱钙处理、酒精梯度(分别为100%、95%和70%)脱水、石蜡包埋、切片(3 μm),保存至4 ℃,待后续病理观察使用。
1.2.4 大鼠视网膜组织病理形态观察 冰冻切片在苏木精溶液中染色5 min,用水冲洗。分色过程在盐酸酒精溶液中进行,最后加水终止。在氨水溶液中进行发蓝,加水终止发蓝。切片浸泡在伊红溶液中5 min,用水冲洗。梯度酒精脱水,二甲苯透明,中性树脂固定封片,光学显微镜下观察载玻片。测量全视网膜的厚度(内界膜和色素上皮之间)并计算神经节细胞层(GCL)细胞的数量(每100 μm细胞)。在每个半球的相邻位置进行3次测量,9次测量取平均值。每组记录3只眼的平均值作为代表值。对三组的结果进行统计分析。
1.2.5 大鼠视网膜组织血管通透性测量[10]采用荧光素检测血管造影和伊文思蓝评价各组大鼠的血管通透性。荧光素血管造影用托品酰胺眼液扩张瞳孔,氯胺酮和甲苯噻嗪深度麻醉大鼠后,腹腔注射150 μl AK-FLUOR(1% W/V)。视网膜血管渗漏用微米级IV成像。注射染料后5 min内拍照。为额外测量血管渗透量,大鼠通过尾静脉注射100 μl伊文思蓝染料,2 h后用CO2安乐处死老鼠,剥离眼球并仔细取出视网膜,放入含有100 μl甲酰胺的离心管中,在55 ℃下培养48 h,然后将离心管转移到96孔板上,测量610 nm处的吸光度。
1.2.6 免疫荧光组织化学 将视网膜组织冰冻切片从4 ℃取出进行冲洗,再用柠檬酸钠缓冲液(pH=6.0)进行抗原去蔽。用1%牛血清白蛋白(BSA)和5%正常山羊血清在磷酸盐缓冲盐水(PBS)溶液中封闭载玻片上的组织切片,用PBS洗涤,与一抗NLRP3孵育2 h,稀释1∶200。将载玻片洗净,然后与相应的1∶500稀释的二抗在适当的封闭液中孵育1 h,室温置于黑暗中。用DAPI进行细胞核染色10 min,再用PBS洗涤,用含有淬灭剂的封片剂进行封片。在徕卡共聚焦显微镜下拍照,用Image J软件对NLRP3荧光强度进行分析。每个视网膜切片随机选择5个视野。
1.2.7 实时定量聚合酶链反应(qRT-PCR) 使用Trizol试剂提取视网膜组织总RNA。使用NanoDrop 2000分光光度计检测RNA质量,将A260/A280比值为1.8~2.0的RNA用于逆转录合成cDNA。采用SYBR Green Real-Time PCR Master进行qRT-PCR。PCR反应条件:50 ℃ 2 min,95 ℃ 15 min,95 ℃ 15 s,进行40个循环;60 ℃30 s,72 ℃ 30 s。扩增是一式3份进行。使用2-△△Ct法计算每个基因的相对表达水平(使用GAPDH作为内参)。所有引物序列如表1。

表1 引物序列
1.2.8 Western blot法检测 将保存在-80 ℃的视网膜组织取出放置冰上,用组织匀浆器进行研磨,加入RIPA裂解液于4 ℃裂解30 min,然后在4 ℃条件下,以20 000 g离心15 min。采用BCA蛋白浓度法测定上清的蛋白含量。将样品与样品缓冲液(4×sample buffer)煮10 min。使用10%~12%的SDS-聚丙烯酰胺凝胶分离总蛋白样本,每泳道上样10 μl进行电泳,然后转膜,再予以下一抗进行孵育(4 ℃孵育过夜):Caspase-1、IL-1β、ASC、VEGF、PECAM-1、ICAM-1,再予相应的二抗室温孵育1 h,用含有Tween 20的Tris缓冲盐水洗涤印迹,最后用ECL显影液进行显影并拍片,用Image-J进行灰度分析。
1.3 统计学分析 所有统计分析均采用GraphPad Prism 6.0软件进行。数据以平均标准误差(SEM)表示,两组之间的比较采用标准双尾无配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 芍药二酮改善了糖尿病大鼠视网膜形态 在光学显微镜下,HE染色显示,视网膜组织可明显分为5层,分别是GCL(视网膜神经节细胞层)、IPL(内网状层)、INL(内部核层)、OPL(外网状层)和ONL(外颗粒层)。对照组大鼠视网膜表面光滑,GCL、INL和ONL层细胞排列紧密、整齐有规律;模型组视网膜内界出现明显水肿,每一层分层异常,细胞排列疏松且无序,总视网膜厚度和GCL、INL、ONL层细胞密度显著低于对照组;而相对于模型组,芍药二酮中剂量组大鼠视网膜内界水肿明显减轻,细胞排列相对整齐,总视网膜厚度和GCL、INL、ONL层细胞密度增多,而芍药二酮低、高剂量组对糖尿病大鼠视网膜形态的改善效果不如中剂量组,见图1。

图1 大鼠视网膜组织HE染色
2.1 芍药二酮改善了糖尿病大鼠视网膜血管通透性 为了研究芍药二酮对糖尿病大鼠视网膜血管通透性的影响,我们检测了血管造影并评价了各组大鼠的血管通透性。结果显示,相比于对照组,模型组大鼠视网膜微血管渗漏增加;而相对于模型组,芍药二酮低、中、高剂量组抑制了大鼠视网膜微血管渗漏,但芍药二酮低、高剂量组对糖尿病大鼠视网膜血管通透性的改善效果不如中剂量组,见图2。
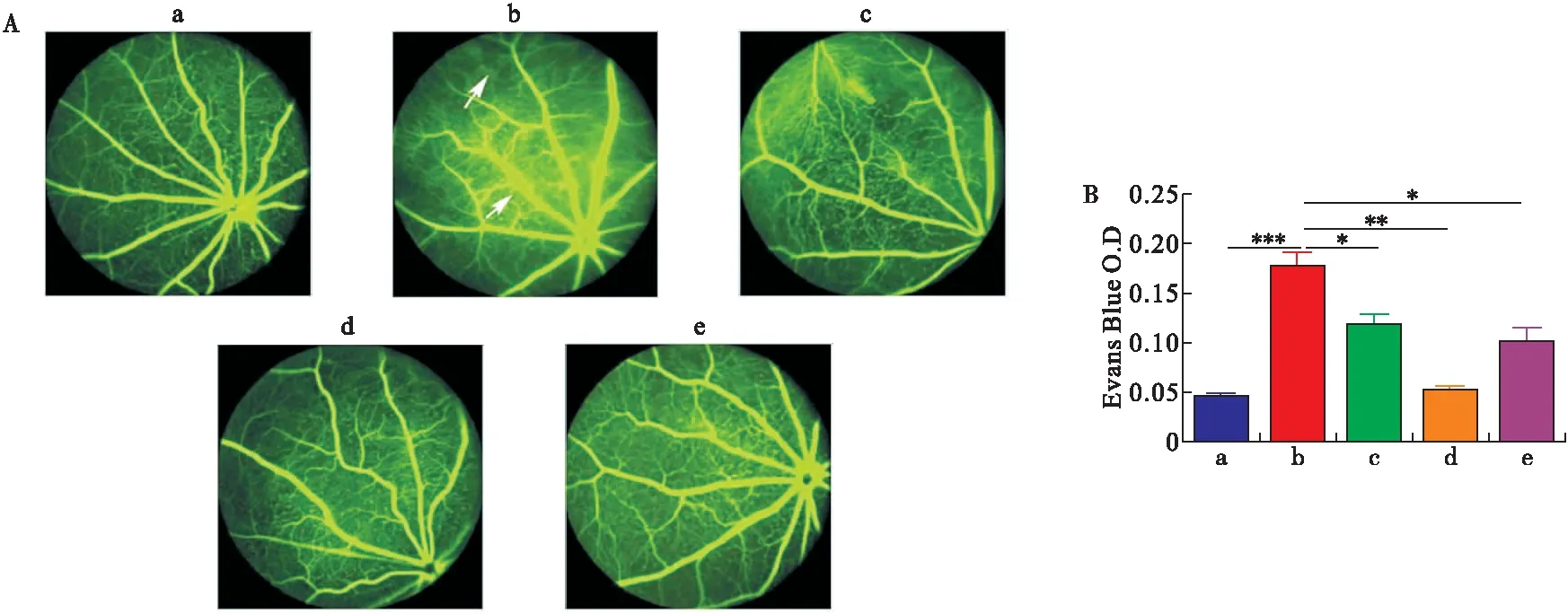
图2 大鼠视网膜组织伊文斯蓝染色
2.2 芍药二酮抑制了糖尿病大鼠视网膜组织中血管生成介质的增加 血管生成介质的表达与血管通透性和血管形成有关。因此,我们检测了各组大鼠视网膜组织中血管生成介质PECAM-1、ICAM-1、VEGF的表达。qRT-PCR和Western blot结果显示,与对照组相比,模型组血管生成介质PECAM-1、ICAM-1、VEGF的表达上调;而与模型组相比,芍药二酮低、中、高剂量组下调了PECAM-1、ICAM-1、VEGF的表达,其中芍药二酮中剂量组变化最显著,见图3。
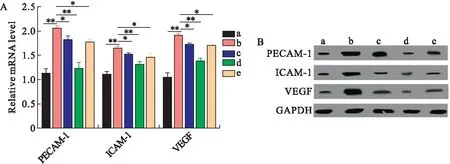
图3 大鼠视网膜组织中血管生成介质的蛋白表达
2.3 芍药二酮减少了糖尿病大鼠视网膜组织中NLRP3阳性细胞数量 炎症是DR发病机制的关键因素,影响血管的形成[8]。因此,我们检测了各组大鼠视网膜组织中NLRP3炎性小体蛋白的表达。免疫荧光组织化学染色结果显示,NLRP3炎性小体主要在GCL和IPL层组成性表达。与对照组相比,模型组NLRP3阳性细胞增多;而与模型组相比,芍药二酮低、中、高剂量组NLRP3阳性细胞均减少,芍药二酮中剂量组NLRP3阳性细胞数量显著减少,见图4。
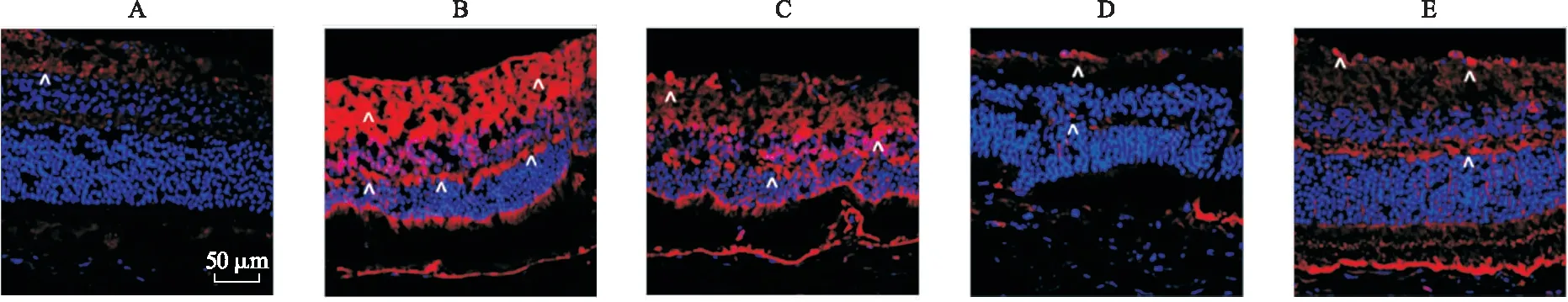
图4 大鼠视网膜组织中NLRP3的蛋白表达
2.4 芍药二酮抑制了糖尿病大鼠视网膜组织中NLRP3炎性小体的激活 本研究检测了各组大鼠视网膜组织中NLRP3炎性小体激活标志物Caspase-1、IL-1β、ASC的表达。qRT-PCR和Western blot结果显示,与对照组相比,模型组大鼠视网膜组织中Caspase-1、IL-1β、ASC的表达上调;而与模型组相比,芍药二酮低、中、高剂量组Caspase-1、IL-1β、ASC的表达下调,其中芍药二酮中剂量组变化最显著,见图5。
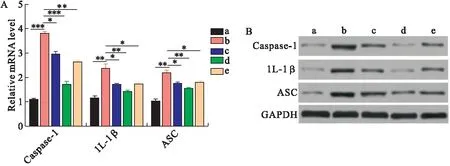
图5 大鼠视网膜组织中NLRP3炎性小体激活标志物的蛋白表达
3 讨论
DR是糖尿病最常见的并发症,也是全球糖尿病患者视力下降的主要原因[11]。临床上,DR大致分为早期非增生性DR 和晚期增生性DR,伴有和不伴有糖尿病性黄斑水肿的发展[12]。DR涉及多个相互关联的通路,炎症就是其中之一,它会对视网膜的神经和血管成分产生不良影响。持续的炎症会引起生化和分子的变化,最终导致糖尿病视网膜病变的并发症和视力下降[13]。DR的病因和病理已经被广泛研究,但其治疗的选择很少。因此,研究治疗DR的药物极其重要。
芍药二酮是具有较强抑制人体IL-1β活性的一类新型萜类化合物,研究发现,它还是多种酶的抑制剂[5-6]。本研究初步探讨了芍药二酮对DR的保护作用及分子机制。研究发现,芍药二酮可以改善DR模型大鼠的视网膜形态,包括改善了GCL、INL及ONL层分层和细胞排列紊乱,并抑制了全视网膜厚度和GCL、INL、ONL层细胞密度的降低;此外,芍药二酮还改善了DR模型大鼠视网膜血管通透性,降低了视网膜微血管的渗漏,抑制了视网膜新生血管的形成。因此,芍药二酮对DR诱发的视网膜组织损伤具有抑制作用。
本研究探讨了芍药二酮抑制DR大鼠视网膜组织损伤的分子机制。由于血管通透性和新生血管形成受血管生成介质PECAM-1、ICAM-1、VEGF的调控[14-16],我们检测了DR大鼠视网膜组织中血管生成介质的表达,发现芍药二酮降低了血管生成介质PECAM-1、ICAM-1、VEGF的表达,由此降低了血管渗漏,抑制了视网膜血管的通透性和新生血管形成。此外,有研究报道,NLRP3炎症小体相关的炎症分子在糖尿病视网膜组织中表达增强,可能有助于糖尿病视网膜病变中新生血管形成[17]。NLRP3炎性小体,是由NLRP3、ASC和Caspase-1组成[18]。NLRP3成分识别危险信号,并将蛋白复合物ASC组装起来激活Caspase-1,导致促炎性细胞因子IL-1β蛋白水解分泌,进而激活NLRP3炎性小体。最新研究表明,通过调节NLRP3炎性小体的激活,可以改善糖尿病视网膜病变[19]。为此,我们检测了大鼠视网膜组织中NLRP3炎症小体及其激活标志物Caspase-1、IL-1β、ASC的表达。本研究结果显示,芍药二酮降低了NLRP3炎症小体及其激活标志物Caspase-1、IL-1β、ASC的表达,进而抑制了NLRP3炎症小体的激活。因此,芍药二酮抑制DR大鼠视网膜组织GCL细胞数量的减少和血管渗漏可能是通过抑制NLRP3炎症小体激活实现的。
综上所述,芍药二酮改善了DR大鼠的视网膜组织形态和血管通透性,降低了DR大鼠视网膜组织中NLRP3炎症小体激活标志物Caspase-1、IL-1β、ASC和血管生成介质PECAM-1、ICAM-1、VEGF的表达,可能是通过抑制NLRP3炎症小体激活实现。
