海岛棉GbGSTU7的克隆及其对枯萎病菌侵染的应答
2021-07-28陆小双韩万里曲延英陈全家邓晓娟
陆小双,陈 琴,韩万里,曲延英,陈全家,邓晓娟
(新疆农业大学 农学院/棉花教育部工程研究中心,乌鲁木齐 830052)
棉花是全球范围内最重要的经济作物之一。中国是目前世界上最大的棉花生产国,由于海岛棉纤维比陆地棉的纤维更长、更强、更细,使其成为栽培棉中纤维品质最优的类型,并且是纺高支精梳纱和特种纺织物的关键原料,在纺织工业中占有重要地位[1]。新疆棉区作为中国唯一的海岛棉种植及生产基地,在国民经济中占有很重要的地位,棉花生产的兴衰对中国乃至世界都会产生十分重要的影响。新疆棉区虽然具有独特的自然条件,适合棉花的种植,但也存在许多问题。特别是棉花枯萎病 (Fusariumoxysporumf.sp.vasinfectum.Fov),近年来由于连年种植,枯萎病已严重影响海岛棉生产,给棉花生产带来了巨大的经济损失[2],使新疆海岛棉的种植面积和产量都大量减少。因此,因海岛棉枯萎病导致减质减产的问题急需被解决,而解决这一问题的有效办法就是棉花抗病新品种的选择和培育。海岛棉自身枯萎病抗性基因的挖掘是关键点,所以利用生物信息学、分子遗传学和基因工程的方法为海岛棉抗枯萎病品种的选育提供候选基因显得尤为重要。
在长期的进化过程中,植物逐渐形成了一系列的抗逆机制,其中,谷胱甘肽途径在此过程中发挥着重要作用[3]。谷胱甘肽转移酶(glutathione S-transferases, GSTs)是一种多功能酶[4],是广泛存在于自然界中的小分子多功能型水溶性蛋白[5]。GSTs一般通过促进还原型谷胱甘肽与各种含亲电基团底物的相互作用,形成复合物,将有害物质运输至体外,从而起到解毒消毒作用[6]。GST被认为是在微生物、动植物酶解毒、细胞信号转导和其他细胞过程中起着必不可少的作用[7]。其主要功能之一是能够提高植物细胞膜的修复能力,在基因工程中可用于提高植物的抗逆能力[8]。GST包含一个N末端域和一个C末端域。N末端结构域包括谷胱甘肽(GSH)结合和催化的催化残基,而保守性较低的C末端结构域(包含5或6个主要螺旋)结合疏水性底物并决定GST的特异性和活性[9]。在非生物胁迫反应中,GST催化GSH的巯基与外源亲电子类物质结合来降低生物细胞内ROS水平,从而保护植物免受损伤[10]。在病原菌等生物胁迫反应中,植物通过增强GST同源基因的表达,将有毒物质运送至液泡加工解毒以减轻对植物的损伤[11-12]。因此,GST基因在植物抵御各种生物和非生物胁迫的进程中均起着非常重要的作用。
课题组前期对具有高抗枯萎病的海岛棉品系06-146与高感枯萎病品种‘新海14’为亲本杂交构建的F7重组自交系群体中的抗感病品种进行转录组测序[13],测序结果提示GSTU7基因可能参与抗枯萎病过程。本研究以海岛棉抗枯萎病材料06-146为试验材料,获得GbGSTU7基因(CottonFGD登录号:GB_A03G0575),对其核苷酸和氨基酸序列进行分析。用抗枯萎病材料06-146与感枯萎病材料‘新海14’为试验材料,利用实时荧光定量PCR技术对该基因在枯萎病菌侵染下的表达进行研究,旨在探讨基因与棉花抗枯萎病之间的关系,为进一步研究海岛棉GSTU7基因的生物学功能奠定理论基础。
1 材料和方法
1.1 材 料
海岛棉抗枯萎病材料06-146,感枯萎病材料‘新海14’,枯萎病菌(生理小种7号),均由新疆农业大学作物遗传育种实验室提供和保存。
1.2 方 法
1.2.1 棉花种植与培养挑选饱满脱绒种子,1%(体积分数)升汞消毒后,无菌水冲洗多次后将种子置于铺有湿润滤纸的发芽盒中,置于人工气候室培养(25 ℃恒温,16 h光照/8 h黑暗)培养至芽长3 cm左右,移至Hoagland’s营养液中培养。待第一片真叶完全展开时,接种稀释至孢子数为1×107个·mL-1的枯萎病菌(生理小种7号)。选取0 h及接菌后4、8、12、24和48 h 的棉株下胚轴、茎和叶片,经液氮速冻处理,-80 ℃超低温冰箱保存备用。
1.2.2 接种鉴定培养基制备。制备马铃薯固体培养基和液体培养基,用于棉花枯萎病菌的培养。
病菌培养。挑取枯萎病菌单菌落接种于马铃薯固体培养基上进行扩大培养,25 ℃恒温培养5~7 d,再将培养后的枯萎病菌接种于马铃薯液体培养基中,25 ℃、 r·min-1震荡培养1周以上,用细胞计数器计数菌液浓度达到1×107个·cm-2备用。
棉花枯萎病菌侵染棉花。室内种植棉花幼苗待2片子叶展平时,用伤根法完成枯萎病菌对棉花的侵染。
接种鉴定。在接种3周后开始进行室内病情的调查和统计,待病情稳定后调查发病率。
分级标准采用国家0~5级的判断标准[14]。
1.2.3 RNA提取与cDNA合成RNA提取采用天根(TIANGEN)生化科技有限公司的RNA提取试剂盒(RNA plant Plus Reagent),提取后的RNA采用爱必梦生物科技有限公司的反转录试剂盒(First-Strand cDNA Synthesis Kit) 进行反转录,cDNA样品用ddH2O稀释后,置于-20 ℃备用。
1.2.4GbGSTU7基因的克隆和测序通过CottonFGD数据库得到GSTU7基因的序列,并设计用于克隆该基因编码区全长的引物,引物交由上海华大基因科技有限公司合成。以提取的cDNA为模板进行PCR扩增,PCR反应经94 ℃预变性5 min后,以94 ℃变性30 s,51.6 ℃退火40 s,72 ℃延伸45s为循环,循环数为35个,最后经72 ℃延伸5 min 后终止反应,4 ℃保存。采用1.5%琼脂糖凝胶电泳对PCR产物进行分离检测,用Tian Gen公司DNA产物纯化试剂盒对含有目的DNA 片段的PCR反应液进行纯化。将纯化产物与pEASY-T1 (全式金)克隆载体连接,转入Trans-T1 (全式金)感受态,均匀涂布在含有50 ng·μL-1卡那霉素的LB 固体培养基上(酵母提取物5 g,胰蛋白胨10 g,氯化钠10 g,琼脂粉15 g,定容至1 L),正置培养1 h后,37 ℃倒置过夜培养,挑取阳性单克隆经菌液PCR验证正确后送华大公司测序。
1.2.5 序列生物信息学分析用NCBI-ORF FINDER找到测序序列的开放阅读框,利用ExPAXSyProtParam (http://web.expasy.org/protparam/)分析该蛋白的物理化学特性,利用TMHMM-2.0(http://www.cbs.dtu.dk/services/ TMHMM-2.0/)和SignalP (http://www.cbs.dtu.dk/services/SignalP/)分析目的蛋白是否存在跨膜区和信号肽,使用EMBL的PFAM(https://pfam.xfam.org/search/sequence)及ExPASy的PROSITE(http://prosite.expasy.org/)对推导出的GSTU7蛋白的功能结构域进行预测。借助NCBI下载相似性高的基因序列,在Clust Omega(https://www. ebi.ac.uk/Tools/msa/clustalo/)中进行多序列比较。利用MEGA 10构建系统发育进化树。运用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)和SWISS MODEL (https://www.swissmodel.expasy.org/)对蛋白质的二级、三级结构进行分析。通过在线预测软件SoftBerryProtComp9.0(http://www.SoftBerry.com)对蛋白进行亚细胞定位。
1.2.6 实时荧光定量PCR利用美国ABI公司7500 Fast System荧光定量PCR仪进行实时荧光定量PCR。以棉花GhUBQ7为内参基因,与目标基因一起扩增,每个处理设3次生物学重复,按照abm SYBR qPCR Master Mix试剂盒的操作说明进行实时荧光定量PCR,检测目的基因的表达,所用引物见表1。以棉花UBQ7基因的转录表达水平作为内参,用2-ΔΔCT法计算目的基因的相对表达水平。
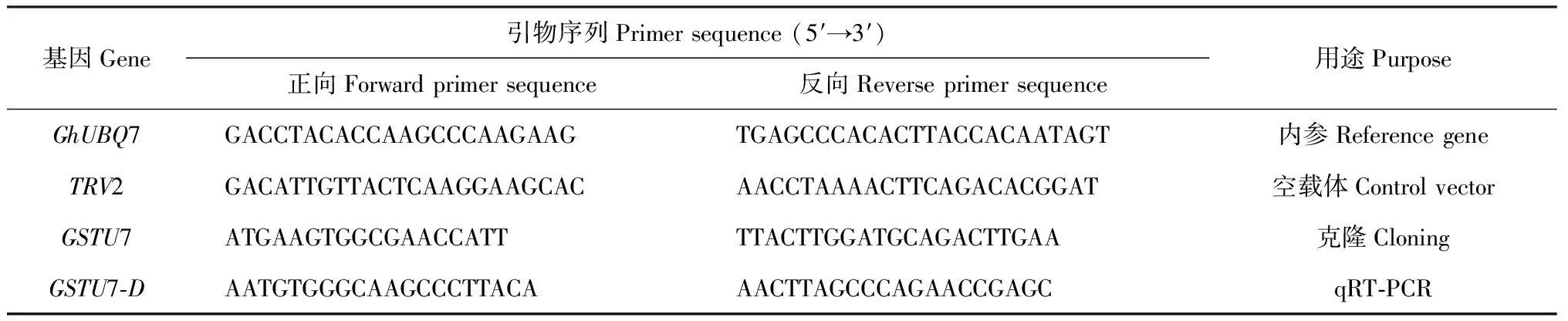
表1 本研究所用引物
2 结果与分析
2.1 室内抗枯萎病鉴定结果
对本研究所涉及的‘新海14’及06-146进行室内枯萎病接种鉴定,结果如表2所示,‘新海14’的枯萎病发病率显著高于06-146,平均高70%。根据国家标准[14],‘新海14’属于感病材料,06-146属于抗病材料。
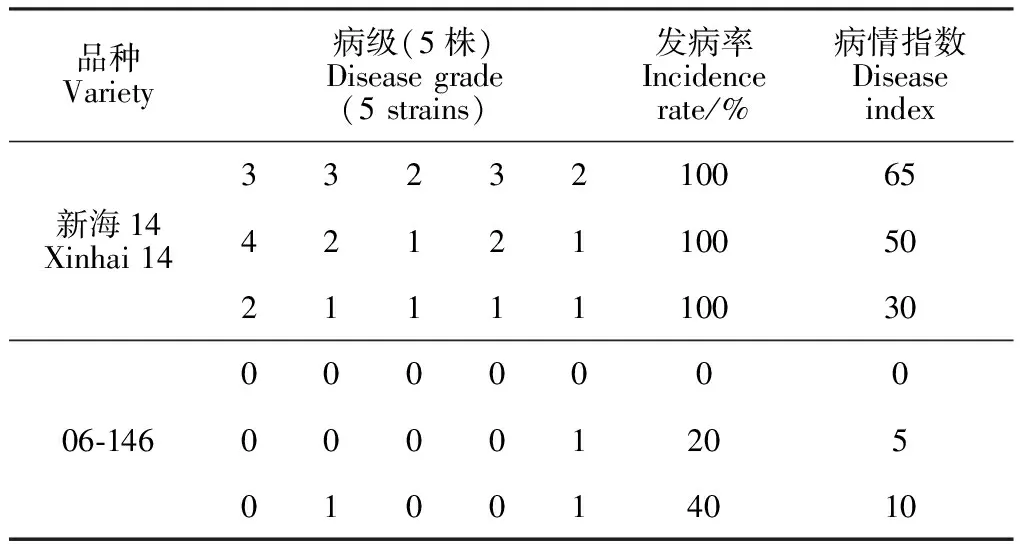
表2 室内抗枯萎病鉴定结果
2.2 目的基因片段的获得
以06-146的cDNA为模板,利用表1中GSTU7的上下游引物进行PCR扩增,得到711 bp的目的片段(图2)。PCR产物纯化后连接到Trans-T1载体上(图2,A),通过含有50 ng·μL-1卡那霉素的LB 固体培养基筛选获得阳性克隆菌落(图2,B),通过菌液PCR可以看到含有711 bp的目的条带(图2,C),送往上海华大基因科技有限公司测序。序列测定与分析表明,海岛棉GSTU7基因含有1个711 bp的开放阅读框,编码236个氨基酸(图1)。

图1 海岛棉GSTU7基因的核苷酸序列及其编码的氨基酸序列Fig.1 The nucleotide sequence of GSTU7 gene of Island cotton and its encoded amino acid sequence
2.3 GSTU7的氨基酸序列和理化性质分析
GbGSTU7蛋白的预测分子式是 C1263H1960N324O351S5,相对分子量约为27.5 ku,等电点7.84。该蛋白中含量最多的氨基酸是赖氨酸,占氨基酸总数的9.7%,带正电荷总体氨基酸残基(Arg+Lys)数和带负电荷总体氨基酸残基(Asp+ Glu)数分别为33个和32个。亲水性平均数-0.314,推测其为亲水蛋白。不稳定系数33.48,是不稳定蛋白。对该蛋白进行跨膜区和信号肽分析发现 GSTU7蛋白不含信号肽,不存在跨膜区。将GbGSTU7基因的氨基酸序列进行 BLAST比对,结果显示,该蛋白属于tau类 GST 蛋白。将家族成员基因的蛋白序列载入MAGA-X,使用classX方式完成多序列比对,采用临近法完成系统发生树的构建(图3)。由进化树可见:该基因家族共鉴定到32个成员共分为3类。第一类共有4个基因成员,第二类共有4个基因成员,第三类共有24个基因成员,GbGSTU7(GB_A03G0575)属于该家族第三类成员。将该基因序列进行功能预测,预测该基因可能被水杨酸诱导,与还原型谷胱甘肽与大量外源和内源性疏水亲电试剂的结合有关,并且对某些除草剂具有解毒作用,与植物生长发育相关,可能参与的KEGG途径有谷胱甘肽代谢和毒素分解代谢过程。
依据氨基酸序列多重比对结果将该蛋白分别与古巴棉(Gossypiumbarbadense) KAB2038401.1、澳洲棉(Gossypiumaustrale)KAA3456760.1、橡胶(Heveabrasiliensis)XP_021652560.1、等植物中的GSTU7基因编码蛋白做多序列比对并进行同源性分析,发现海岛棉GSTU7基因编码的蛋白序列与亚洲棉、陆地棉、雷氏棉等GSTU7氨基酸序列相似性较高,分别是100%、98.23%、97.88%,与黄连、荔枝、橡胶等物种的GSTU7氨基酸序列相似性较低,均在65%以下(图4)。
2.4 海岛棉GSTU7的生物信息学分析
对海岛棉GSTU7基因推导的氨基酸序列进行疏水性/亲水性分析,结果表明该蛋白为亲水蛋白。该蛋白第174位的缬氨酸(Val) 亲水性最强,其次为第170和第171位的丙氨酸(Ala) 和异亮氨酸(Ile);疏水性最强的位点为第16位的谷氨酸(Glu),其次为第14的天冬氨酸(Asp) (图5)。该蛋白二级结构包含5个β-折叠和9个α-螺旋,三级结构空间结构像呈球状。海岛棉GSTU7基因与毛棉、陆地棉,亚洲棉,雷蒙德氏棉亲缘关系较近,与荔枝、柑橘等亲缘关系较远。海岛棉、毛棉的GST属于同一分支,古巴棉、陆地棉、雷氏棉、海岛棉、毛棉、亚洲棉、澳洲棉均属于同一分支,荔枝、柑橘的GST属于同一分支,橡胶、黄连的GST属于同一分支(图6)。亚细胞定位预测结果显示,发现该蛋白既可在细胞质中表达,也可在细胞核中表达。

M.DL2000;A.1.PCR纯化产物;2.目的基因连接Trans-T1载体之后的质粒;B.1-3.阳性克隆菌落;C.1-8.菌液PCR结果;D.1.目的片段 图2 海岛棉GSTU7 基因 PCR 产物电泳分析M. DL2000; A. 1. PCR purified products; 2. The plasmid after the target gene was attached to the trans-T1 vector; B.1-3. Positive colonies; C.1-8. PCR results of bacterial fluid; D.1. Target fragmentFig.2 Electrophoresis analysis of PCR products of Island cotton GSTU7 gene
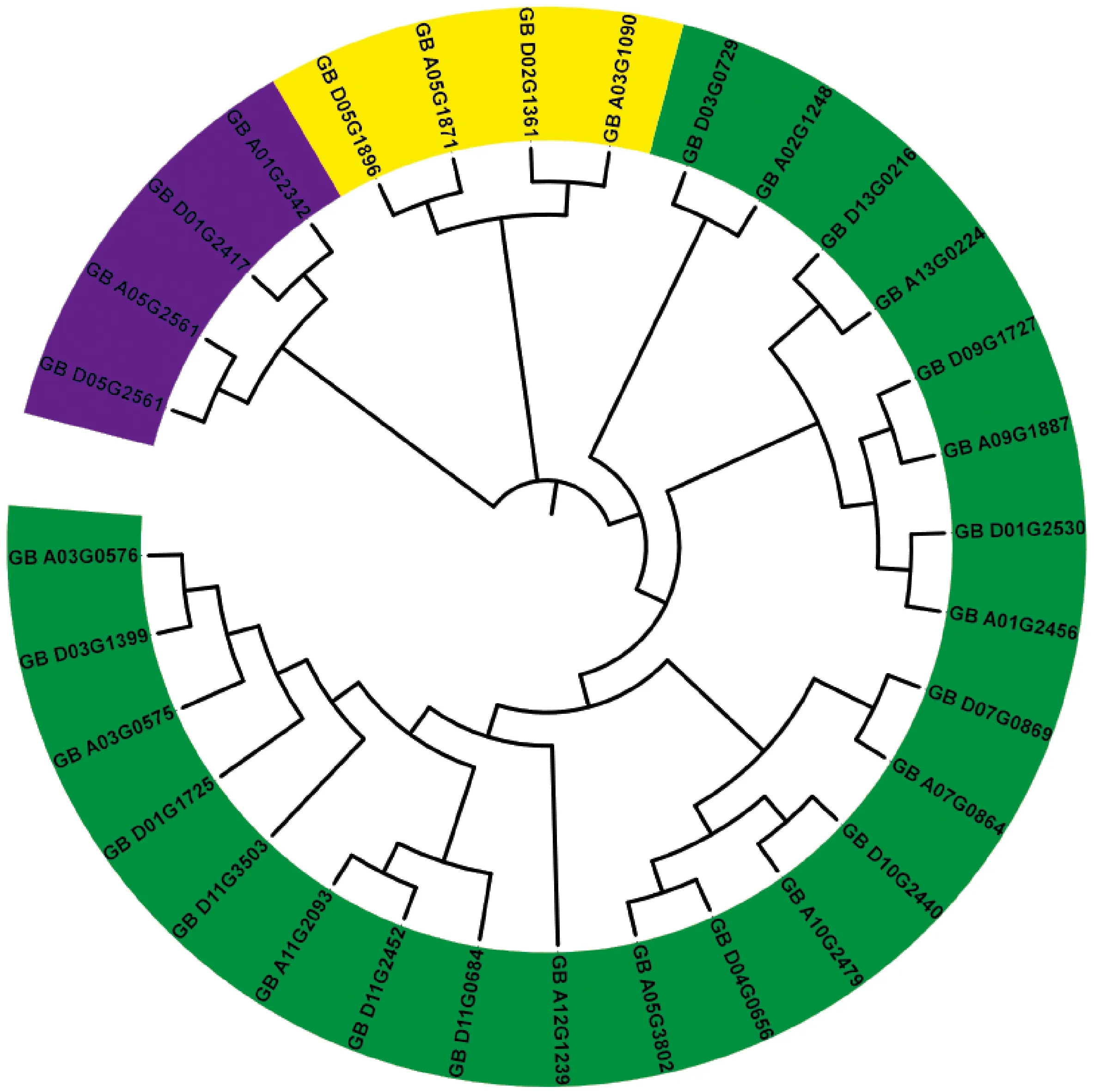
海岛棉H7124数据库中GST_N_3基因家族成员图3 家族系统发生树Registration numbers are GST_N_3 gene family members in H7124 database of Island cottonFig.3 Family phylogenetic tree
2.5 枯萎病菌侵染后海岛棉GSTU7基因的表达分析
由图7可知,正常条件下,海岛棉GSTU7基因在棉花的根、茎和叶中均有表达。
图7,A、B显示,在根中,‘新海14’(感病材料)该基因响应缓慢,06-146(抗病材料)接菌后立即上调响应,而‘新海14’(感病材料)到24 h才上调表达对抗。接菌后,该基因的表达量在06-146(抗病材料)的各组织中表现出有规律的先上升后下降,根、茎、叶中依次表达,表现出与病菌传播途径一致的方向,表明该基因起到了正面抵抗作用。‘新海14’(感病材料)则不同,在根中响应缓慢,在茎和叶中呈上升-下降-上升-下降的变化,表现出盲抗反应,对病菌扩散未起到持久抑制作用。

GB_A03G0575.1. 海岛棉;KAB2038401.1. 古巴棉;KAA3456760.1. 澳洲棉;XP_021652560.1. 橡胶;KDO66687.1. 柑橘;XP_031286334.1. 黄连;EOY33900.1. 可可;XP_012471261.1. 雷氏棉;ALY05896.1. 荔枝;XP_016740535.1. 陆地棉;TYI35251.1. 毛棉;XP_017641138.1. 亚洲棉;KAE8705650.1. 木槿;AT2G29420.1. 拟南芥; 图6同图4 海岛棉GSTU7与其他植物 GSTU7氨基酸序列的多重比对GB_A03G0575.1. Gossypium barbadense L; KAB2038401.1. Gossypium barbadense; KAA3456760.1. Gossypium australe;XP_021652560.1. Hevea brasiliensis; KDO66687.1. Citrus sinensis; XP_031286334.1. Pistacia vera; EOY33900.1. Theobroma cacao; XP_012471261.1. Gossypium raimondii; ALY05896.1. Litchi chinensis; XP_016740535.1. Gossypium hirsutum;TYI35251.1. Gossypium tomentosum; XP_017641138.1. Gossypium arboreum; KAE8705650.1. Hibiscus syriacus; AT2G29420.1. Arabidopsis thaliana; The same as Fig.6Fig.4 Multiple alignment of the amino acid sequences of Island cotton GSTU7 and other plant GSTU7
图7,C-E显示,在06-146(抗病材料)中,随着接菌时间的延长,GbGSTU7基因在根中的表达量呈下降趋势,在茎和叶中的表达量均呈先上升后下降的趋势,且在处理24 h时茎的表达量达到最高。接菌24 h时,海岛棉GSTU7基因在茎和叶中的表达量较接菌4 h有明显上升,但根中的表达量明显下降。在‘新海14’(感病材料)中,枯萎病菌侵染后4 h时,海岛棉GSTU7基因在根和茎中的表达量较0 h无明显变化,但在叶片中的表达量达到最高,随着接菌时间的延长,海岛棉GSTU7基因在‘新海14’(感病材料)根中的表达量呈下降-上升的趋势,叶中的表达量呈上升-下降-上升的趋势,且在处理8 h时茎的表达量达到最高。

Val. 缬氨酸;Glu. 谷氨酸图5 海岛棉GSTU7 氨基酸序列的亲水性和疏水性分析Val. Valine acid;Glu. Glutamic acidFig.5 Hydrophilicity and hydrophobicity analysis of GSTU7 amino acid sequence of Island cotton
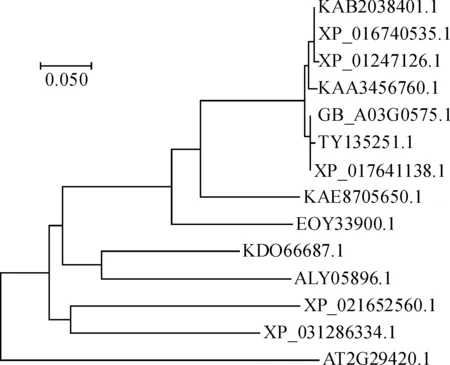
图6 海岛棉与其他植物 GSTU7 氨基酸序列的系统进化树Fig.6 Phylogenetic tree of GSTU7 amino acid sequences of Island cotton and other plants
3 讨 论
前人研究表明,植物在遭遇逆境胁迫时,其体内的活性氧含量会大量升高,会对细胞结构和代谢物质造成氧化伤害,严重影响甚至扰乱植物的正常生长、发育和代谢[15-16]。清除活性氧的过氧化物酶系在生物体内普遍存在,包括谷胱甘肽过氧化物酶(glu-tathione peroxidase,GPX)、超氧化物歧化酶(superoxide dismutase,SOD) 、过氧化氢酶(catalase, CAT)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX),能够有效地清除植物体内的活性氧及其他自由基,消除细胞内的有害代谢物质,从而保护植物免受或减缓伤害[17]。其中,GST作为一个大的基因家族,在植物生长发育、响应环境变化的过程中发挥重要的调节作用[18]。GSTs对生长素和细胞分裂素有很高的亲和力,在茄属植物中,受病原真菌侵染的植物表现GST含量随着细胞内生长素水平的增加而快速增加[19],这表明GSTs在激素稳态和植物抵御病原菌中起着重要作用[20]。抗黄萎病棉花品种‘农大601’,在病毒诱导基因沉默抑制GST基因簇后极易感病,这表明GST簇在黄萎病抗性中起重要作用[21]。因此,研究GST有助于阐明植物生长和抵御胁迫的分子机制,对改善胁迫下植物的生存能力具有实际意义。
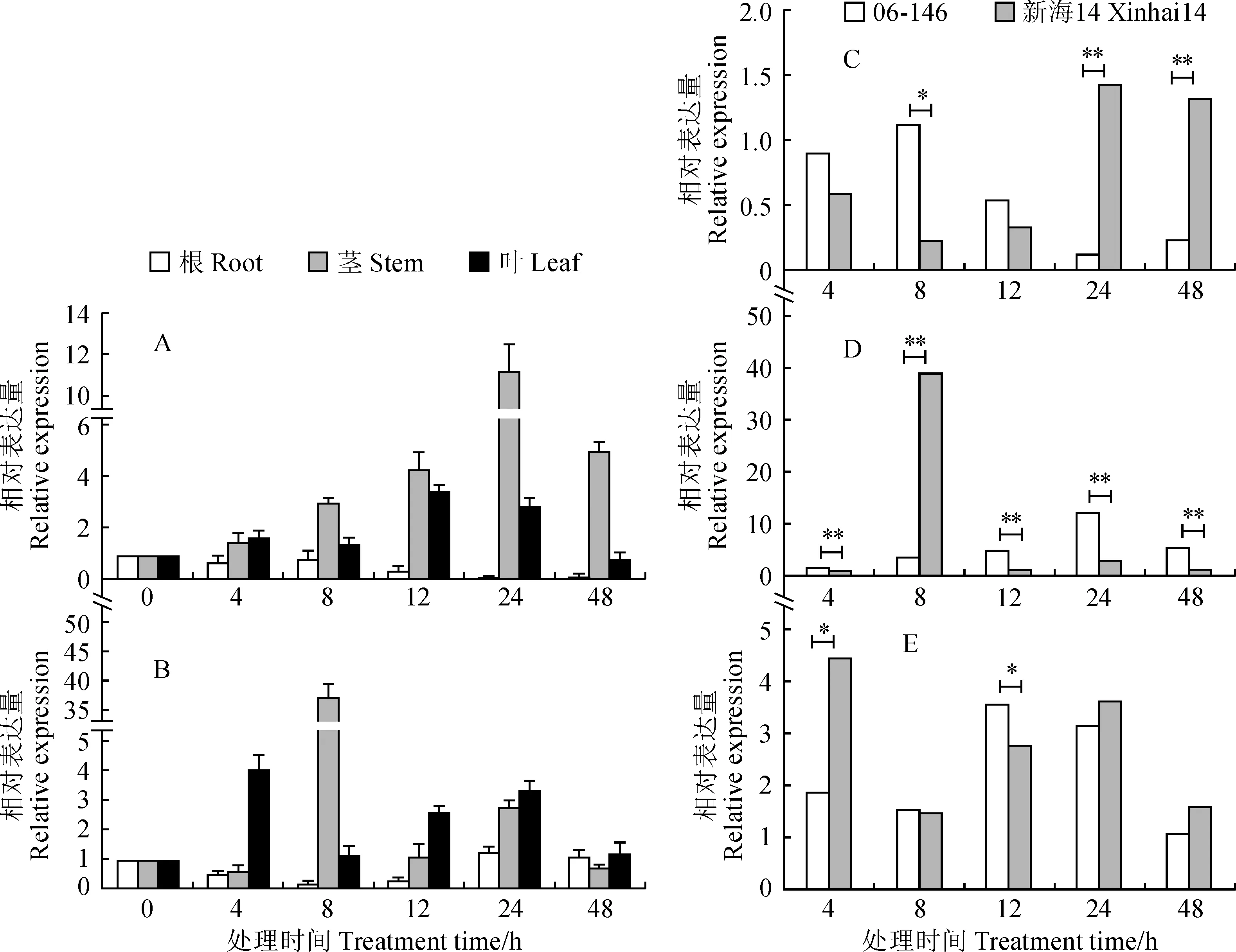
A.06-146;B. 新海14;C.根;D.茎;E.叶; *表示P<0.05,**表示P<0.01图7 海岛棉GSTU7基因在枯萎病菌侵染后不同材料及组织的表达A. 06-146; B. Xinhai 14; C.Root;D.Stem; E. Leaves. * Indicates P<0.05, ** Indicates P<0.01Fig.7 Expression of GSTU7 gene of Island cotton in different materials and tissues after infection by Fusarium wilt
GSTs一般以25~27 kD的2条亚基的同源或异源方式聚合而成,每个亚基都含有2个空间结构不同的结构域:N端由β折叠和α螺旋构成;C端主要由α螺旋构成[18]。本研究克隆获得的海岛棉GSTU7基因属于tau类GST家族成员,其编码的蛋白质与其他物种中GST序列相似性较低,但在结构上相对保守,N端具有保守的结合谷胱甘肽的G位点,C端的H位点可结合疏水底物[5],在空间结构上与前人研究结果类似,N端主要由β折叠和α螺旋构成(βαβαββα),C端由6个α螺旋构成,通过1个约11个氨基酸的短序列与N端结构域连接。
研究发现,玉米中大多数GST基因在根中表达水平较高,而在其他组织中表达相对较低[22]。本研究中,海岛棉GSTU7基因在棉花各组织中表达差异明显,茎中的表达量最高,其次是叶,在根中的表达量较低,呈现明显的组织特异性。前人研究表明,干旱、真菌攻击、盐胁迫等均能诱导GSTs的表达[21, 23-25]。过表达大豆GmGSTL基因提高了烟草和拟南芥在盐胁迫下的存活率[7]。拟南芥中过表达番茄GST基因增强了其在盐胁迫和干旱胁迫条件下的生长势[26]。烟草过表达GhGST结果表明,转基因烟草植株对黄萎病的抗性明显增强,棉花抗病品种在病毒诱导基因沉默抑制GST基因簇后极易感病[21]。这表明,GSTs 在植物抵御不良环境和损伤等方面也起着重要作用。
本研究结果表明,克隆的海岛棉GSTU7基因属于GST家族tau类成员,枯萎病菌侵染后,该基因在抗病材料06-146和感病材料‘新海14’的各组织均可响应诱导,并且在根、叶中均存在显著差异,茎中存在极显著差异。在抗病材料06-146茎中的表达量最高,其次是叶,在根中的表达量较低,具有明显的组织特异性。说明该基因可在植物体遭受枯萎病菌侵染时,各组织随着病原菌的扩散做出应答,推测其可能与棉花抗枯萎病有着密切的关系,可能在棉花抵御病菌侵染的过程中发挥重要的调控作用,但其具体的作用机制还有待进一步研究。本研究结果为鉴定海岛棉GSTU7基因功能奠定了一定的理论基础。
