葡萄VvIQD10果形相关基因定位及其互作研究
2021-07-28农慧兰陶建敏
余 欣,董 阳,刘 静,农慧兰,郑 焕,陶建敏
(南京农业大学 园艺学院, 南京 210095)
葡萄(VitisL.)是一种被广泛种植的水果作物[1],可以为人类的日常饮食提供纤维素、维生素和抗氧化剂等丰富的营养物质[2]。这些丰富的营养成分是葡萄的内在品质,而葡萄的外在品质对于水果作物葡萄来说也格外重要,果实形状就是葡萄重要的外在品质之一。多种多样的葡萄果形,在一定程度上影响了葡萄的经济价值及消费选择[3]。根据葡萄不同果形特性,将葡萄果粒形状分为11种:扁圆形(obloid)、圆形(round)、近圆形(nearly round)、椭圆形(broad lipsoid)、长椭圆形(narrow lipsoid)、卵圆形(ovoid)、倒卵圆形(obovoid)、鸡心形(heart-shape)、束腰形(waist shape)、弯形(curved shape)和圆柱形(cylindric)[4]。其中,弯形和束腰形品种屈指可数[4],如‘美人指’为束腰形,‘金手指’为弯形[5];而长椭圆形、倒卵圆形、扁圆形和鸡心形等果形的品种数量较少,最为常见的是椭圆形[4]。果实是植物器官之一,而植物器官的形状主要受单个细胞的几何形状及其细胞分裂和生长轴的方向控制,所有这些过程都高度依赖于微管(microtubules, MT)动力[6]。
IQ67结构域(IQ67 domain, IQD)蛋白家族是一种古老的钙调素结合蛋白(calmodulin binding proteins, CaMBPs),起源于陆地植物的早期进化过程[7]。拟南芥和水稻的IQD基因系统发育分析表明,主要的IQD基因谱系起源于单子叶和双子叶植物分化之前[8]。IQD蛋白的显著特征是具有较高的等电点和丝氨酸残基频率[8],且编码的IQD蛋白中包含67个保守氨基酸残基的植物特异性结构域——IQ67结构域。IQ67结构域的特征是3种不同钙调素募集基序(IQ、1-5-10和1-8-14)的独特和重复排列。IQD蛋白家族被认为是潜在的控制微管动态性、稳定性和组织性的微管相关网络蛋白(microtubule-associated network protein, MAP)家族,对环境的适应性和植物的发育起重要作用。微管是细胞骨架的重要组成部分,微管相关蛋白网络控制微管的动态性、稳定性和组织性以生成各种微管阵列[9-10],从而使细胞骨架形成一个高度动态的网络。微管阵列作为结构支撑附着在质膜(plasma membrane, PM)上[11],并通过引导纤维素合成酶复合物(cellulose synthase complex, CSCs)来确定细胞扩张的方向[12]。微管细胞骨架还介导了不同物质的胞内运输[13-14],并且有助于胞吐作用[15-18]。研究表明,Ca2+信号的传导可以激活细胞骨架组织相关蛋白钙调蛋白/钙调蛋白类蛋白(calmodulin/calmodulin-like proteins, CaM/CML)从而调节翻译后的IQD功能[19]。Ca2+-CaM/CML信号参与了对细胞骨架组织的控制过程[20]。IQD蛋白可以在发育中的植物组织中根据环境变化解析相应激素(如生长素)水平和Ca2+水平变化,从而使微管分支和细胞骨架结构发生变化,指导细胞的伸长和扩张,最终驱动器官形状变化[21]。在葡萄中,通过研究微管相关蛋白以解析果形变化分子机制的相关研究较少。
迄今为止,已经在多个物种(拟南芥、水稻和番茄等)中鉴定出IQD基因家族,并报道了IQD基因家族中多个成员的功能[8, 22-28]。IQD家族基因不仅在果实等器官形状的调控中起作用[29-32],还在干旱和盐胁迫等逆境响应[26-27]、赤霉素反应的负反馈调节[33]以及通过脱落酸信号通路调节种子的萌发[34]中起着重要作用,AtIQD1基因还被报道可以影响与硫代葡萄糖酸盐代谢相关的多个基因的表达,起到对生物攻击进行防御反应的作用[35]。据报道,在拟南芥和水稻中,IQD家族成员可以与CaM、CML和微管结合蛋白(KLCR1)及微管相关蛋白SPIRAL2(SPR2)相互作用,根据外源生长素和钙离子转运来调节微管结构[29, 36-37]。
番茄SUN/SlIQD12是IQ67结构域(IQD)蛋白质家族成员[31, 38]。SUN/SlIQD12是控制番茄(Solanumlycopersicum)果实伸长的主要基因之一[30],对果形的影响比OVATE基因要显著[39]。张亚光等[3]利用番茄SUN基因,在美国国家生物信息中心(NCBI)中查找葡萄基因组中序列相似性最高的同源序列,命名为VvSUN。本研究在前人研究[31-32]基础上,选择葡萄IQD基因家族中与葡萄VvSUN基因以及番茄SUN基因具有较高同源性的VvIQD10基因,通过比较6个不同葡萄果形品种VvIQD10基因的表达量推测该基因可能和葡萄果形相关,从椭圆形品种葡萄‘天山’中克隆出VvIQD10基因,对其进行序列分析,并利用烟草瞬时表达技术对VvIQD10蛋白进行亚细胞定位,对VvIQD10蛋白及其靶蛋白钙调素类蛋白(VvCML)互作关系进行研究,以期能够从基因角度解析VvIQD10基因促进细胞伸长,进而导致葡萄果形变化的分子机理。
1 材料和方法
1.1 试验材料
试验材料采于南京农业大学汤山葡萄试验基地,以束腰形品种葡萄‘美人指’、弯腰形品种葡萄‘金手指’、长椭圆形品种葡萄‘天山’和‘魏可’、近圆形品种葡萄‘阳光玫瑰’和‘红环’(图1)开花期花序为试验材料,采用平棚架避雨栽培,常规田间管理,以圆锥花序穗肩顶端小穗上一半的花开放为盛花期,分别在盛花期采集小穗,液氮速冻后-80 ℃保存备用;烟草为本氏烟草,生长于22~24 ℃长日照条件(光照16 h/黑暗8 h)的温室中。

图1 不同果形的葡萄品种Fig.1 Grape varieties with different fruit shapes
实验所需pCAMBIA1302-GFP植物表达载体、pGBKT7和pGADT7酵母载体、nEYFP和cEYFP双分子荧光互补试验(bimolecular fluorescence complementation test, BiFC)载体均为南京农业大学果树生物技术实验室现有保存材料;酵母菌株诱饵菌株Y2H Gold和捕获菌株Y187购自南京酶普利斯生物公司;大肠杆菌DH5α和根癌农杆菌菌株EHA105购于上海吐露港生物科技有限公司;中间载体pClone007 Blunt Simple购于北京擎科生物科技有限公司;DNA凝胶回收试剂盒和重组克隆试剂盒(ClonExpress®UltraOne Step Cloning Kit)购自南京诺唯赞生物科技股份有限公司;金担子素A(AbA)和α-半乳糖苷酶显色底物(X-α-gal)购自翊圣生物科技(上海)有限公司。
1.2 试验方法
1.2.1VvIQD10基因表达分析利用植物总RNA提取试剂盒(TIANGEN)分别提取‘美人指’、‘金手指’、‘天山’、‘魏可’、‘阳光玫瑰’和‘红环’葡萄盛花期花序总RNA,用反转录试剂盒(TaKaRa)进行cDNA合成。以cDNA为模板,使用Beacon Designer 7.0软件(Premier Biosoft Internaition, USA)设计的引物(表1)进行荧光定量PCR分析。反应体系按SYBR Green PCR Master Mix (TaKaRa)说明书进行。以VvUbiquitin为内参,由ABI 7300 system软件完成试验程序的操作和数据的导出,试验数据采用2-ΔΔCt方法进行分析[40],用Excel 2010和SPPSS 20.0软件进行作图和显著性分析。

表1 本研究中的引物序列
1.2.2VvIQD10基因及VvCML基因的克隆在NCBI中查找与番茄SUN(SlIQD12)基因和葡萄VvSUN(VvIQD7)进化关系较近的葡萄基因组IQD家族成员VvIQD10(XM_010647400)序列[31-32];查找相关文献[36],在NCBI中检索与水稻基因组IQD家族中SUN同源基因OsIQD14的靶基因OsCaM1(XM_015766855.2)在葡萄中的同源基因VvCML(XM_003632182.3)。用‘天山’葡萄花期花序cDNA为模板进行PCR扩增。PCR产物经琼脂糖凝胶电泳检测后,回收目的条带,连接到pClone007 Blunt Simple载体,转化至大肠杆菌DH5α后进行鉴定并测序。
1.2.3VvIQD10基因的生物信息学分析利用BioXM软件和ProtParam(https://web.expasy.org/prot param/)在线软件对VvIQD10基因所编码的蛋白质理化性质进行分析;ProtScale(https://web. expasy.org/protscale/)和SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP-4.0/)分别分析蛋白质的疏水性和信号肽;TMHMM Server v. 2.0(http://www.cbs.dtu.dk/ services/TMHMM/)预测蛋白质跨膜区域;SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page= npsa_sopma.html)和SWISS-MODEL(https:// swissmodel.expasy.org/)在线软件分别预测蛋白质二、三级结构;Pfam数据库(http://pfam.xfam.org/)分析蛋白质结构域;MEGA 10.0软件构建系统进化树;ClustalX软件比对不同物种的氨基酸序列。
1.2.4VvIQD10基因的亚细胞定位分析使用pCAMBIA 1302-GFP植物表达载体,用DNA连接酶(TaKaRa)连接目的基因和载体,构建pCAMBIA 1302-GFP-VvIQD10瞬时表达载体。以空载体为阴性对照,通过热击法将所得质粒转化至根癌农杆菌菌株EHA105中。将PCR检测为阳性的菌液过夜培养至OD600为0.6后收集菌体。用含有10 mmol·L-1MES、10 mmol·L-1MgCl2、100 μmol·L-1乙酰丁香酮(As)的悬浮液重悬菌体至OD600为0.3,室温避光孵育4 h。选择长势一致的4周龄本氏烟草,用无菌注射器吸取菌液注射,置于25 ℃的环境中(黑暗48 h/光照12 h)培养60 h,在Zeiss LSM 700激光共聚焦显微镜下观察绿色荧光蛋白信号分布。
1.2.5 酵母双杂交实验根据重组克隆试剂盒说明书,构建诱饵载体pGBKT7-VvIQD10/VvCML、猎物载体pGADT7-VvIQD10/VvCML。将重组载体质粒分别转化Y2H Gold和Y187酵母菌株,30 ℃暗培养3~5 d,观察菌落生长状况,检测重组质粒对酵母的毒性作用;观察Y2H Gold[pGBKT7-VvIQD10/VvCML]在不同浓度(0、50、100、150和200 μL/mL)AbA的SD/-Trp固体培养基上的生长状况进行诱饵载体的抗性筛选;将Y2H Gold[pGBKT7-VvIQD10/VvCML]涂布在SD/-Trp、SD/-Trp-Leu、SD/-Trp/X-α-gal、SD/-Trp/X-α-gal/AbA固体培养基上,Y187[pGADT7-VvIQD10/VvCML]涂布在SD/-Leu、SD/-Trp-Leu、SD/-Leu/X-α-gal、SD/-Leu/X-α-gal/AbA固体培养基上,观察菌落生长状况以判断重组质粒是否具有转录自激活活性。在双杂交实验中,将诱饵质粒和猎物质粒共转化进Y2H Gold酵母菌株,涂布于SD/-Trp-Leu固体培养基,30 ℃暗培养3~5 d。待菌落长出后,将共转化成功的阳性单菌落挑出,加入SD/-Trp-Leu液体培养基中,在30 ℃、200 r·min-1条件下振荡培养12~15 h,稀释至OD600为0.2时再依次稀释5倍、50倍,取2 μL点到SD/-Trp-Leu-His-Ade、SD/-Trp-Leu-His-Ade/AbA/X-α-gal培养基上,30 ℃暗培养3~5 d,观察菌落生长情况。
1.2.6 双分子荧光互补试验构建双分子荧光瞬时表达载体VvIQD10/VvCML-cEYFP和VvIQD10/VvCML-nEYFP。将构建好的载体与空载两两组合瞬时侵染烟草表皮细胞,农杆菌转化、侵染方法及观察同VvIQD10基因的亚细胞定位实验。
2 结果与分析
2.1 不同葡萄品种的VvIQD10基因PCR分析
以‘美人指’、‘金手指’、‘天山’、‘魏可’、‘红环’和‘阳光玫瑰’葡萄盛花期花序cDNA为模板,分别进行实时荧光定量PCR分析。结果(图2)显示,VvIQD10基因在不同果形葡萄品种中均有表达。果形相对较长的‘美人指’、‘金手指’、‘天山’和‘魏可’表达量较高,近圆形品种‘阳光玫瑰’和‘红环’的基因表达量明显较低。

Sm.阳光玫瑰;Rr.红环;Gf.金手指;Wi.魏可;Ti.天山;Mf.美人指。不同字母表示品种间差异显著(P<0.05)图2 不同葡萄品种中VvIQD10基因的表达Sm. Shine muscat; Rr. Red ring; Gf. Gold finger; Wi. Wink; Ti. Tianshan; Mf. Manicure finger. Different letters mean significant differences in different grape varieties at 0.05 levelFig.2 Expression of VvIQD10 gene in different grape varieties
2.2 葡萄VvIQD10、VvCML基因的克隆和VvIQD10基因序列分析
以‘天山’葡萄为材料,扩增出VvCML,片段长度为450 bp(图3,A)。进一步克隆出了VvIQD10(图3,B),测序并通过DNAMAN 8.0软件将得到的序列与预测序列(XM_010655617.1)进行比对,结果显示CDS区序列长度一致,长度为1 401 bp。起始密码子为ATG,终止密码子为TAG(图4)。与NCBI中相比,第354位、510位、799位、814位核苷酸发生突变,分别由CAT、AGT、ATC、GAA突变成AAT、GGT、GTC、CAA,前两者编码的氨基酸并没有发生变化,而后两者编码的氨基酸分别由异亮氨酸、谷氨酸转变成缬氨酸和谷氨酰胺(图4)。

M.DL2000;1. VvIQD10;2-4. VvCML 图3 VvCML基因和VvIQD10基因克隆结果Fig.3 The result of VvCML and VvIQD10 gene cloning

ATG. 起始密码子;TAG. 终止密码子;方框内为突变位点图4 VvIQD10基因的核苷酸序列及其编码的氨基酸序列ATG. Start codon;TAG. Stop codon;The mutation sites are in the boxFig.4 Nucleotide sequence and amino acid sequence of VvIQD10 gene
2.3 葡萄VvIQD10蛋白分析
VvIQD10基因编码蛋白质由466个氨基酸组成,其中酸性氨基酸有56个,碱性氨基酸有85个。预测编码产物分子量为52.94 kD,等电点为10.64,不稳定系数为80.25,为不稳定亲水性蛋白。SignalP 4.0预测结果显示该蛋白无信号肽。用TMHMM Server V. 2.0在线软件对跨膜结构进行预测发现该蛋白不具有跨膜区域。Pfam数据库分析显示,VvIQD10蛋白第136~154、160~174氨基酸位点为IQ基序,第354~428位点为未知功能的DUF4005结构域,第381~426位点和第236~326位点分别为具有类IQ基序的融合蛋白IQCJ-SCHIP1 和NADH泛醌氧化还原酶亚单位NDUFA12。结合相关文献[3,8]查找分析相关基序,发现其具有包含2个IQ基序、3个1-5-10基序以及2个1-8-14基序的IQ67结构域(图6)。二级结构预测结果显示VvIQD10蛋白由46.78%的α螺旋,50.21%的随机卷曲,2.58%的β折叠和0.43%的β转角组成。三级结构预测显示该蛋白由一个PDB号为2dfs.1.A的结构为模板建立,序列的相似性为0.3,范围为134~194 aa,在IQ67结构域所包含的区域内。

图5 葡萄和其他物种IQD蛋白的氨基酸序列系统进化树Fig.5 Phylogenetic tree of amino acid sequences of IQD protein in grape and other species

图6 VvIQD10基因中IQ67基序分析Fig.6 Analysis of IQ67 motif in VvIQD10 gene
用MEGA 10.0制作进化树,将VvIQD10蛋白和其他物种的IQD蛋白进行比对,发现该蛋白与猕猴桃同源蛋白的亲缘关系最近,和拟南芥、豌豆及甜橙等植物的亲缘关系较远(图5)。ClustalX比对分析后得出VvIQD10编码的氨基酸序列与多种植物的相似度在43.29%~62.34%之间,IQ67结构域在不同物种间较为保守(图7)。
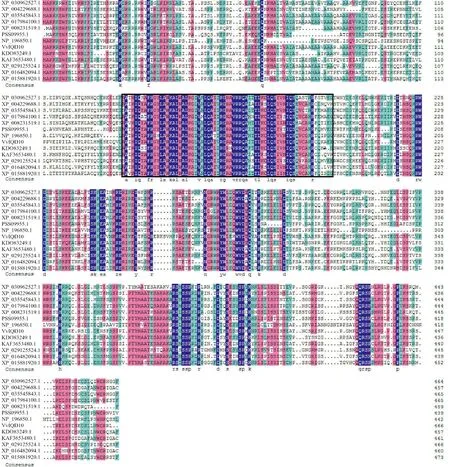
XP_030962527.1. 大叶栎;XP_004229688.1. 番茄;XP_035545843.1. 胡桃;XP_017984100.1. 可可;XP_008231519.1. 梅;PSS09955.1. 猕猴桃;NP_196850.1. 拟南芥;KDO83249.1. 甜橙;KAF3653480.1. 甜椒;XP_029125524.1. 木豆;XP_016482094.1. 烟草;XP_015881920.1. 枣;黑色方框内为IQ67结构域图7 葡萄VvIQD10蛋白和其他物种IQD蛋白的氨基酸序列比对XP_030962527.1. Quercus lobata; XP_004229688.1. Solanum lycopersicum; XP_035545843.1. Juglans regia; XP_017984100.1. Theobroma cacao; XP_008231519.1. Prunus mume; PSS09955.1. Actinidia chinensis var. chinensis; NP_196850.1. Arabidopsis thaliana; KDO83249.1. Citrus sinensis; KAF3653480.1. Capsicum annuum; XP_029125524.1. Cajanus cajan;XP_016482094.1. Nicotiana tabacum; XP_015881920.1. Ziziphus jujuba; In the box is the IQ67 domainFig.7 Amino acid sequence alignment of grape VvIQD10 protein and other IQD proteins

Bar = 35 μm,下同图8 VvIQD10蛋白在烟草叶片表皮细胞中的亚细胞定位Bar = 35 μm, the same as belowFig.8 Subcellular localization of VvIQD10 protein in tobacco leaf cells
2.4 VvIQD10蛋白亚细胞定位
为研究VvIQD10蛋白在细胞中的分布情况,在烟草表皮细胞中进行亚细胞定位实验。构建表达载体pCAMBIA 1302-GFP-VvIQD10,瞬时转化烟草。结果表明,VvIQD10蛋白在烟草表皮细胞的细胞质和细胞膜中都有分布,在细胞中可见微管清晰的丝状结构。而在以pCAMBIA 1302空载体转化的对照组中,绿色荧光蛋白在细胞的各个部位都有分布(图8)。由此可初步判定,VvIQD10蛋白主要定位于微管和质膜。
2.5 VvIQD10和VvCML蛋白互作验证
为验证VvIQD10基因在植物细胞中所起的作用,构建了诱饵载体pGBKT7-VvIQD10/VvCML、猎物载体pGADT7-VvIQD10/VvCML。将重组载体质粒分别转化酵母菌株后进行重组质粒的毒性检测和自激活检测,证明重组诱饵质粒和猎物质粒均对酵母没有毒性作用,且pGADT7-VvIQD10、pGADT7-VvCML不具有转录激活活性;为抑制诱饵载体酵母生长,通过抗性筛选后选择150 μL/mL AbA浓度为抑制诱饵载体pGBKT7-VvCML酵母生长最佳浓度,200 μL/mL AbA浓度为抑制诱饵载体pGBKT7-VvIQD10酵母生长最佳浓度。双杂交实验结果显示,诱饵载体和猎物载体共转化的Y2H Gold酵母菌株能在SD/-Trp-Leu培养基上长出白色单菌落;Y2H Gold [pGADT7-VvIQD10+pGBKT7-VvCML]、Y2H Gold [pGADT7-VvCML+pGBKT7-VvIQD10]和阳性对照在SD/-Leu/-Trp/-Ade/-His、SD/-Leu/-Trp/-Ade/-His/X-a-gal/AbA培养基上能够生长,且在SD/-Leu/-Trp/-Ade/-His/X-a-gal/AbA培养基上长出蓝色单菌落,而阴性对照在这两种培养基上不能够生长。说明蛋白VvIQD10与蛋白VvCML之间存在互作(图9)。
2.6 双分子荧光互补试验
为验证酵母双杂交的蛋白质互作结果,构建重组载体VvIQD10/VvCML-cEYFP和VvIQD10/VvCML-nEYFP以进行双分子荧光互补试验。将重组载体和空载体两两组合共转化烟草表皮细胞,利用共聚焦显微镜观察黄色荧光蛋白(yellow fluorescent protein, YFP)荧光图像,分别在光、明场和融合场中拍摄黄色荧光部位(图10)。结果表明,VvIQD10和VvCML蛋白间存在互作,此结果与酵母双杂交结果一致。并且,VvIQD10蛋白和VvCML蛋白主要在微管和质膜中互作,这和VvIQD10基因的亚细胞定位结果相吻合。
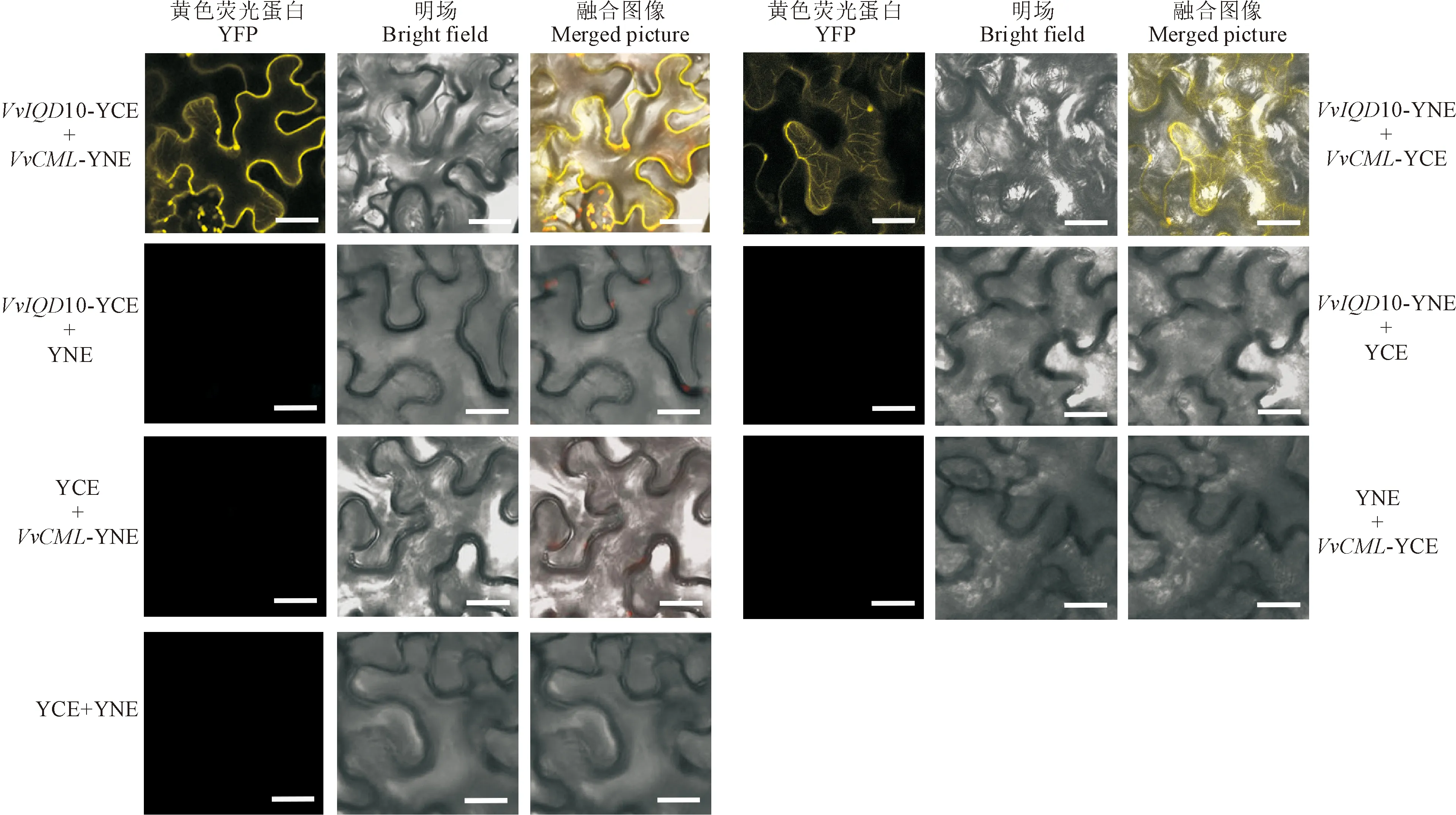
图10 烟草表皮细胞中VvCML蛋白与VvIQD10蛋白相互作用的BiFC分析Fig.10 BiFC analysis of the interactions among VvCML protein and VvIQD10 in tobacco epidermal cells
3 讨 论
本试验选取和葡萄VvSUN基因以及番茄SUN基因相似性较高的基因VvIQD10,通过比较6个不同葡萄果形品种VvIQD10基因的表达量推测该基因可能和葡萄果形相关,并在椭圆形葡萄品种‘天山’中克隆出该序列。与NCBI中预测基因相比,克隆出的VvIQD10基因发生了点突变,但突变位点不在功能结构域内,这可能是由于测序品种和试验品种不同造成的。通过分析VvIQD10蛋白的理化特性,发现其具有较高等电点,这和IQD家族蛋白的性质相吻合,其具有较高等电点可能是IQD蛋白与微管和质膜通过静电相互作用所必须具备的条件[29]。对VvIQD10蛋白的功能域IQ67结构域分析发现,其所含的基序种类和数目与VvSUN相同[3],但基序所包含的部分氨基酸种类发生了变化,这一变化可能影响蛋白的表达途径和作用强度。多序列比对和系统发育树分析结果显示,在葡萄、猕猴桃、烟草、番茄、甜椒、拟南芥、可可、梅、枣、胡桃和甜橙等十多种植物中,VvIQD10基因与猕猴桃同源基因亲缘关系最近,并且在13种植物中具有相似的保守结构域,说明IQD基因功能是相对保守的。
农杆菌介导法转化烟草细胞瞬时表达结果显示,VvIQD10蛋白同时定位于微管(MT)和质膜(PM),说明此基因编码的产物不仅在MT上有功能,而且在PM上起作用。前人研究表明,IQD蛋白是植物中PM子结构域的组成部分,它们可能将CaM/CML介导的Ca2+信号局部限制在PM中的特定位置,并在空间上将功能不同的CaM/CML信号模块分开[29]。
为进一步验证VvIQD10蛋白在微管和质膜上的作用,对其进行蛋白质互作实验。酵母双杂交和双分子荧光互补试验表明,VvIQD10蛋白可以和细胞骨架组织相关蛋白VvCML在微管和质膜中发生互作。IQD蛋白可能通过S-酰化作用附着于PM上,将IQD-CaM/CML复合物锚定在Ca2+通道入口处来激活通道。通道被激活后,在通道入口处附近产生陡峭的游离Ca2+浓度梯度,引起Ca2+传感器蛋白(CaM/CML)的激活。相关研究推测,与被激活的IQD信号复合物相结合的蛋白可能是驱动蛋白轻链相关(kinesin light chain-related, KLCR)/纤维素-微管解偶联(cellulose-microtubule uncoupling, CMU)蛋白家族的成员[7, 41-42]。KLCR / CMU可以在MT和PM的连接处通过抵抗MT对纤维素合酶复合物(CSCs)的推动力来增加MT的稳定性[43],并可能间接影响纤维素沉积。
由此可以推出,葡萄VvIQD10蛋白在特定的PM子结构域中和钙调蛋白类蛋白(CML)结合,形成VvIQD10-VvCML复合物,激活Ca2+通道后形成的Ca2+浓度梯度使VvCML被激活。随后,VvIQD10-VvCML复合物与微管结合蛋白结合(KLCR/CMU),来参与对细胞骨架组织的控制,从而改变微管分支和细胞骨架结构,指导细胞的伸长和扩张,最终使植物器官形状发生变化。根据前人对葡萄VvSUN基因超表达促进番茄果形变长的研究[32],再根据本试验中对与VvSUN基因同一家族中同源性较高的VvIQD10基因功能的研究结果,推测VvIQD10可能也在葡萄果实形状变化中起着至关重要的作用,但具体功能还需进行超表达和基因沉默来进一步验证。
