日本蛇根草DFR3基因的克隆分析及其编码蛋白的分离纯化
2021-07-28周娜娜孙世宇周洁羽
冯 猜,周娜娜,孙世宇,周洁羽,孙 威,2*
(1 贵州师范大学 生命科学学院/植物生理与发育调控重点实验室, 贵阳 550025;2 西南喀斯特山地生物多样性保护重点实验室, 贵阳 550025)
花色苷作为一种天然安全无毒的水溶性色素,广泛存在于植物的花、果实、根、茎、叶等器官的细胞中,通过赋予植物由红、紫红到蓝等不同的色调来吸引昆虫对其花粉进行传播。研究显示,植物中的花色苷除具有以上功能外,还具有一定的医疗药用价值,例如,降低血脂、抗氧化、预防糖尿病,同时还可用于心脑血管等疾病的治疗[1-3]。
二氢黄酮醇(dihydroflavonol) 是花色苷和黄酮醇合成途径的中间产物,同时也是二氢黄酮醇4-还原酶与黄酮醇合成酶的底物[4]。二氢黄酮醇4-还原酶 (DFR) 具有底物特异性,它以不同的二氢黄酮醇为底物将催化形成不同的花色苷,并且其功能的缺失将直接导致花色苷无法形成[5-7]。
日本蛇根草是一种直立的多年生草本植物,花冠近似漏斗形,茎为圆柱形,基部节上具少数须根。在中国四川、江西、台湾、贵州、云南等地均有分布。全草皆可药用,有止咳和祛痰的功效,对支气管炎、咯血、扭伤等治疗有显著效果[8-11]。但是,花色苷作为日本蛇根草重要的药用成分之一,关于其合成代谢的研究很少,并且关于其二氢黄酮醇4-还原酶的研究还未见报道。
因此,本研究对日本蛇根草花色苷合成途径中的关键酶——二氢黄酮醇4-还原酶进行研究,成功克隆获得其基因的全长cDNA序列,构建该基因原核表达载体,并通过实验完成其重组蛋白的制备与纯化,研究结果可为后续解析日本蛇根草二氢黄酮醇4-还原酶的功能奠定基础。
1 材料和方法
1.1 实验材料
日本蛇根草(Ophiorrhizajaponica)采自贵州省施秉县山区。
1.2 方 法
1.2.1 日本蛇根草总RNA提取与cDNA合成将日本蛇根草置于预冷的研钵中研磨成粉末,利用OminiPlant RNA Kit(DNase I)试剂盒(康为世纪生物科技有限公司),参照说明书完成其总RNA的提取,采用琼脂糖凝胶电泳以及核酸定量仪对RNA进行质量检测。检测合格后,取1 μg总RNA,利用逆转录试剂盒完成其cDNA的合成。
1.2.2OjDFR3基因的克隆以cDNA为模板,利用PCR仪对OjDFR3进行扩增,扩增程序为: 94 ℃预变性 8 min; 94 ℃变性 30 s, 54 ℃退火30 s, 72 ℃延伸65 s,33 个循环;72 ℃延伸 8 min。将PCR产物利用Gel Extraction Kit试剂盒回收预期目的片段后连接于pMD18-T载体,转化至大肠杆菌JM109后,经菌液PCR及酶切验证后,送公司测序,以确认日本蛇根草OjDFR3基因的核苷酸序列。
1.2.3OjDFR3基因生物信息学分析首先利用ORF finder在线分析软件预测OjDFR3基因的开放阅读框;通过Protparam(http://web.expasy.org/protparam/)对蛋白质理化性质进行分析;蛋白质的亚细胞定位通过PSORT(https://psort.hgc.jp/)进行分析;利用EXPASY(https://swissmodel.expasy.org/)对蛋白质进行结构预测及亲疏水性的分析;通过SignalP 5.0 Server(www.cbs.dtu.dk/services/SignalP)进行信号肽预测。
1.2.4 pET32a-OjDFR3原核表达载体的构建根据OjDFR3基因序列,利用Primer 5.0软件设计含有相应酶切位点的上下游引物F (CGGAATTC ATGAAAGATGTCAATGGT)和R(CGGAATTCATGAAAGATGTCAATGGT),进行原核表达载体的构建。首先利用上述引物克隆获得含有相应酶切位点的基因,然后将基因构建到pMD18-T载体上,测序确认无突变后,将该质粒对应的菌种及pET32a菌种扩大培养进行质粒提取。随后对pET32a质粒和T+OjDFR3质粒进行酶切与琼脂糖凝胶电泳验证,回收目的片段;将pET32a和OjDFR3胶回收产物,利用T4-DNA 连接酶在16 ℃金属浴中连接16 h。次日进行转化培养,经过菌液 PCR、酶切验证无误后,将阳性质粒送公司测序,并利用相关生物学软件对测序结果进行比对,以pET32a-OjDFR3命名测序正确的质粒。
1.2.5 重组蛋白诱导表达条件的确定1)pET32a-OjDFR3转化表达菌株BL21(DE3)。将测序正确的 pET32a-OjDFR3质粒转入大肠杆菌 BL21(DE3)感受态细胞中,置于37 ℃恒温培养箱培养,次日挑取单克隆培养进行菌液PCR和双酶切鉴定,将阳性克隆送公司测序,测序成功后用于下一步实验。
2)pET32a-OjDFR3在大肠杆菌BL21(DE3)中的诱导表达 取验证正确的单克隆菌液,接种于4 mL 氨苄霉素(Amp+)LB培养基中,将空菌BL21(DE3)、pET32a-BL21(DE3)和不加异丙基硫代半乳糖苷(IPTG)诱导的重组菌pET32a-OjDFR3-BL21(DE3)做空白和阴性对照,37 ℃摇床,200 r/min,振荡培养约2.5 h。加入4 μL 1 mol/L IPTG至其终浓度为1 mmol/L,37 ℃,继续诱导培养4 h。诱导结束后,从各管取出500 μL菌液于1.5 mL EP管中,离心弃上清。用80 μL 8 mol/L尿素重悬沉淀,置于4 ℃冰箱过夜处理,加入20 μL 5×上样缓冲液,混匀,于沸水中煮沸5 min,离心,进行SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)检测。
1.2.6 OjDFR3重组蛋白诱导表达条件的确定1)诱导表达时间的确定 取200 μL pET32a-OjDFR3-BL21(DE3)单克隆菌液接种于4管装有8 mL Amp+抗性LB培养基的离心管中,同时以pET32a-BL21(DE3)以及BL21(DE3)菌液做对照,置于37 ℃摇床,200 r/min,振荡培养约2.5 h后,向含pET32a-OjDFR3-BL21(DE3)菌液的3管离心管中,加入8 μL IPTG至终浓度为1 mmol/L,标记,将离心管置于37 ℃摇床分别培养4、6和8 h。将培养完成的菌4 ℃ 5 000 r/min 离心15 min,收集菌体后加入2 mL细胞裂解液将菌体悬浮,冰浴30 min,在冰浴条件下进行细胞超声破碎。离心后将沉淀用尿素充分溶解,室温过夜。次日以BL21(DE3)、pET32a-BL21(DE3)空载体、pET32a-OjDFR3-BL21(DE3)未诱导表达菌株做对照,进行SDS-PAGE电泳检测,确定最佳诱导时间。
2)诱导剂浓度的确定 在37 ℃最佳诱导时间下将重组菌分别在IPTG终浓度为0.2、0.4、0.6、0.8 和1.0 mmol/L条件下进行诱导,结束后收集菌体,样品处理方法同上,SDS-PAGE电泳检测确定最佳诱导剂浓度。
1.2.7 OjDFR3重组蛋白的分离与纯化按照1%接菌量,在最佳诱导条件下进行重组蛋白的大量制备。诱导结束后用50 mL离心管分装,4 ℃、6 000 r/min离心15 min,弃上清;每100 mL菌体中加入10 mL磷酸盐缓冲溶液(PBS)重悬菌液,随后冰浴30 min,超声破碎细胞。4 ℃、6 000 r/min 离心20 min,加入10 mL 8 mol/L尿素重悬并溶解菌体,室温过夜。次日4 ℃、6 000 r/min离心30 min,将上清过滤后用于过柱纯化。按照填料说明书完成镍柱的填装,分别称取0.040 848、0.102 12、0.204 24、0.408 48和1.021 20 g咪唑溶于30 mL 8 mol/L尿素中,将pH调至7.4,完成各个浓度咪唑洗脱缓冲液的配置。
首先用20 mmol/L PBS平衡镍柱,然后将10 mL含有目的蛋白的上清上样于镍柱中,重复上样3次,分别用浓度为20、50、100、200 和500 mmol/L咪唑洗脱缓冲液各洗10 mL,每个梯度每2 mL洗脱液收集1管,利用SDS-PAGE电泳验证后,收集电泳条带大小符合预期且条带较为单一的样品,随后分别用含有6、4、2 mol/L尿素的透析缓冲液,以及20 mmol/L PBS对蛋白进行透析,以除去尿素,使蛋白缓慢复性。透析完成后,将透析袋包埋于处于低温环境下的变色硅胶中,完成蛋白的浓缩。
2 结果与分析
2.1 OjDFR3基因的克隆
以cDNA为模板,对OjDFR3基因进行扩增。将PCR产物回收后进行跑胶验证,片段大小与目的基因大小一致。随后将回收产物连接于pMD18-T载体上,转化,挑取克隆进行菌液PCR及酶切验证,结果显示,电泳条带与目的基因大小一致 (图1)。
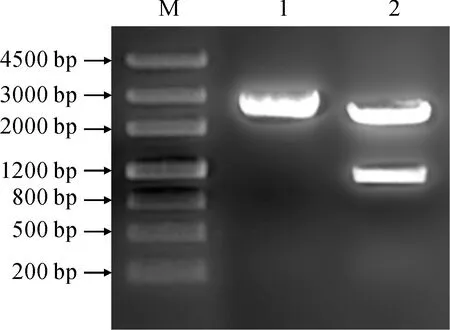
M. Marker Ⅲ; 1. T+OjDFR3质粒; 2. T+OjDFR3质粒酶切图1 OjDFR3基因的克隆M. Marker Ⅲ; 1. T + OjDFR3 plasmid; 2. T + OjDFR3 plasmid digestionFig.1 Cloning of OjDFR3 gene
同时测序结果显示,已成功克隆获得OjDFR3基因(图2),该基因开放阅读框长度为1 071 bp,可编码356个氨基酸,蛋白分子量为39.52 kD。

图2 OjDFR3基因核苷酸序列及其编码氨基酸序列Fig.2 Nucleotide sequence and amino acid sequence of OjDFR3 gene
2.2 OjDFR3的序列分析
利用Protparam对蛋白质的理化性质进行分析,结果显示,OjDFR3蛋白由20种氨基酸组成,其中亮氨酸含量最多。随后,利用SignalP5.0Server对OjDFR3进行信号肽预测,结果表明,该蛋白不存在信号肽;二级结构预测分析结果显示,其二级结构由α螺旋、延伸链、无规则卷曲组成,分别占比32.87%、10.96%,56.18%。
利用ProtScale对蛋白的亲水性与疏水性进行分析,结果显示,OjDFR3蛋白是一种亲水性蛋白;同时亚细胞定位分析表明,该蛋白分布在细胞质的可能性最大,占比为45%,而在其他部位定位的概率均低于细胞质;蛋白质三级结构预测分析结果显示,OjDFR3主要以不规则卷曲为主,占最大比率,其次是α螺旋,而延伸链占比最小,以上结果与二级结构预测相一致。
2.3 原核表达载体的构建
将成功引入酶切位点的T载体质粒及pET32a质粒进行酶切与胶回收,随后用T4-DNA连接酶进行连接,过夜培养后,进行菌液 PCR、酶切验证,结果如图3所示,酶切条带大小符合预期,并且测序结果也表明OjDFR3已成功插入pET32a原核表达载体。
2.4 重组质粒pET32a-OjDFR3在 BL21(DE3)中的表达验证
将测序正确的pET32a-OjDFR3质粒转入大肠杆菌BL21(DE3)中,过夜培养后挑取克隆进行菌液PCR及酶切验证,验证无误后,取BL21(DE3)、pET32a-BL21(DE3)和pET32a-OjDFR3-BL21(DE3)菌液各40 μL,接种于4 mL相应抗性的LB液体培养基。37 ℃、200 r/min,振荡培养2.5 h后,向各菌液中加IPTG诱导,阴性对照不加。样品处理后进行SDS-PAGE电泳检测,结果显示,加IPTG诱导后,目的蛋白条带明显变粗,表明pET32a-OjDFR3可以在BL21(DE3)中表达蛋白。
2.5 重组蛋白诱导表达条件的确定
pET32a-OjDFR3-BL21(DE3)加入IPTG后,分别在37 ℃条件下诱导 4、6、8 h。结果如图4,A所示,不同诱导时间下均产生明显的目的蛋白,且表达量差异不明显,所以确定最佳诱导时间为4 h。随后,进行不同IPTG浓度摸索,由图4,B可以看出,37 ℃诱导4 h终浓度为0.8 mmol/L IPTG的孔道蛋白条带较粗,所以选择在该浓度下对蛋白进行诱导表达。综上,pET32a-OjDFR3-BL21(DE3)重组蛋白最佳诱导表达条件为37 ℃、4 h,IPTG浓度为0.8 mmol/L。
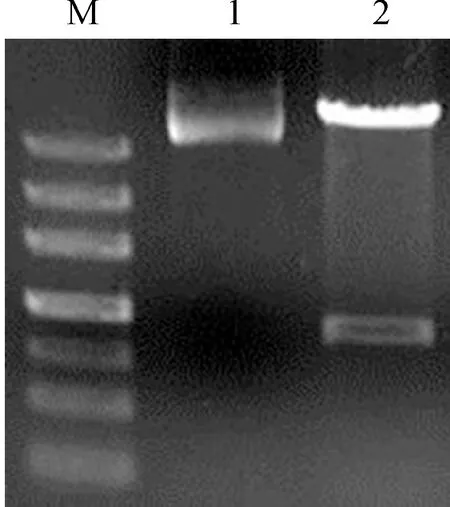
M. Marker Ⅲ; 1. pET32a-OjDFR3质粒; 2. pET32a-OjDFR3质粒酶切图3 重组质粒 pET32a-OjDFR3的构建M. Marker Ⅲ; 1. pET32a-OjDFR3 plasmid; 2. pET32a-OjDFR3 plasmid enzyme digestionFig.3 Construction of recombinant plasmid pET32a-OjDFR3

M. 蛋白分子量标准;A. 1. BL21(DE3)加IPTG; 2. pET32a加IPTG; 3. pET32a-OjDFR3 未加IPTG; 4-6. pET32a-OjDFR3加IPTG诱导4、6 和8 h;B. 1-3. 与A相同; 4-8. IPTG浓度为0.2、0.4、0.6、0.8、1.0 mmol/L图4 重组蛋白OjDFR3不同时间(A)及不同IPTG浓度(B)诱导表达M. Protein molecular weight marker; A. 1. BL21(DE3) with IPTG; 2. pET32a with IPTG; 3. pET32a-OjDFR3 without IPTG; 4-6. pET32a-OjDFR3 with IPTG induced for 4, 6, 8 h); B. 1-3. The same to A; 4-8. IPTG concentration 0.2, 0.4, 0.6, 0.8, 1.0 mmol/LFig.4 Expression of OjDFR3 recombinant protein induced at different time points (A) and IPTG concentration (B)
2.6 OjDFR3重组蛋白的分离及纯化
确定最佳诱导条件后对重组菌进行大量诱导表达,随后进行目的蛋白的分离与纯化。结果如图5所示,在100和200 mmol/L咪唑浓度洗脱液下,蛋白纯度最好,所以在此基础上收集条带单一的目的蛋白洗脱液,利用透析袋及变色硅胶对重组蛋白进行透析和浓缩。结果显示,成功制备并纯化获得浓度和纯度较好的重组蛋白(图6)。

M. Blue Plus III; A. 1. pET32a; 2. pET32a-OjDFR3 (未加IPTG); 3. 上样前; 4. 上样后; 5-6. PBS洗脱流出液;7-8. 20 mmol/L咪唑脱流出液; 9. 沉淀对照; B. 1-3、4-8. 分别为20、50 mmol/L咪唑洗脱流出液; 9. 沉淀对照; C. 1-5、6-8. 分别为100、200 mmol/L咪唑洗脱流出液; 9. 沉淀对照; D. 1-2、3-7.分别为200、500 mmol/L咪唑洗脱流出液; 8. 沉淀对照图5 重组蛋白OjDFR3不同咪唑浓度梯度洗脱M. Blue Plus III; A. 1. pET32a; 2. pET32a-OjDFR3 (without IPTG); 3. Before sample loading; 4. After sample loading; 5-6. PBS eluents; 7-8. 20 mmol/L imidazole eluents; 9. Precipitation control; B. 1-3, 4-8. 20 and 50 mmol/L imidazole eluents; 9. Precipitation control; C. 1-5, 6-8. 100 and 200 mmol/L imidazole eluents; 9. Precipitation control; D. 1-2, 3-7. 200 and 500 mmol/L imidazole elution, respectively; 8. Precipitation controlFig.5 Gradient elution of OjDFR3 recombinant protein with different imidazole concentrations
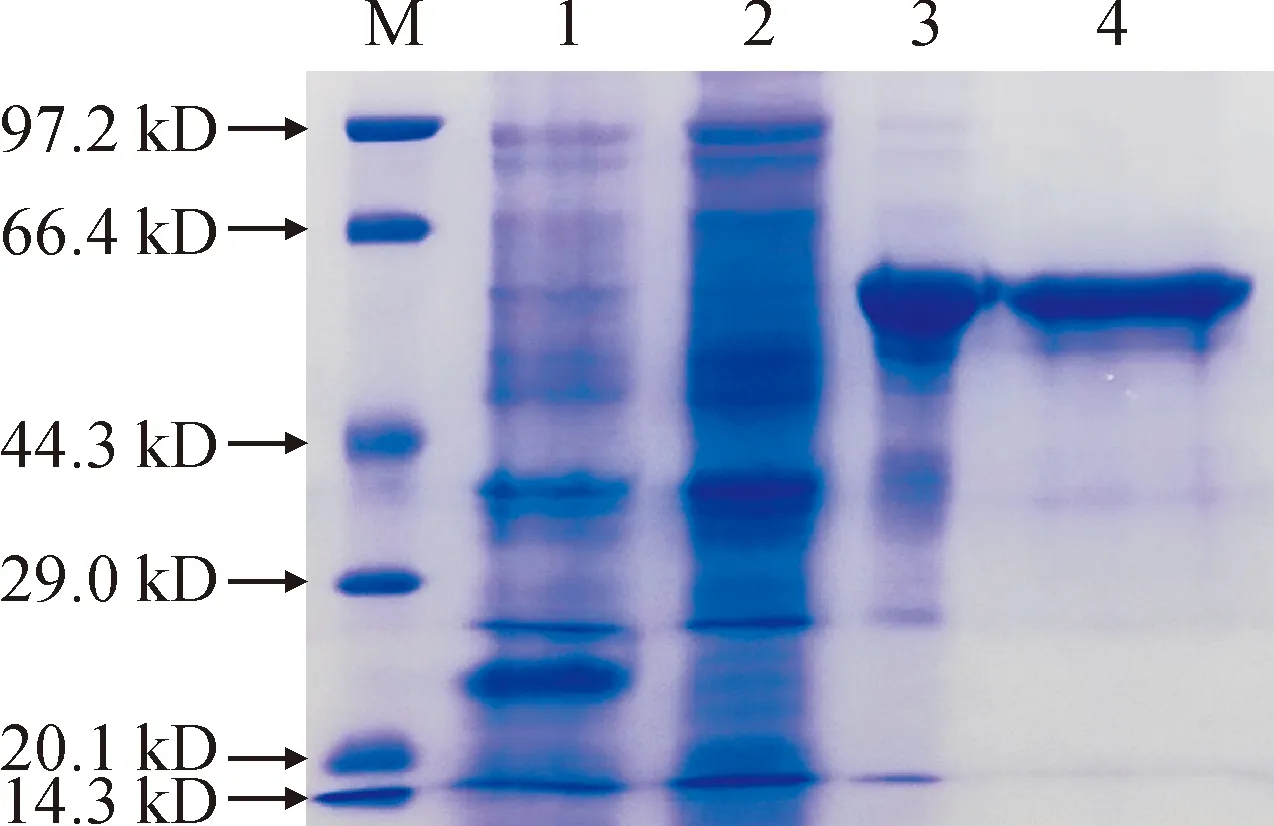
M. 蛋白分子量标准; 1. pET32a加IPTG; 2. pET32a-OjDFR3未加IPTG; 3. pET32a-OjDFR3纯化前; 4. 纯化浓缩后的pET32a-OjDFR3图6 重组蛋白OjDFR3的纯化与浓缩M. Protein molecular weight marker; 1. pET32a with IPTG; 2. pET32a-OjDFR3 without IPTG; 3. Before purification of pET32a-OjDFR3; 4. Purified and concentrated pET32a-OjDFR3Fig.6 Purification and concentration of OjDFR3 recombinant protein
3 讨 论
DFR属于NADPH依赖性的短链还原酶家族,关于DFR基因的分离要追溯到20世纪80年代,其最初是由OReilly等[12]采用转座子标签法从玉米和金鱼草中分离出来的。随后,其他研究者又利用金鱼草DFR表型突变基因作为探针,从矮牵牛中将DFR基因分离出来[13-14]。研究显示,二氢黄酮醇4-还原酶在很多植物中已被研究,如穗醋栗[15]、羽衣甘蓝[16]、凤丹牡丹[17]、毛白杨[18]等。研究内容主要包括基因克隆、表达分析、功能鉴定等,但对日本蛇根草二氢黄酮醇4-还原酶的研究却未见报道。本实验成功克隆获得日本蛇根草OjDFR3基因,其cDNA全长为1 071 bp,可编码356个氨基酸,翻译形成蛋白的分子量为39.52 kD。蛋白质的理化性质分析显示,其理论等电点为5.96,共由20种氨基酸组成,亮氨酸含量最多。同时PSORT Ⅱ在线软件分析表明,该蛋白亚细胞定位在细胞质的可能性最大,这一分析结果与花色苷在细胞质中合成后,转运至液泡中发挥作用的理论相吻合;但却与芥蓝DFR的定位研究结果不同,表明不同物种中相同基因编码的蛋白质发挥作用的位置可能存在差异。
随后,本实验在成功克隆获得日本蛇根草OjDFR3基因的基础上完成了其重组蛋白的制备。研究显示,要对某种蛋白的结构及功能进行研究,首先要确保实验所制备的蛋白是可溶、稳定、且折叠正确的。所以在制备OjDFR3重组蛋白时,首先尝试通过低温诱导、更换表达菌株、在培养基中添加葡萄糖等方法获得可溶性重组蛋白,但实验结果均不理想,该蛋白始终以包涵体形式存在。相关研究表明,蛋白在包涵体中表达时,虽然制备过程中会变性,但可以在透析时使用含有不同梯度浓度尿素的透析液,通过逐步降低变性剂的浓度消除变性剂对蛋白活性的影响,使蛋白重新折叠复性。所以参照上述方法,通过透析复性与浓缩,成功完成了OjDFR3重组蛋白的制备。但所制备的重组蛋白是否具有活性,还需要进一步的酶活实验进行验证。
前期研究显示,日本蛇根草中缺失天竺葵素类花色苷,所以本研究在成功制备OjDFR3重组蛋白后,将对其底物特异性,催化效率等进行分析,以此来验证日本蛇根草天竺葵素类花色苷的缺失是否与二氢黄酮醇4-还原酶的底物选择性有关。综上,本研究结果一方面将为日本蛇根草DFR基因的功能解析奠定基础,另一方面将有助于更好地研究蛇根草,为揭示日本蛇根草花色苷的合成代谢及其他茜草目植物的花色苷代谢研究提供参考。
