转Bt基因海岛棉分子检测及抗虫性鉴定
2018-01-06贾莉莉范李萍李娟陈全家张海燕王希东曲延英
贾莉莉+范李萍+李娟+陈全家+张海燕+王希东+曲延英
摘要: 海岛棉作为新疆特有的资源,其优良的纤维品质和商业价值都是其他作物不可替代的,因此选育抗性优良的海岛棉新品系(品种)显得尤为重要。以海岛棉K222、新海25、新海30为受体,利用农杆菌介导技术导入目的基因Bt,通过PCR检测、Southern杂交、Bt-Cry1Ab/1Ac试纸条检测、抗虫性鉴定等,随后又对转Bt基因海岛棉品系的纤维品质进行考察,发现目的基因Bt的导入对9个海岛棉品系的纤维品质有不同程度的影响。PCR检测结果表明,9个转Bt基因品系都含有目的基因,并且阳性率都在90%以上;由Southern杂交结果可看出,7个转Bt基因品系出现了杂交条带,其中3个品系为单拷贝,3个品系为双拷贝,1个品系为三拷贝。用Bt-Cry1Ab/1Ac免疫试纸条检测转Bt基因品系及对照,发现转Bt基因品系的试纸条上出现2条紫红色条带,而对照的试纸条上只出现1条紫红色条带,K2-ZKC66 的阳性率达到90%。抗虫性鉴定结果表明,转Bt基因品系的叶片受危害较轻,叶片较为完整,对照叶片受危害较重,叶片不完整,7个转Bt基因抗虫棉品系校正死亡率都在60%以上。与对照相比,部分转Bt基因海岛棉品系上半部平均长度和长度整齐度显著降低,断裂比强度极显著降低,断裂伸长率极显著增加,短纤维率显著增加,成熟度极显著降低,马克隆值极显著增加。结果显示,7个转Bt基因品系的目的基因已成功整合到海岛棉基因组中。与对照相比,转基因品系纤维品质差异显著。
关键词: 转基因技术;海岛棉;;Bt基因;抗虫性;纤维品质;生物育种
中图分类号: Q785;S562.03 文献标志码: A
文章编号:1002-1302(2017)22-0097-05
转基因是一项新技术,转基因技术是一项新的产业。自1983年世界上第一例转基因植物烟草问世以来[1],对转基因作物的抗虫、抗除草剂、抗病及品质改良方面的研究与应用取得了巨大进展[2-4]。1996—2014年,全球转基因作物的种植面积从170万hm2增至1.815亿hm2,增加了100多倍,转基因农作物成为全球推广种植最为迅速的作物,这也使转基因技术成为近代史上发展最快的作物改良技术。美国是全球转基因作物种植的第一大国,种植的转基因作物包括玉米、大豆、棉花、油菜、甜菜、紫苜蓿、木瓜和南瓜等,其中棉花、大豆和玉米种植面积较广。我国是世界上率先研究农业生物育种的国家之一,转基因育种的面积也一直位居世界前列,棉花是我国主要的经济作物,在我国国民经济发展中具有举足轻重的地位[5]。近年来,随着基因工程技术的不断发展,利用生物技术创新棉花种质资源和培育新品种是一条非常有效的途径,极大地推动了棉花遗传育种的发展[6]。我国转基因抗虫棉作为生物育种创新成功的典范在国际上产生了深远的影响,将Bt基因转入到棉花中后,可以使棉花表达杀虫蛋白,从而能杀死目标害虫进而可以减少杀虫剂的使用[7-9],抗虫棉的种植与推广在一定程度上降低了棉铃虫对棉花产量的影响,给棉花产业带来了巨大的经济效益。随着转Bt基因抗虫棉的长期种植,陆地棉抗虫性得到了很大提高[10-13]。但是新疆特有的海岛棉转基因抗虫性研究却相对落后,至今仍未有转基因抗虫海岛棉品系的报道。本试验利用前期通过农杆菌介导获得的转基因海岛棉品系(品种)开展PCR检测及Southern杂交等室内分子检测,以及大田Bt-Cry1Ab/1Ac试纸条检测与室内抗虫性鉴定等,分析目的基因Bt转入受体及表达的情况,为培育新疆地区抗虫优良的海岛棉品种(品系)提供理论依据。
1 材料与方法
1.1 试验材料
本试验材料是由新疆农业大学生物技术重点实验室前期采用农杆菌介导法将外源基因Bt导入海岛棉K222、新海25和新海30,经过多代系统选育得到的高代转基因材料[14-15]。目的基因Bt是由郭三堆研究员惠赠,现由新疆农业大学生物技术重点实验室保存,Bt基因植物表达载体是由新疆农业大学生物技术重点实验室构建的。本试验所用的品种(品系)为海岛棉K222(对照)及其转Bt基因的7个品系(K2-ZKC31、K2-ZKC37、K2-ZKC53、K2-ZKC58、K2-ZKC65、K2-ZKC66、K2-ZKC70),新海25(对照)及其转Bt基因的XH25-ZKC和新海30(对照)及其转Bt基因的XH30-ZKC。
1.2 试验方法
1.2.1 PCR检测及Southern杂交
实验室内种植待检测样品,苗期取样,采用十六烷基三甲基溴化铵法(cetyl trimethyl ammonium bromide,简称CTAB)提取棉花基因组DNA,PCR扩增体系为25 μL,引物序列上游为5′-CAACGGTTCCGCTCTTTCTG-3′,下游为5′-CGTGGTTCTGCCCAAGGTAT-3′,扩增程序为 94 ℃ 5 min;94 ℃ 30 s;57 ℃ 30 s;72 ℃ 1 min;72 ℃ 10 min,共35个循环。扩增产物经1%琼脂糖凝胶电泳,再用溴化乙锭染色10 min,凝胶成像仪拍照。根据扩增条带的有无,可以初步判断转基因品系。
利用Southern杂交技术检测目的基因是否整合到棉花基因组中及其拷贝数。取20 μg DNA,用HindⅢ于37 ℃酶切 6 h,35 V电泳至弥散条带后转印于尼龙膜,按照Roche公司的PCR DIG Probe Synthesis Kit说明进行探针标记、杂交和显色处理。
1.2.2 Bt-Cry1Ab/1Ac试纸条检测
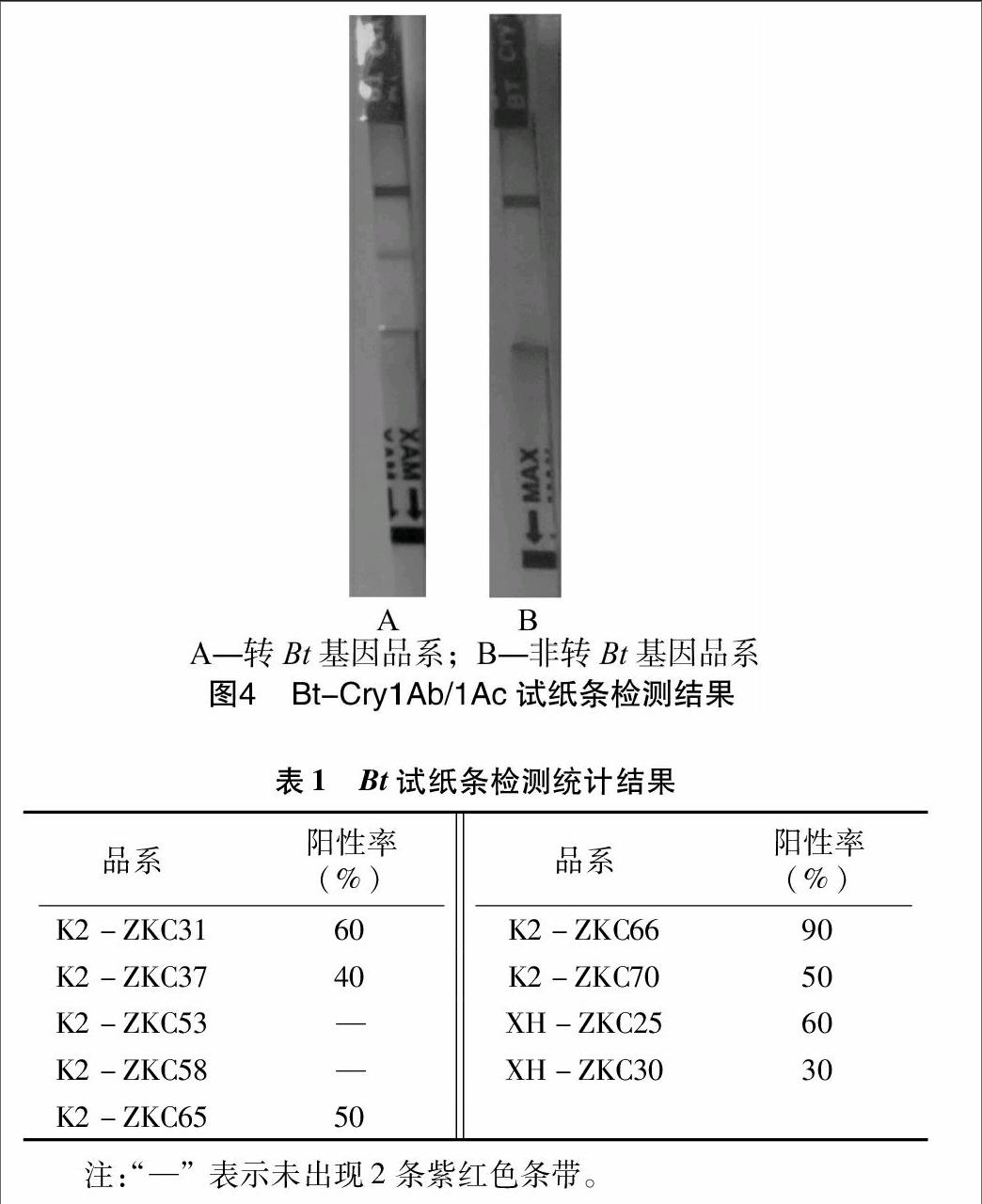
Bt-Cry1Ab/1Ac试纸条能快速、定性检测转基因植株中是否含有特异性的 Bt-Cry1Ab、Bt-Cry1Ac蛋白。采用美国Agdia公司生产的免疫检测试纸条检测。首先采集PCR呈阳性植株叶片,按照试纸条检测说明书进行规范操作,若结果显示2条紫红色条带,1条为质控线,另1条为检测线则为阳性品系;若结果只有1条紫红色條带则为非转基因品系(品种);若试纸条未出现任何1条条带,则操作有误,应重新操作。根据是否出现2条紫红色条带,确定转基因材料的株数,计算阳性率。
1.2.3 棉铃虫饲喂检测
棉铃虫由中国科学院新疆生态与地理研究所惠赠,虫龄包括2、3、4龄。采集大小一致阳性植株的幼嫩叶片放入培养皿中,叶柄一端用浸湿的脱脂棉包裹,每张叶片接5头虫,用塑料膜包裹培养皿,放入室内培养。5 d 后观察叶片受危害情况,计算幼虫校正死亡率。
幼虫校正死亡率=(处理幼虫死亡率-对照幼虫死亡率)/(1-对照幼虫死亡率)×100%。抗虫性评判标准:校正死亡率>90%,高抗;60%<校正死亡率≤90%,抗病;40%<校正死亡率≤60%,中抗;校正死亡率≤40%,感病。
试验数据采用Excel和SPSS 21.0统计软件进行统计分析。
2 结果与分析
2.1 转Bt基因品系的分子检测结果分析
2.1.1 PCR检测结果分析
对转Bt基因品系及对照进行DNA提取,PCR扩增,以非转基因品种K222、新海25和新海30为阴性对照,以含有目的片段的质粒为阳性对照,进行1%琼脂糖凝胶电泳检测和拍照分析。由图1、图2可以看出,样品均有特异性条带,且与阳性对照质粒条带大小一致,均在 400 bp 左右,而阴性对照没有扩增出目的条带,因此可初步判断目的基因存在于棉花中。
2.1.2 Southern杂交结果分析
为进一步验证转Bt基因品系的目的基因是否整合到棉花基因组中以及拷贝数,分别对PCR检测得到的阳性植株进行Southern Blotting分析(图3)。结果表明,在9个转基因品系中,7个转基因品系出现了杂交带,阳性质粒出现了杂交带,阴性对照没有出现杂交带;3、4、6、7、9、11和13泳道出现了杂交带,分别是K2-ZKC31、K2-ZKC37、K2-ZKC65、K2-ZKC70、K2-ZKC66、XH25-ZKC和XH30-ZKC,并且4、7和13显示为双拷贝,对应的品系名称分别是K2-ZKC37、K2-ZKC70和XH30-ZKC;3、6和9显示为单拷贝,对应的品系分别是K2-ZKC31、K2-ZKC65和K2-ZKC66;11(XH25-ZKC)显示为三拷贝;2、10和12是阴性对照,都未出现杂交带,通过以上结果可以证明,7个转基因品系的目的基因已经整合到海岛棉基因组中。
2.2 Bt-Cry1Ab/1Ac试纸条检测结果分析用Bt免疫试纸条检测转Bt基因品系,阳性结果在检测试剂条上出现2条紫红色条带,1条为检测线,另1条为质控线,阴性结果只含有1条紫红色质控线(图4)。经过Bt免疫试纸条检测后,其中图4-A出现了2条紫红色的条带,为转Bt基因品系,图4-B只出现了1条紫红色条带,为非转Bt基因品系。由Bt免疫试纸条统计结果(表1)可以看出,K2-ZKC66 的阳性率达到90%,其他(除K2-ZKC53和 K2-ZKC58 以外)转Bt基因品系的阳性率略低,在30%~60%之间。
2.3 转Bt基因品系抗虫性检测结果分析
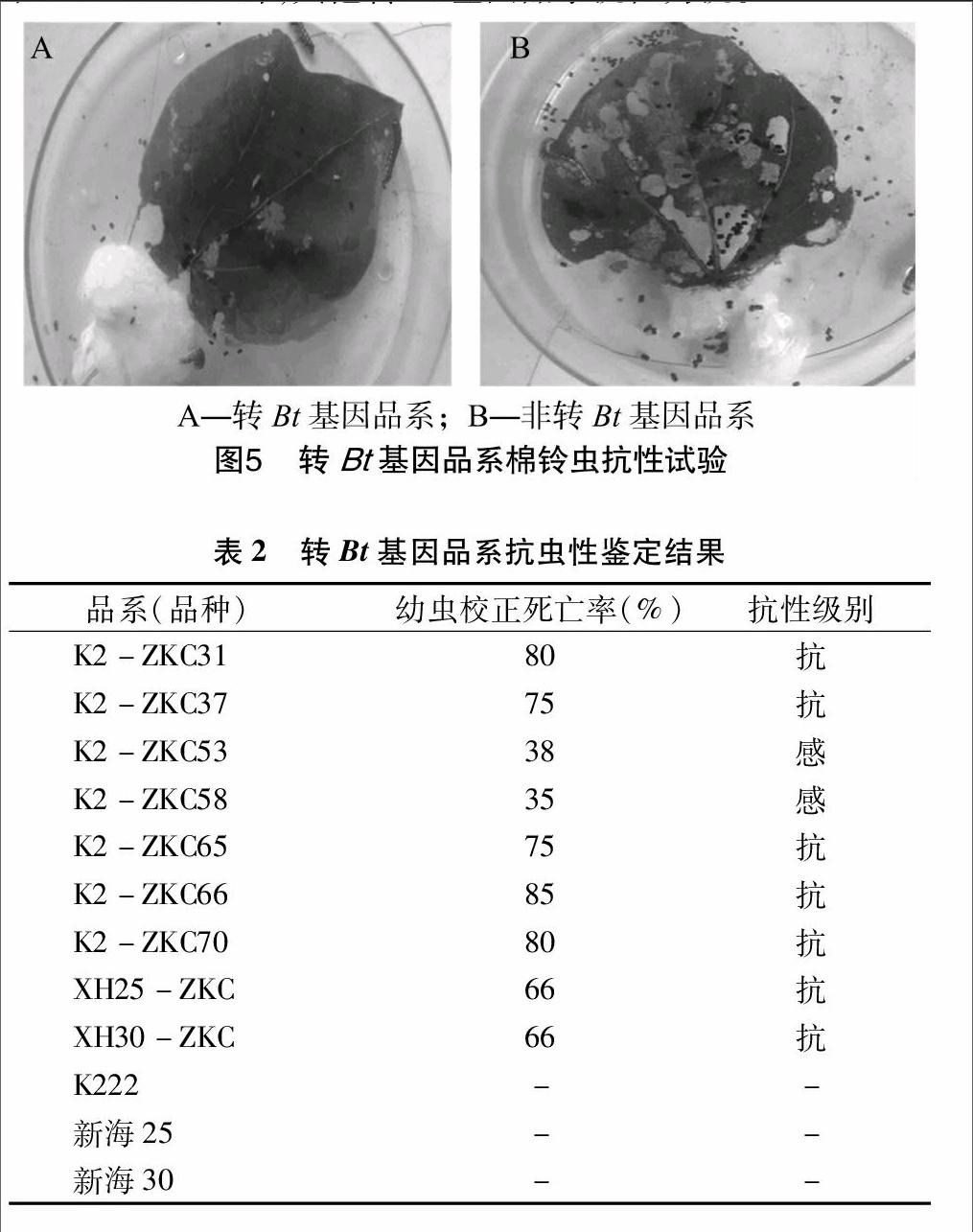
棉叶接虫5 d后,由图5可以看出,转基因抗虫棉叶片受棉铃虫危害较轻,整个叶片也较为完整,而对照组叶片受棉铃虫危害较重,整张叶片只剩下1/3,说明抗虫棉能减缓棉铃虫对叶片的危害。由转Bt基因抗虫棉抗虫性鉴定结果(表2)可看出,7个转Bt基因抗虫棉品系幼虫校正死亡率都在60%以上,其中K2-ZKC31、K2-ZKC66和K2-ZKC70的棉铃虫幼虫校正死亡率在80%及其以上;XH25-ZKC和XH30-ZKC的幼虫校正死亡率相对较低,均为66%。由幼虫校正死亡率可以得到转Bt基因海岛棉的抗性级别,除K2-ZKC53和 K2-ZKC58外,其他转Bt基因品系抗性为抗。
2.4 转基因品系纤维品质与对照比较分析
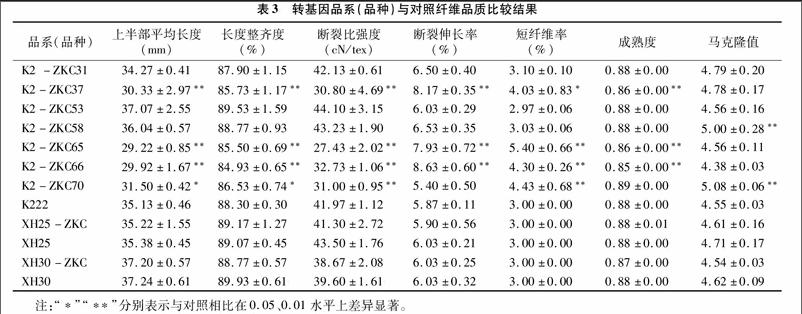
由表3可知,K2-ZKC37、K2-ZKC65和K2-ZKC66的上半部平均长度、长度整齐度极显著低于对照,K2-ZKC70的上半部平均长度、长度整齐度显著低于对照;K2-ZKC37、K2-ZKC65、K2-ZKC66和K2-ZKC70的断裂比强度极显著低于对照;K2-ZKC37、K2-ZKC65、K2-ZKC66的断裂伸长率极显著低于对照; K2-ZKC65、K2-ZKC66和K2-ZKC70的短纤维率极显著高于对照,K2-ZKC37的短纤维率显著高于对照;K2-ZKC37、K2-ZKC65、K2-ZKC66成熟度极显著高于对照;K2-ZKC58和K2-ZKC70的马克隆值极显著高于对照。XH25-ZKC与XH25、XH30-ZKC与XH30的纤维品质无显著差异,都保持着原品系的性状,可以说明Bt基因导入XH25和XH30,没有改变它们的纤维品质。
3 讨论
PCR检测可以证明待测样品中是否含有目的条带,但会因引物设计不合理以及目的基因在受体中重排等原因使PCR检测出现假阳性现象,所以还需要进一步进行Southern杂交检测,它是在DNA水平上检测目的基因是否整合到受体染色体上的技术。符家平等对转Bt基因苎麻T0和T1代分子检测,结果显示PCR检测呈阳性的T0和T1代植株做Southern杂交都得到了单一杂交条带,表明外源基因片段转入到受体中[16]。本试验中,PCR检测转Bt基因品系扩增出目的条带,可初步判断Bt基因转到了受体中,在进一步的Southern 杂交检测中,7个转基因品系得到杂交条带,可以证明这7个转基因品系的目的基因已经整合到海岛棉基因组中,已获得的杂交条带的拷贝数有单拷贝、双拷贝和三拷贝等3种,检测的转基因品系中三拷贝的有1个,仅占14%,说明转基因品系的遗传稳定性较高。本研究所用转基因品系均是通过农杆菌介导法获得的,农杆菌介导过程中根癌农杆菌是以低拷贝数整合到棉花基因组中的,而质粒注射往往以多拷贝数整合到棉花基因组中[17]。李琼等利用农杆菌噴雾和质粒注射处理后代植株,Southern杂交得出农杆菌喷雾的平均单插入率高于质粒注射,农杆菌喷雾法也能转化后代并且稳定性较高[18]。
Bt-Cry1Ab/1Ac试纸条可以定性检测Bt毒蛋白。聂新辉等使用金标Bt-Cry1Ab/1Ac试纸条检测转Bt基因棉花,得出转Bt基因棉花的试纸条上出现2条紫红色条带,说明转Bt基因棉花中含有Bt毒蛋白[19]。本试验中,K222转Bt基因的部分品系以及XH25-ZKC和XH30-ZKC的试纸条检测结果出现了2条紫红色的条带,可以说明部分转基因品系中含有Bt毒蛋白。宁新民等用试纸条检测外源抗虫基因时,得出海岛棉检测线的清晰度比陆地棉低[20],本试验结果与其有相似之处,这可能与外源基因转入量有关或者与海岛棉抗虫基因的蛋白质表达量有关[21-23]。
抗虫性鉴定是在蛋白水平检测转Bt基因棉花。徐遥等所做棉铃虫的抗性试验报道得出Bt棉对棉铃虫有毒杀作用[24-26]。本试验中,转基因品系叶片相对非转基因品系(品种)叶片较完整,危害较轻,说明转基因Bt棉能减缓棉铃虫对叶片的危害。李瑞奇等做转基因棉花抗虫性鉴定试验发现,3代棉铃虫的校正死亡率和抗性都低于2代棉铃虫,并且随着棉株生育期的进展,棉株对棉铃虫的抗性明显降低[27]。王峰等做抗虫性鉴定试验得出,在2、3、4龄,棉铃虫发生盛期,阳性植株叶片对棉铃虫校正死亡率依次降低,植株的抗虫性随着植株的生长表现降低的趋势[28]。本试验幼虫校正死亡率大部分处于60%~85%之间,抗性级别处于抗,原因可能与采取棉株叶片时间、棉铃虫的龄数有关。
将Bt基因导入棉花后,棉花农艺性状会发生一系列变化,其纤维品质是非常重要的农艺性状,纤维品质的优劣直接影响其经济价值和纺织工业。因为转Bt基因海岛棉研究较少,所以前人都是以陆地棉为受体研究Bt基因导入后农艺性状的改变[29-30],得出Bt基因导入棉花后,长度下降,强度提高,伸长率下降,马克隆值升高[31];转Bt基因品系中部分品种上半部平均长度、整齐度、断裂比强度、伸长率等高于非转基因品种[32];转Bt+Sck基因导入对棉花纤维品质无显著影响[33];转基因抗虫棉的绒长下降、比强度不同程度增加以及纤维增粗[34]。其他目的基因导入陆地棉后,其纤维品质也发生不同程度的改变,转基因棉花绒长和比强度不同程度增加,马克隆值降低[35];纤维长度及比强度下降、成熟度降低等[36];转基因棉花纤维品质整体比受体显著提高[37]。本研究将Bt基因导入海岛棉后,其纤维品质发生的改变,填补了Bt基因导入对海岛棉农艺性状研究的空白。在本研究中,与对照相比,部分转Bt基因海岛棉品系上半部平均长度和长度整齐度显著降低、断裂比强度极显著降低、断裂伸长率极显著增加、短纤维率显著增加、成熟度极显著降低和马克隆值极显著增加,但也有个别品系的纤维品质略高于对照。由于地区、材料以及数据处理之间的差异等造成转基因与对照之间纤维品质结果的不同,同一品种的不同株系间也会因性状分离使纤维品质表现出差异。
4 结论
以海岛棉K222、新海25、新海30为受体,利用农杆菌介导技术导入目的基因Bt,通过PCR检测、Southern杂交、Bt-Cry1Ab/1Ac 试纸条检测、抗虫性鉴定等,证明Bt基因已经整合到海岛棉基因组中并得到表达。与对照相比,部分转Bt基因海岛棉品系上半部平均长度和长度整齐度显著降低、断裂比强度极显著降低、断裂伸长率极显著增加、短纤维率显著增加、成熟度极显著降低和马克隆值极显著增加,但也有个别品系的纤维品质略高于对照。
参考文献:
[1] Vaeck M,Reynaerts A,Hfte H,et al. Transgenic plants protected from insect attack[J]. Nature,1987,328(6125):33-37.
[2]姚方印,朱常香,李廣贤,等. Bt水稻的抗虫性鉴定及转基因的遗传分析[J]. 中国农业科学,2002,35(2):142-145.
[3]杨 君,张 艳,王伟巧,等. 海岛棉GbHyPRP1 克隆及其转基因拟南芥抗黄萎病验证[J]. 植物遗传资源学报,2015,16(3):594-602.
[4]孟灵真,陈全家,杨 婷,等. 抗除草剂bar基因植物表达载体的构建与抗性功能的检测[J]. 新疆农业大学学报,2013,36(4):265-268.
[5]孙国清,李雪源,秦文斌,等. 新疆转基因棉花育种研究现状[J]. 分子植物育种,2004,2(1):129-132.
[6]王根平,杜文明,夏兰琴. 植物安全转基因技术研究现状与展望[J]. 中国农业科学,2014,47(5):823-843.
[7]Romeis J,Meissle M,Bigler F. Transgenic crops expressing Bacillus thuringiensis toxins and biological control[J]. Nature Biotechnology,2006,24(1):63-71.
[8]Tabashnik B E,Sisterson M S,Ellsworth P C,et al. Suppressing resistance to Bt cotton with sterile insect releases[J]. Nature Biotechnology,2010,28(12):1304-1307.
[9]Cattaneo M G,Yafuso C,Schmidt C,et al. Farm-scale evaluation of the impacts of transgenic cotton on biodiversity,pesticide use,and yield[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(20):7571-7576.
[10] Kruger M J,van Rensburg J B J,van den Berg J. Perspective on the development of stem borer resistance to Bt maize and refuge compliance at the vaalharts irrigation scheme in South Africa[J]. Crop Protection,2009,28(8):684-689.
[11]Tabashnik B E,van Rensburg J B J,Carrière Y. Field-evolved insect resistance to Bt crops:definition,theory,and data[J]. Journal of Economic Entomology,2010,102(6):2011 - 2025.
[12]Storer N P,Babcock J M,Schlenz M,et al. Discovery and characterization of field resistance to Bt maize:Spodoptera frugiperda (Lepidoptera:Noctuidae) in Puerto Rico[J]. Journal of Economic Entomology,2010,103(4):1031-1038.
[13]Bates S L,Zhao J Z,Roush R T,et al. Insect resistance management in GM crops:past,present and future[J]. Nature Biotechnology,2005,53(1):57 - 62.
[14]翁 琴. 海岛棉(G. barbadense L.)茎尖再生体系的建立及农杆菌介导抗虫基因(Bt;SATI)转化研究[D]. 乌鲁木齐:新疆农业大学,2007.
[15]周丽容. 农杆菌介导转Bt基因海岛棉技术体系的建立及抗虫性鉴定[D]. 乌鲁木齐:新疆农业大学,2011.
[16]符家平,汪 波,刘立军,等. 根癌农杆菌介导转Bt基因苎麻的获得及其抗虫鉴定[J]. 作物学报,2009,35(10):1771-1777.
[17]王景雪,孙 毅. 农杆菌介导的植物基因转化研究进展[J]. 生物技术通报,1999,1(1):7-13.
[18]李 琼,曲延英,杨 婷,等. 海岛棉两种转Bt基因方法的研究[J]. 棉花学报,2012,24(5):393-398.
[19]聂新辉,尤春源,陈惠瑜,等. 金标Bt-CryIAb/Ac试纸条定性检测转Bt基因棉花的方法研究[J]. 中国棉花,2013,40(1):15-17.
[20]宁新民,孔庆平,阿里甫,等. 新疆海岛棉抗虫转基因棉花的筛选及抗虫鉴定[C]//中国棉花学会2009年年会论文汇编. 北京,2009.
[21]沈 平,林克剑,张永军,等. 转Bt基因棉不同品种杀虫蛋白季节性表达及其对棉铃虫的控制作用[J]. 棉花学报,2010,22(5):393-397.
[22]张永军,吴孔明,郭予元. 转Bt基因棉花杀虫蛋白含量的时空表达及对棉铃虫的毒杀效果[J]. 植物保护学报,2001,28(1):1-6.
[23]王冬梅,李海强,丁瑞丰,等. 新疆北部地区转Bt基因棉外源杀虫蛋白表达时空动态研究[J]. 棉花学报,2012,24(1):18-26.
[24]徐 遥,丁瑞丰,李号宾,等. 转Bt基因棉花国抗62对棉铃虫生长发育的影响及田间抗虫效果[J]. 昆蟲学报,2008,51(2):222-226.
[25]汪 飞,徐 静,封红兵,等. 新疆棉区转Bt基因棉对棉铃虫生物学的影响[J]. 昆虫知识,2003,40(2):131-135.
[26]丁瑞丰,李号宾,刘 建,等. 新疆南部棉区转Bt基因棉花对棉铃虫抗性的季节性变化规律[J]. 植物保护学报,2012,39(3):193-199.
[27]李瑞奇,马峙英,王勤英,等. 转Bt/CpTI基因棉花抗虫性鉴定与筛选[J]. 植物遗传资源学报,2005,6(4):409-413.
[28]王 峰,张秋平,陈金湘,等. Bt-Cry5Aa 基因转化棉花及其抗虫性鉴定[J]. 植物遗传资源学报,2014,15(4):877-881.
[29]华鹤良,陈 源,张 祥,等. Bt基因导入对棉花叶片生长特征的影响[J]. 江苏农业科学,2015,43(7):53-55.[HJ1.7mm]
[30]安百伟,赵 亮,狄佳春,等. 陆地棉Bt抗虫基因类型鉴定与染色体定位[J]. 江苏农业学报,2016,32(2):262-266.
[31]刘剑光,肖松华,狄佳春,等. Bt基因导入对棉花农艺性状的影响[J]. 中国棉花,2003,30(3):15-17.
[32]刘 方,王坤波,宋国立,等. 棉花转基因材料的获得及主要农艺性状变异分析[J]. 棉花学报,2009,21(1):23-27.
[33]郭金英,郭旺珍,朱协飞,等. 转Bt+Sck棉花的分子检测及其农艺性状分析[J]. 南京农业大学学报,2007,30(3):16-20.
[34]吕淑平,郭小平,赵元明. 转基因抗虫棉Bt基因导入对受体材料农艺性状的影响[J]. 中国农学通报,2004,20(3):36-37.
[35]张燕红,王冬梅,周小云,等. 转Susy基因对棉花农艺性状的影响[J]. 新疆农业科学,2008,45(1):61-65.
[36]连丽君,吕素莲,李汝忠,等. 转BetA/als基因棉花材料的农艺性状考察[J]. 棉花学报,2008,20(6):447-451.
[37]刘慧君,简桂良,邹亚飞. GO基因导入对棉花农艺性状及抗病性的影响[J]. 分子植物育种,2003,1(5):669-672.
