大麦染色体特异IT分子标记的筛选
2021-07-28李红斌刘志鹏王秀娥王海燕
李红斌,刘志鹏,徐 涛,肖 进,王秀娥,王海燕
(作物遗传与种质创新国家重点实验室/JCIC-MCP,南京农业大学 农学院,南京 210095)
现有小麦品种遗传基础日趋狭窄已成为目前小麦育种取得突破性进展的主要瓶颈[1]。小麦近缘种属蕴藏丰富的抗逆、高产、优质等基因资源,通过远缘杂交将近缘物种中的优良基因导入到普通小麦,是拓宽小麦遗传基础、推进小麦育种取得突破性进展的有效途径之一[2-4]。
大麦属于小麦族中的大麦亚族(Hordeinae),其中只有栽培大麦(HordeumvulgareL., 2n = 2x = 14, HH)在小麦育种工作中得以利用。其中大麦所含有的抗黄矮病、抗穗发芽、早熟、耐冷、耐盐和耐贫瘠等优良性状,是小麦遗传性状改良的重要基因资源[5-11]。为了将大麦中的优异基因导入到栽培小麦品种中,研究者们从 1896 年开始就进行小大麦杂交试验,但直到1973 年,丹麦科学家Kruse首次报道利用六倍体普通小麦给二倍体大麦授粉,得到了小麦-大麦杂种植株[12]。在Kruse研究成果鼓励下,世界上许多科学家都开始了大小麦之间的杂交实验。随后的研究者相继创制出了普通小麦中国春-大麦Betzes、普通小麦Mv9kr1-大麦Igri、普通小麦Asakaze-大麦Manas二体异附加系、端体异附加系、小麦-大麦二体异代换系[13-17]。例如Islam等[18]以普通小麦‘中国春’为母本、大麦Betzes为父本创制出除1H染色体异附加系和1HL双端体异附加系的一整套小大麦整条和双端体异附加系,研究发现由于大麦1H染色体长臂上的Shw不育基因可以引起异附加系减数分裂异常,从而导致植株不育,因此未获得小-大麦1H异附加系。Yuan等[13]从小麦品种(CS)×大麦品种Betzes(H.vulgareL. cv. Betzes)的杂种后代中获得了一套能够稳定遗传的小-大麦异代换系。2016年Türkösi等[19]利用Asakaze/Manas小麦-大麦杂交种创制出一套小麦-大麦双端体异附加系(包括2HS、2HL、3HS、3HL、4HS、4HL、6HS、6HL、7HS、7HL),研究发现普通小麦背景中加入7HL染色体臂可提高小麦的耐盐性。 在小麦-大麦异附加系和异代换系的基础上,研究者们进一步利用染色体配对控制体系和杀配子染色体效应创制了一系列小麦-大麦易位系[20-22]。另外也有通过自发产生小麦-大麦易位系的报道[23-24]。这些材料的获得对于进一步向小麦背景中转移大麦有益基因奠定了坚实的基础。
准确高效无误的鉴定外源染色体身份,对加速小麦种质资源创新和利用,提高外源染色体的选择效率,降低劳动成本具有重要的现实意义。小麦遗传背景中大麦染色体的检测手段主要有形态学鉴定、细胞学鉴定(包括染色体核型、带型分析等)、生化标记鉴定(同工酶和蛋白质)和基因组原位杂交等技术,这些技术不仅难度大、费时费力,而且在鉴定小片段外源染色体方面具有一定的局限性。然而分子标记技术由于可直接在DNA分子水平上进行检测,能够准确鉴定出小麦中外源染色体片段的组成、大小和位置,尤其是高密度的分子标记对于精确鉴定外源染色体的易位身份具有重要意义。2012年以来,国际大麦基因组测序联盟陆续发表了大麦基因组和泛基因组高质量物理图谱,基因组序列信息的发布必将提高大麦特异性分子标记开发的效率[25-26]。目前,用于鉴定小麦背景中的大麦染色质常用的分子标记主要有RFLP[27-28]、STS-PCR[29-30]、SSR[31-32]和AFLP[33-36]等,但是分子标记的数量和密度还较低,利用这些标记来鉴定大量的大麦染色体结构变异体是远远不够的,而且也严重阻碍了大麦基因资源在小麦遗传改良中的应用。
IT(intron targeting)分子标记是基于EST(expression sequence tag)序列发展而来的新型分子标记[37]。IT标记的优势是它的扩增产物包含了变异频率更大的内含子区域,内含子区域由于不编码功能蛋白,除少数是作为顺式作用元件,大多是不受选择,因此保守性差,变异高;同时IT标记是在保守的外显子上设计的,因此即保证了标记的通用性,即在大多小麦族染色体组都可以扩增,也保持了标记的高多态性[38]。相比EST标记具有更高的多态性、扩增条带清晰、分辨率高而且这种分子标记在外源物种中具有很好的转移性。 Wang等[39]根据簇毛麦4VS的染色体分拣以及测序信息,通过与4AL、4BS、4DS以及粗山羊草的4DS的内含子区域进行比较,开发了359个IT标记,其中232个标记可以在T4VS·4DL易位系上进行特异性扩增,多态率为64.62%。Zhang等[40]利用簇毛麦survey序列信息和小麦基因组测序信息开发了1 624个IT标记,其中841个标记定位到簇毛麦1V-7V染色体上,多态率为51.79%。
簇毛麦与大麦同属于小麦的三级基因资源库,它们与小麦具有很好的共线性关系,因此,本研究充分利用小麦基因组学和大麦基因组学的最新成果,结合比较基因组学分析,利用实验室前期基于簇毛麦和普通小麦D亚基因组设计的2 267个IT分子标记,在普通小麦‘中国春’-Betzes大麦二体异附加系(2H~7H)进行扩增,筛选在大麦各条染色体特异的IT分子标记。本研究筛选到的大麦各染色体特异的分子标记对于大麦优异基因向小麦背景中转移和分子标记辅助选择育种提供快速高效的鉴定手段。
1 材料和方法
1.1 试验材料
本试验所用到的材料包括从美国堪萨斯州立大学小麦遗传资源中心引进的普通小麦‘中国春’-Betzes大麦二体异附加系DA2H(TA#3698)、DA3H(TA#3699)、DA4H(TA#3670)、DA5H(TA#3671)、DA6H(TA#3672)和DA7H(TA#3697);普通小麦‘中国春’(T.aestivumcv. Chinese spring,CS)和大麦(Hordeumvulgare,Golden promise)。
1.2 试验方法
1.2.1 引物本研究标记来自于Wang等[39]和Zhang等[40]以及实验室新开发的IT分子标记总计2 267个,分别分布在簇毛麦的1V(267个)、2V(333个)、3V(211个)、4V(569个)、5V(327个)、6V(360个)和7V(200个)染色体。该类分子标记是基于簇毛麦V基因组与‘中国春’A、B和D亚基因组间同一基因内含子间的大小差异开发的,由上海金唯智生物公司合成。
1.2.2 PCR扩增及电泳检测PCR扩增反应总体系为10 μL,其中1 μL模板80~200 ng/μL DNA,5 μL 2×Master Mix, 3.6 μL 超纯水,左右引物各0.2 μL。扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,56~60 ℃退火30 s(依据引物的退火温度),72 ℃延伸50 s,共32个循环;最后72 ℃延伸6 min。
在PCR扩增产物中加入2.0 μL 上样缓冲液,离心,取1.5~2 μL PCR扩增产物加入8%聚丙烯酰胺凝胶中(39∶1)进行电泳检测。电泳缓冲液1×Tris-硼酸(TBE)缓冲液,电泳电压200 V,电泳时间50 min左右。电泳结束后,参照银染法对PCR扩增产物进行检测。银染方法:用0.1%硝酸银溶液染10~15 min,用超纯水冲洗30 s,再用2%氢氧化钠和1%甲醛混合溶液染5~10 min后,用自来水冲洗2~3次,置于胶片观察灯上拍照并进行数据统计。
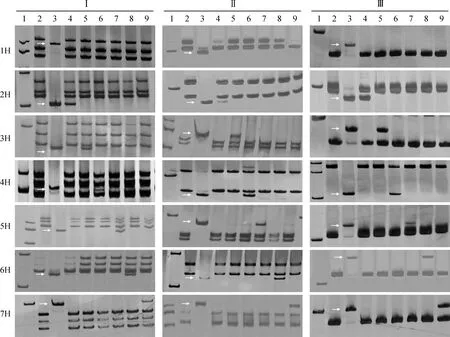
1. Marker; 2. ‘中国春’; 3.大麦;4. DA2H; 5. DA3H; 6. DA4H; 7.DA5H; 8. DA6H; 9. DA7H;类型Ⅰ的IT标记从上到下分别是大麦1H-7H染色体特异的分子标记CINAU1748、CINAU1812、CINAU1969、CINAU2247、CINAU1433、CINAU1513、CINAU1599;类型Ⅱ的IT标记从上到下分别是大麦1H-7H染色体特异的分子标记CINAU1710、CINAU1058、CINAU1211、CINAU1347、CINAU2301、CINAU1523、CINAU1581;类型Ⅲ的IT标记从上到下分别是大麦1H-7H染色体特异的分子标记CINAU879、CINAU1099、CINAU1209、CINAU2253、CINAU1382、CINAU1525、CINAU1495。图2、4的泳道1-9同图1 IT标记在大麦和大麦异附加系中的扩增结果1. Marker DNA ladder; 2. Chinese Spring; 3. Barley; 4. DA2H; 5. DA3H; 6. DA4H; 7. DA5H; 8. DA6H; 9. DA7H; The IT markers of type Ⅰ are CINAU1748, CINAU1812, CINAU1969, CINAU2247, CINAU1433, CINAU1513, CINAU1599, specific for barley chromosome of 1H, 2H, 3H, 4H, 5H, 6H and 7H from top to bottom, respectively; The IT markers of type Ⅱ are CINAU1710, CINAU1058, CINAU1211, CINAU1347, CINAU2301, CINAU1523, CINAU1581; The IT markers of type Ⅲ are CINAU879, CINAU1099, CINAU1209, CINAU2253, CINAU1382, CINAU1525, CINAU1495. 1-9 are the same as in Fig.2 and Fig.4Fig.1 The amplification of IT markers in barley and its disomic additional lines
2 结果与分析
2.1 大麦染色体特异分子标记的分类
利用实验室前期开发的2 267个IT分子标记在‘中国春’、大麦和普通小麦-大麦二体异附加系中进行PCR扩增,筛选大麦染色体特异分子标记。分子标记的扩增条带参照Wang等[39]对IT分子标记的分类,将分子标记分为3种。类型Ⅰ,这类分子标记总共可以扩增出4条带,其中1条带是大麦染色体所特异的,另外3条带分别来自于普通小麦A、B、D 3个亚基因组,这种类型分子标记不仅可以检测大麦染色体,还可以同时区分A、B、D 3个亚基因组,这种类型的分子标记称为共显性的分子标记;类型Ⅱ,这类分子标记总共可以扩增出3条带,其中1条带是大麦染色体所特异的,另外2条带分别来自于小麦A、B、D 3个亚基因组中的任意2个亚基因组;类型Ⅲ,这类分子标记总共可以扩增出2条带,其中一条带是大麦染色体所特异的,另外一条带来自于小麦A、B、D 等3个亚基因组中的任一个亚基因组、任2个亚基因组或3个亚基因组。图1展示了部分引物的扩增结果。
2.2 大麦各条染色体特异分子标记的筛选
2 267个IT分子标记扩增结果发现,2 095个分子标记在‘中国春’和大麦中都有扩增位点,占总标记数的92.41%。在这2 095个标记中,有534个IT标记在大麦和普通小麦-大麦二体异附加系中的一个二体异附加系中扩增出相同的条带,而与‘中国春’和其他二体异附加系中扩增出的条带不同,那么这个标记就可以作为这个二体异附加系所对应的大麦染色体的特异分子标记,约占总标记总数的23.56%,7个部分同源群的多态标记比率在18.04%~36.33%之间(表1)。
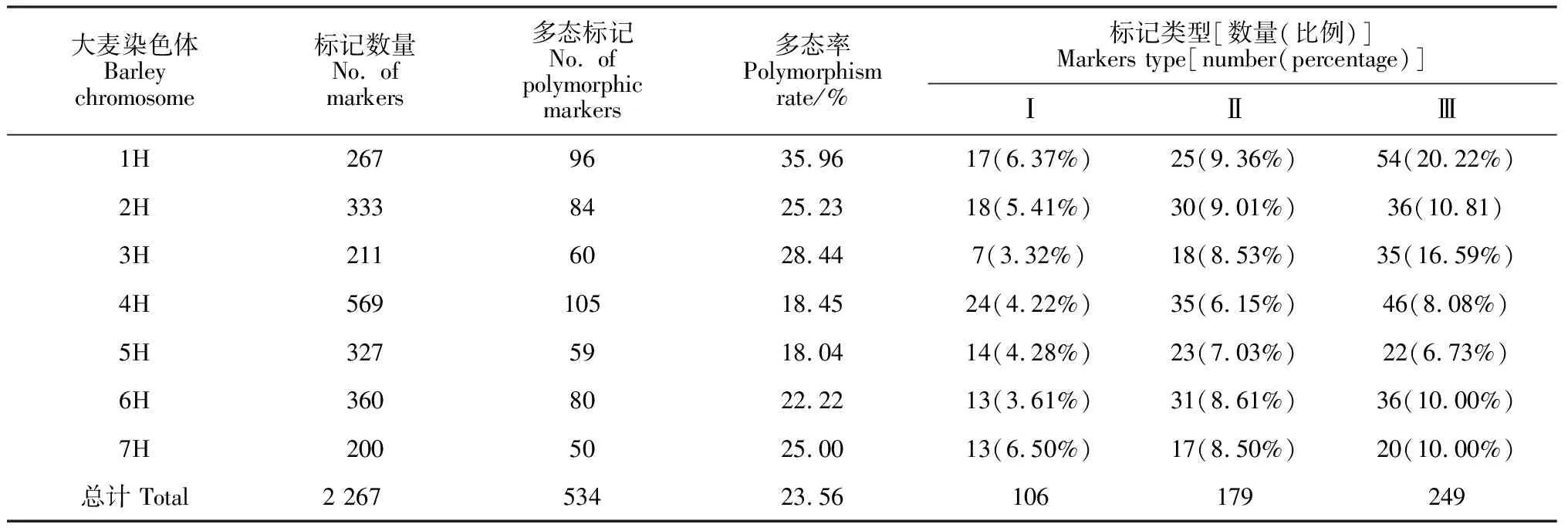
表1 IT分子标记在普通小麦-大麦二体异附加系中的扩增结果
由于该套异附加系中没有涉及大麦1H染色体的二体异附加系,本研究通过排除法来筛选大麦1H染色体特异的IT分子标记。如果该引物在大麦中存在特异性扩增条带,然而该引物在普通小麦-大麦2H~7H二体异附加系的扩增条带与‘中国春’都相同,推测该引物扩增出的特异条带位点来自于大麦1H染色体,该分子标记是大麦1H染色体特异分子标记。按照此思路,第一部分同源群的267个IT标记中,有261个标记在‘中国春’、大麦和大麦异附加系中具有扩增产物,占97.75%;其中96个IT标记在大麦中扩增出与‘中国春’和2H~7H染色体异附加系不同的条带,推测这些IT分子标记可能为大麦1H染色体的特异分子标记,这些标记数目占第一部分同源群标记总数的35.95%;其中类型为Ⅰ的共显性分子标记、类型Ⅱ和类型Ⅲ分子标记分别为17个、25个和54个,分别占第一部分同源群标记总数的6.37%、9.36%和20.22%(表1)。
另外还发现,原来定位于第一部分同源群的标记CINAU1736 和CINAU1691分别在大麦3H和4H二体异附加系中扩增出与大麦相同的特异条带,因此标记CINAU1736 和CINAU1691分别可以作为大麦3H和4H染色体的特异分子标记(图2)。
在第二部分同源群的333个IT标记中, 84个IT标记在大麦和普通小麦-大麦2H异附加系中扩增出大小相同的特异条带,是2H染色体特异分子标记,占第二部分同源群IT分子标记总数的25.23%。这些2H特异标记中,18个为类型Ⅰ的共显性分子标记,约占第二部分同源群IT分子标记总数的5.41%;30个为类型Ⅱ的特异分子标记,约占第二部分同源群IT分子标记总数的9.01%;36个为类型Ⅲ的特异分子标记,约占第二部分同源群IT分子标记总数的10.81%(表1)。
第三部分同源群的211个IT标记中,有191个标记在‘中国春’、大麦和大麦3H异附加系中具有扩增产物,占第三部分同源群标记总数的90.52%;其中60个IT标记是大麦3H染色体的特异分子标记,占第三部分同源群标记总数的28.44%;其中共显性分子标记类型Ⅰ为7个,类型Ⅱ和Ⅲ分别有18和35个,分别占第三部分同源群标记总数的3.32%、8.53%和16.59%(表1)。
第四部分同源群的569个IT标记中,有519个标记在‘中国春’、大麦和大麦异附加系中具有扩增产物,约占第四部分同源群标记总数的91.21%;其中105个IT标记是大麦4H染色体的特异分子标记,占第四部分同源群标记总数的18.45%;其中共显性分子标记类型Ⅰ为24个,类型Ⅱ和Ⅲ分别有35和46个,分别占第四部分同源群标记总数的4.22%、6.15%和8.08%(表1)。
第五部分同源群的327个IT标记中,310个标记在‘中国春’、大麦和大麦异附加系中具有扩增产物,约占第五部分同源群标记总数的94.80%;其中59个IT标记是大麦5H染色体的特异分子标记,占第五部分同源群标记总数的18.04%;其中共显性分子标记类型Ⅰ为14个,类型Ⅱ和Ⅲ分别有23和22个,分别占第五部分同源群标记总数的4.28%、7.03%和6.73%(表1)。
第六部分同源群的360个IT标记中,345个标记在‘中国春’、大麦和大麦异附加系中具有扩增产物,约占第六部分同源群标记总数的95.83%;其中80个IT标记是大麦6H染色体的特异分子标记,占第六部分同源群标记总数的22.22%;其中共显性分子标记类型Ⅰ为13个,类型Ⅱ和Ⅲ分别有31和36个,分别占第六部分同源群标记总数的3.61%、8.61%和10.00%(表1)。
第七部分同源群的200个IT标记中,192个标记在‘中国春’、大麦和大麦异附加系中具有扩增产物,约占第七部分同源群标记总数的96.00%;其中50个IT标记是大麦7H染色体的特异分子标记,其约占第7部分同源群标记总数的25.00%;其中共显性分子标记类型Ⅰ、Ⅱ和Ⅲ分别有13、17和 20个,分别占第七部分同源群标记总数的6.50%、8.50%和10.00%(表1)。
2.3 大麦特异IT分子标记物理图谱的构建
为了验证筛选的大麦各染色体特异分子标记的可靠性,进一步利用小麦族多基因组学网站(http://202.194.139.32/blast/viroblast.php),同时利用大麦参考基因组序列(Barley genome,https://www.nature. com/ articles/ nature22043)[25],通过blastn(版本2.10.1+,设置E=1)将这些标记对应的原始基因序列比对到大麦的参考基因组中,通过人工筛选,挑选出相似度最高的序列的物理位置,构建了一张大麦各染色体特异分子标记在大麦全基因组的物理图谱(图3)。从图中可以发现,在之前筛选到的534个大麦各染色体特异的分子标记中,有531个分子标记所对应的基因序列都能比对到大麦同源群对应的参考基因组中,进一步说明大麦跟小麦之间具有很好的共线性。其中有3个分子标记(CINAU800、CINAU1734和CINAU1796)所对应的基因序列比对不到大麦基因组中,有可能在大麦中不存在此基因的同源基因。在这3个标记中,有2个来自1V染色体(CINAU1796、CINAU1734),1个来自4V染色体(CINAU800),并且这3个标记在大麦的1H或4H上均能扩增出特异条带(图4)。另外,从图2中可以看出,之前来自于1V染色体的分子标记CINAU1736 和CINAU1691对应的基因序列分别比对到大麦的3H和4H染色体上,进一步说明这两个分子标记分别可以作为大麦3H和4H染色体的特异分子标记(图2)。由于本研究中没有涉及大麦1H染色体的二体异附加系,在筛选大麦1H染色体特异分子标记的时候,运用排除法,通过图2可进一步证实除了分子标记CINAU1736 和CINAU1691之外,其他筛选到的1H染色体特异分子标记是可靠的。
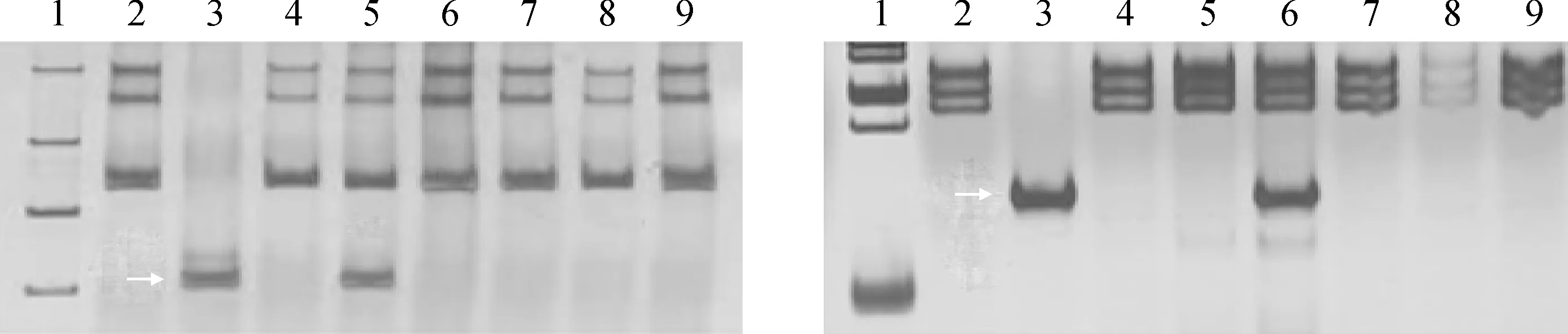
左图标记为CINAU1736,右图标记为CINAU1691图2 分子标记CINAU1736和CINAU1691在大麦和大麦异附加系中的扩增结果The marker in left figure is CINAU1736, and the other is CINAU1691Fig.2 The amplification of molecular markers CINAU1736 and CINAU1691 in barley and its disomic additional lines
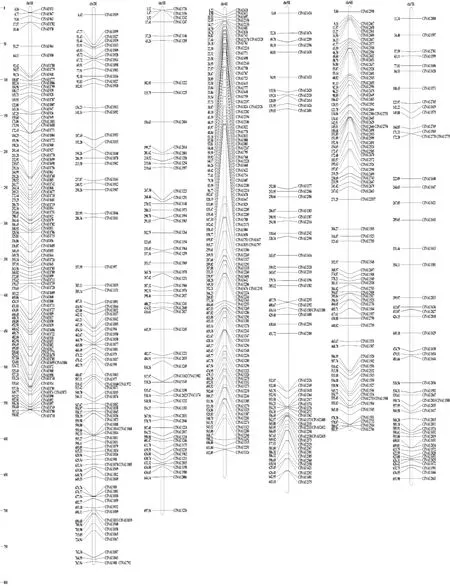
图3 大麦染色体特异IT标记的物理位置Fig.3 Physical mapping of IT markers specific to chromosomes of Hordeum vulgare
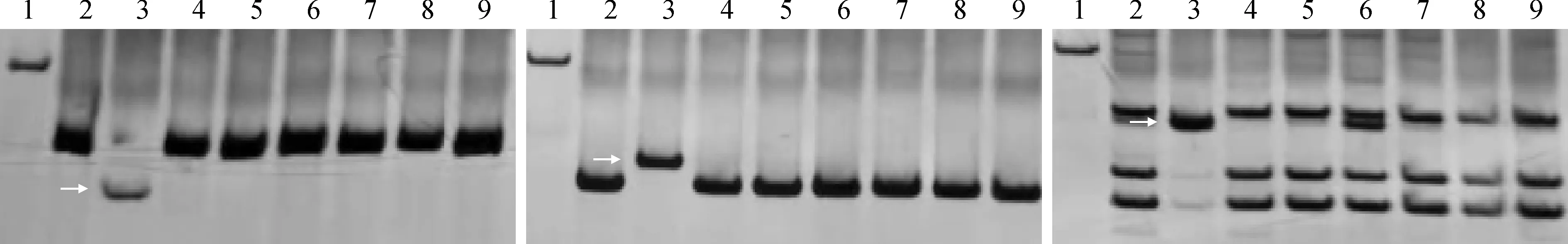
左图标记为CINAU1734,中间标记为CINAU1796,右图标记为CINAU800图4 不同分子标记在大麦和大麦异附加系中的扩增结果The marker in left figure is CINAU1734, in the middle is CINAU1796, and in the right is CINAU800Fig.4 Amplification of the different markers in barley and its disomic additional lines
3 讨 论
自20世纪以来,将小麦野生近缘物种中的优异基因转移到普通小麦是小麦育种的重要策略之一。目前,鉴定小麦背景中的外源染色体及染色体片段主要方法是分子细胞遗传学和分子标记。利用分子细胞遗传学技术原位杂交可以有效地检测小麦背景中的外源染色体身份,但是原位杂交技术步骤繁琐、耗时长,分子标记是一种快速、高效且准确的检测外源染色体的方法,可以弥补分子细胞遗传学鉴定的不足,对外源易位材料进行更精细的鉴定。在小麦野生近缘种基因组序列匮乏的情况下,以往野生物种的标记多来自普通小麦,如RFLP、SSR、EST标记等。但这类标记多数是根据小麦基因组设计,向近缘物种的转化效率低,可在近缘物种中利用的标记数目少,远不能满足外源染色质追踪和外源目标基因定位的需求。例如秦丹丹等[41]利用416个小麦SSR标记在157份大麦材料中进行扩增,最终仅发现有54个SSR标记能扩增出清晰且多态性稳定的条带,其多态率为12.98%;Varshney等[42]根据111 090个大麦EST序列设计了2 823个EST-SSR分子标记,结果只筛选到大麦染色体特异的185个EST-SSR标记,多态率为6.55%。在簇毛麦中,曹亚萍等[43]和Zhao等[44]分别根据小麦的EST序列,开发了240个EST-STS分子标记和607个 EST分子标记,最终只筛选到簇毛麦染色体特异的分子标记分别是13个和58个,多态率分别是5.42%和9.56%。
相对于其他标记,IT标记的优势是它的扩增产物包含了变异频率更大的内含子区域,具有更高的多态性和稳定性;小麦近缘物种基因组测序信息的释放,使高通量开发IT标记成为可能。Wang等[39]在4VS上开发了359个IT分子标记,其中有232个标记可以扩增出簇毛麦特异性条带,多态率达到64.62%;Zhang等[40]利用簇毛麦和小麦基因组测序信息开发了1 624个IT标记,其中841个标记定位到簇毛麦1V-7V染色体上,多态率为51.79%。本研究利用此套引物,共筛选到大麦染色体特异的分子标记534个,多态率为23.56%,也略高于其他大麦分子标记。这些研究结果表明该套IT标记,不仅能在簇毛麦染色体上具有较高的扩增多态性,在其他小麦属的野生近缘种中也具有较高的可转移性。当然,在实际应用中,这类标记不仅可以鉴定小麦背景中的外源染色体,同时在比较基因组学、分类研究和基因分型等方面都具有重要的应用价值。因此,可以认为IT标记是一种多态性高、稳定性好、低成本的小麦属野生近缘种的特异分子标记之一。
