黄瓜MTP基因家族分析及重金属胁迫下表达特征
2021-07-28朱雄萌蒋昕晨席克勇尹军良朱永兴
朱雄萌,蒋昕晨,席克勇,杨 静,3,尹军良,朱永兴*
(1 长江大学 园艺园林学院,湖北荆州 434000;2 长江大学 农学院,湖北荆州 434000;3 重庆工程职业技术学院,重庆 402260)
近年来,工矿业的迅速发展,以及化肥、农药的大量使用,导致中国土壤中重金属含量不断增加,土壤重金属污染日趋严重[1]。部分金属元素,如铜、铁、锌、锰等,是植物生长发育所必需的微量元素,常作为酶的重要辅因子,参与植物的生理生化活动以及代谢过程[2]。但是,必需微量元素积累过高也会对植物细胞造成毒害,影响植物的生长发育。例如,过量的锰、铜和锌会影响植物光合作用的正常进行,导致植株黄化,也会造成植物细胞损伤以及干扰植株对其他离子的吸收[3-4]。此外,还有一些植物生命活动非必需的金属元素,如镉、汞和铅,即使在低浓度下也会对植物体产生毒害,可影响细胞膜透性、破坏植物抗氧化防御系统以及光合系统;同时,这些非必需金属元素会在植物体内转运并富集到作物的可食用部分,最终威胁人们的身体健康[5-6]。因此,如何提高植物,尤其是农作物耐受重金属胁迫的能力,已经引起科研工作者的广泛关注。
为应对重金属胁迫,植物逐渐形成了多种重金属胁迫耐受机制,通过吸收、排出、螯合和转运重金属离子以维持生物体内金属离子稳态,降低重金属离子毒性[7]。植物中存在多个与金属转运相关的蛋白家族,如重金属ATP酶(heavy metal ATPase,HMA)、NRAMP家族(natural resistance associated macrophage protein)、CDF家族(cation diffusion facilitator)及ZIP转运蛋白(ZRT-IRT-like protein)等[1]。其中阳离子扩散促进家族(CDF)是一类广泛存在于酵母、细菌、拟南芥等原核和真核生物中的金属转运蛋白[3],其功能是将重金属离子运入特定的细胞器或运出细胞质,维持生物体细胞中金属离子稳态[3,8]。
植物CDF转运蛋白也被称为金属耐受蛋白(metal tolerance protein,MTP),在植物响应重金属胁迫的调控过程中起着关键作用。根据系统发育分析以及金属离子的转运特异性,可将CDF家族成员分为Mn-CDFs、Fe/Zn-CDFs和Zn-CDFs三个亚家族[8]。三个亚家族可进一步细分为7个组,其中G1(Group 1)、G5和G12属于Zn-CDF,G8和G9属于Mn-CDF,G6和G7属于Fe/Zn-CDF[8-9]。截至目前,已对拟南芥、水稻、小麦、甜橙、芜菁、茶树和杨树等物种进行了基因家族分析,分别鉴定到12、10、20、12、18、13和22个MTP基因。部分MTP蛋白的功能也得到初步解析,包括Zn-CDFs亚家族的MTP1、MTP3、MTP4和MTP12,以及Mn-CDF亚家族的MTP8、MTP9和MTP11。其中MTP1、MTP3和MTP4的主要功能是转运Zn2+,也可以转运Cd2+、Co2+以及Fe2+[8]。MTP5与MTP12可形成蛋白复合体,将Zn2+转运到拟南芥的高尔基体中[15]。MTP8蛋白与Mn2+的稳态维持密切相关[16]。MTP9定位于质膜上,参与黄瓜根系细胞Mn2+和Cd2+的外排[17]。在拟南芥和水稻中,MTP11转运蛋白可增强植物对Mn2+的耐受性[18]。此外,尽管MTP9和MTP10属于Mn-CDF亚家族,目前尚缺乏关于MTP9蛋白和MTP10蛋白提高植物对Mn2+的耐受性或参与锰离子转运的确切证据。此外,MTP蛋白G6组和G7组成员的具体功能均不明确,且关于植物金属转运蛋白基因家族成员的具体调控机制仍需进一步研究[19-20]。
目前,国内外有关植物MTP的功能研究主要围绕水稻、拟南芥等模式物种开展,其他物种中MTP参与植物重金属响应的调控机制尚不清楚。黄瓜(CucumissativusL.)是世界范围内重要蔬菜作物,也是中国设施栽培面积大、种植范围广的主要蔬菜作物之一。但由于黄瓜根系分布较浅,再生能力弱,对胁迫环境敏感,一旦遭受金属毒害会严重影响黄瓜的产量和品质。因此,系统鉴定黄瓜的MTP基因家族成员,揭示其对重金属胁迫的响应特征,对深入研究MTP在黄瓜抗重金属毒害中的作用以及利用MTP增强黄瓜对重金属胁迫的耐受能力,均具有重要的理论和实践意义。本研究利用生物信息学方法对黄瓜MTP基因家族成员进行鉴定和基因组注释,并对其基因结构、系统进化、蛋白质序列、保守结构域和表达模式等进行分析,以期为进一步开展黄瓜MTP基因功能研究奠定基础。
1 材料和方法
1.1 黄瓜MTP基因家族的鉴定
从黄瓜基因组数据库(http://cucurbitgenomics.org/organism/2)下载黄瓜的全基因组序列。以模式植物拟南芥[9]、水稻[9]、玉米中的MTP蛋白序列为种子序列,BLASTp比对到黄瓜蛋白质序列数据库(e-value≤1e-10)。同时,利用关键词“metal tolerance protein”搜索黄瓜基因组数据库。将得到的序列提交到InterProScan(http://www.ebi.ac.uk/interpro/),确认是否含有MTP家族特有的结构域(IPR002524)。
1.2 方 法
1.2.1 多重序列比对和系统发育分析利用ClustalW2(v2.1)对黄瓜、拟南芥、水稻和玉米的MTP蛋白序列进行多重序列比对。通过MEGA7基于LG模型使用邻接法构建无根系统发育树,校验参数bootstrap值设置为1 000次[21],其他参数为默认值。使用IToL(Interactive Tree of Life)在线工具美化系统发育树。
1.2.2 染色体分布及跨膜结构域分析从黄瓜基因组注释文件(GFF3)中提取MTP基因的染色体位置信息,使用MapInspect,根据位置信息绘制MTP在7条染色体上的分布图[22]。用ExPaSy提供的在线工具ProtParam对MTP的蛋白质特征进行分析,包括等电点、相对分子质量、蛋白质平均疏水性和氨基酸组成。使用在线软件WoLF PSORT预测黄瓜MTP蛋白的亚细胞定位。
1.2.3 基因结构和motif分析利用在线工具GSDS(Gene Structure Display Server,http://gsds. cbi.pku.edu.cn/)分析黄瓜MTP基因的外显子和内含子组成及分布情况[23]。使用MEME motif搜索工具(http://meme-suite.org/index.html)和SMART(http://smart.embl-heidelberg.de/)识别黄瓜MTP蛋白的保守基序。除允许识别的motif个数最大值设定为5外,其余均使用参数默认。利用TBtools软件(https://github.com/CJ-Chen/TBtools)绘制基因结构和motif结构图。
1.2.4 表达特征分析为初步揭示黄瓜MTP基因的表达模式,从黄瓜基因组数据库收集MTP基因在不同发育阶段、不同组织以及多种处理条件下,通过RNA-seq获得的基因表达水平FPKM(Fragments per kilobase of transcript per million fragments mapped values)值。用R软件的pheatmap包绘制热图。
1.2.5 荧光定量PCR分析‘津优1号’黄瓜种子经55 ℃温水浸泡15 min后,置于28 ℃培养箱避光催芽。出芽后播种于穴盘,放置于人工气候室中培养,昼夜温度设置为25 ℃/18 ℃,相对湿度60%。待植株长到两叶一心时,移栽到营养液中进行培养。营养液选用1/2Hoagland营养液,详细配方组成参考Zhu等[24]。缓苗5 d后,对植株进行重金属胁迫处理,向营养液中分别添加100 μmol/L ZnSO4·7H2O、100 μmol/L CdCl2、400 μmol/L MnSO4·H2O、40 μmol/L CuSO4·5H2O、50 μmol/L EDTAFeNa·3H2O和45 μmol/L Na2MoO4。经3 d的重金属处理后,每个处理以及对照分别取根系和叶片的样品,液氮速冻后于-80 ℃冰箱中保存直至使用。
提取植物根系和叶片组织的RNA,并按照反转录试剂盒说明书(南京诺唯赞生物科技有限公司)将RNA反转录成cDNA,稀释后作为模板进行实时荧光定量PCR分析。荧光定量PCR使用SYBR qPCR Master Mix试剂(南京诺唯赞生物科技有限公司),荧光定量反应总体系为20 μL,包括SYBR Premix 10 μL、上下游引物各1 μL、cDNA 2 μL,加水至终体积20 μL,充分混匀离心后于Bio-Rad CFX96实时定量PCR仪上扩增(Bio-Rad,Hercules,USA)。每个样品均设3次生物学重复,以Actin基因作为内参,引物信息见表1。采用2-ΔΔCt法计算基因的相对表达量[25]。用SPSS19.0软件分析差异显著性并利用Sigmaplot绘图。

表1 黄瓜MTP基因引物序列
2 结果与分析
2.1 黄瓜MTP家族成员的全基因组鉴定
通过本BLASTp比对、关键词搜索和InterProScan确认,从黄瓜基因组中鉴定出10个CsMTP基因家族成员,结构域分析表明它们均属于阳离子转运蛋白超家族(cation efflux)(表2)。根据拟南芥AtMTP的分类标准以及同源关系,10个CsMTPs可分为3个亚家族和7个组,分别命名为CsMTP3~CsMTP12。Zn-CDFs亚家族包括G1(Group 1,CsMTP3、CsMTP4a、CsMTP4b)、G5(CsMTP5)和G12(CsMTP12)三个组的5个基因;Fe/Zn-CDF亚家族包括G6(CsMTP7)和G7(CsMTP6)两个组的2个基因;Mn-CDF亚家族包括G8(CsMTP8)和G9(CsMTP11、CsMTP9)两个组的3个基因。
2.2 黄瓜MTP蛋白的理化参数及结构特征
如表2所示,CsMTP基因编码蛋白的氨基酸序列长度在313(CsMTP7)至876(CsMTP12)之间,相对分子质量为33.8~98.5 kD,等电点pI为5.54~8.33。CsMTP的亚细胞定位预测结果表明,黄瓜Zn-CDFs和Zn/Fe-CDF中的所有成员均定位于液泡膜上。其中2个Mn-CDF成员CsMTP8和CsMTP9被预测定位于细胞膜或液泡上。跨膜保守结构域分析结果表明,除CsMTP7存在4个跨膜结构域(TMD),CsMTP12存在11个TMD外,其他8个黄瓜CsMTP均具有6个典型的TMD结构域。

表2 黄瓜CsMTP基因鉴定和基本分子特征分析
2.3 黄瓜MTP的系统发育分析
系统发育分析表明,黄瓜大多数CsMTP基因是拟南芥AtMTP的同源基因(图1)。属于Zn-CDF亚家族的CsMTP3、CsMTP4和CsMTP5分别与AtMTP3、AtMTP4和AtMTP5有较高的相似性;属于Mn-CDF亚家族的CsMTP11和CsMTP8分别与AtMTP11和AtMTP8有较高的相似性;而属于Fe/Zn-CDF亚家族的CsMTP6和CsMTP7与AtMTP6和AtMTP7/OsMTP7有较高的相似性。此外,在黄瓜中未鉴定到与拟南芥AtMTP1、AtMTP2和AtMTP10同源的基因。
2.4 黄瓜MTP保守基序、基因结构和染色体分布分析
本研究对CsMTP中保守基序组成进行了分析。根据黄瓜MTP的结构域组成,共鉴定出10个保守motif(Motif 1~10;图2,A)。其中,Motif 2由残基“WFTAFAMRKPNPYRYPIGKKRMQPVGIIVFASVMATLGLQ”组成,与阳离子转运蛋白家族(Cation efflux;PF01545)相关。而由“NHHPEIKHIDTVRAYTFGVHYFVE”残基组成的Motif 8与锌转运蛋白二聚体结构域(ZT_dimer;PF16916)相关。
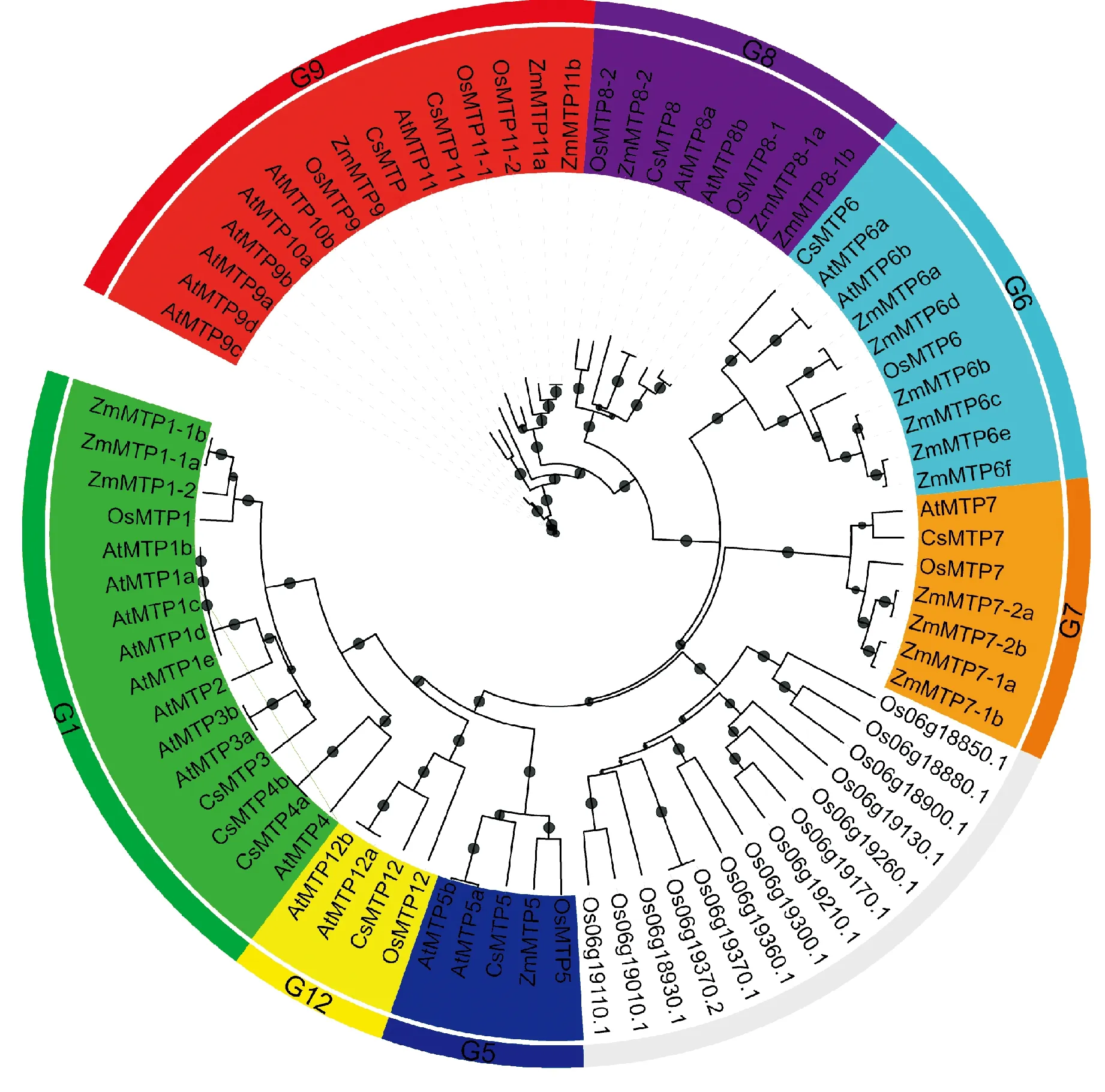
G1、G5、G6、G7、G8、G9和G12分别代表归属于相应组(Group)的基因家族成员;At.拟南芥;Os.水稻;Zm.玉米;Cs.黄瓜图1 黄瓜、拟南芥、玉米和水稻MTP基因的系统发育分析G1, G5, G6, G7, G8, G9 and G12 represent genes belonging to corresponding group; At. Arabidopsis thaliana; Os. Oryza sativa; Zm. Zea mays; Cs. Cucumis sativusFig.1 Phylogenetic relationship of MTP gene in Cucumis sativus, Arabidopsis, maize and rice
前人研究结果显示,所有属于Zn-CDF的CsMTP蛋白都含有保守的Motif 1、3、4和7,但CsMTP5只含有Motif 1和3(图2,A)。Mn-CDF亚家族基因的motif数量以及排布基本相同(Motif 9、2、10、5和2),这说明它们可能具有相似的生物学功能(图2,A)。研究表明,Mn-CDF通常含有保守序列DxxxD(x为任意氨基酸),而Zn-CDF常含有保守序列HxxxD。本研究中,在Mn-CDF亚家族的CsMTP8、CsMTP11、CsMTP9中识别到基序DxxxD,而在Zn-CDF和Zn/Fe-CDFs亚家族的CsMTP3、4、5和CsMTP7中识别到HxxxD基序的存在(图3)。
基因的外显子-内含子结构分析表明,黄瓜CsMTP的内含子数量在1~12个之间。5个Zn-CDF亚家族成员中,除了CsMTP5含有9个内含子外,其他4个均含有1个内含子(图2,B);Zn/Fe-CDF亚家族成员的内含子数目最多,其中,CsMTP6和CsMTP7分别含有11和12个内含子;Mn-CDF亚家族的成员CsMTP4a和CsMTP4b中分别含有5和6个内含子。基因非编码区(UTR)分析发现,除CsMTP4a、CsMTP4b和CsMTP8的3′端不含UTR,CsMTP12和CsMTP9的5′端不含UTR外,其他CsMTP两端均含有UTR区域。染色体分布分析发现,除第2和4号染色体上没有基因外,第1、3、5、6、7号染色体上分别存在3、2、1、2、2个CsMTP基因(图4)。
2.5 黄瓜MTP的表达特征分析
为系统认识CsMTP的表达特征,从黄瓜基因组数据库收集已有的RNA-seq数据,对黄瓜MTP基因在不同组织及处理下的表达模式进行了初步分析。由图5可知,CsMTPs在不同组织和处理下均表达,但各基因的表达水平差别较大。其中CsMTP11、CsMTP3、CsMTP7在不同组织和处理下均表现较高的表达水平;CsMTP8、CsMTP9、CsMTP12、CsMTP4、CsMTP6、CsMTP5的表达水平普遍偏低,没有组织或者处理特异性响应的现象。

A. 保守基序分析;B. 基因结构分析;Motif. 基序;CDS. 蛋白质编码区;UTR. 非编码区;Intron. 内含子图2 CsMTP基因家族的保守基序及基因结构分析A. Motif analysis;B. Gene structure analysis; CDS. Sequence coding for amino acids in protein; UTR. Untranslated regionFig.2 Gene structure and motif analysis of CsMTP gene family
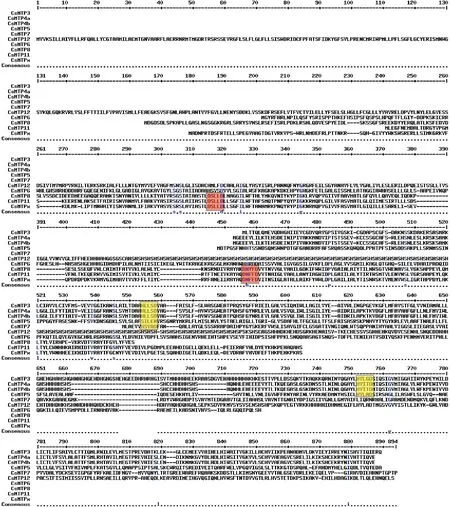
橙色框为Mn-CDF含有的保守序列DxxxD;黄色框为Zn-CDF含有保守序列HxxxD (x为任意氨基酸);标尺代表氨基酸残基数目图3 黄瓜MTP蛋白保守结构域分析Orang boxes represent for conserved sequence DxxxD belongs to Mn-CDF; Yellow boxes represent for conserved sequence DxxxD belongs to Zn-CDF; The rule represents the amino acid residuesFig.3 Conserved protein domain analysis of Cucumis sativus MTP
2.6 黄瓜MTP对重金属胁迫的响应特征分析
为了深入了解CsMTP基因在重金属胁迫下的响应特征,我们借助实时荧光定量PCR分析了黄瓜根系和叶片在不同重金属离子(包括Zn、Cd、Mn、Cu、Fe和Mo)胁迫下的表达变化。由图6可知,黄瓜MTP基因家族在不同重金属处理下的不同组织表达水平存在一定差异。每种重金属离子至少可以诱导一个或几个CsMTP基因的差异表达。根系中,Zn胁迫处理显著提高了CsMTP3的表达水平,而CsMTP4、CsMTP5、CsMTP7、CsMTP8、CsMTP11的表达水平则显著降低。Cd胁迫处理后,除了CsMTP3和CsMTP9的表达水平显著升高外,其他CsMTP基因的表达水平均显著降低。

Chr 1~7代表1~7号染色体图4 黄瓜CsMTP基因的染色体分布Chr1-7 represent the chromosome 1 to 7Fig.4 Chromosomal distribution of CsMTP genes
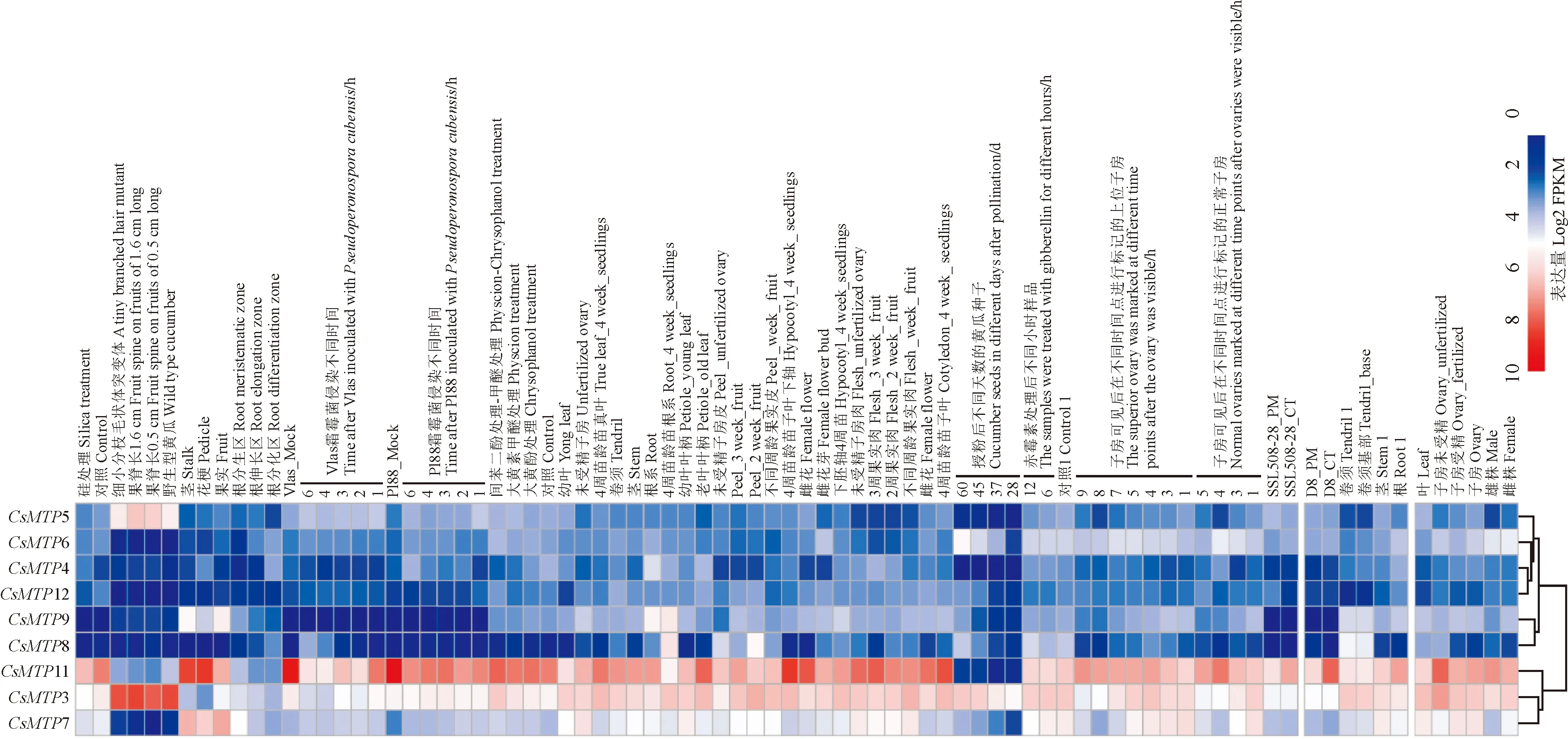
图中Vlas Mock、PI88_Mock、SSL508-28分别代表不同的黄瓜品种图5 黄瓜MTP基因表达水平热图Vlas Mock, PI88_Mock and SSL508-28 represent for different cucumber cultivars; The changes of color indicates different levels of log2-transformed gene expression levelFig.5 Expression pattern profiling of cucumber MTP genes
Mn胁迫处理下,除了CsMTP5和CsMTP6之外,其他基因的表达水平均显著上调(CsMTP4和CsMTP9)或者下调表达。Cu胁迫显著诱导了根系中CsMTP3、CsMTP4、CsMTP6、CsMTP9、CsMTP11的表达,抑制了CsMTP8和CsMTP11的表达。Fe处理下,CsMTP4的表达水平基本没有变化,其他基因的表达水平均显著上调(CsMTP9)或者下调。Mo处理下,大部分基因的表达水平显著降低,而CsMTP4和CsMTP9的表达水平则显著升高。
叶片中,除了CsMTP11的表达水平显著提高之外,Zn胁迫处理显著降低了所有CsMTP基因的表达水平。Cd处理显著提高了CsMTP9的表达水平,显著降低了除CsMTP4和CsMTP7之外的大部分基因的表达水平。Mn处理下,CsMTP3、CsMTP5、CsMTP8、CsMTP12的表达水平显著降低,而CsMTP7、CsMTP9和CsMTP11的表达水平则显著升高。Cu胁迫处理后,CsMTP7和CsMTP11的表达水平有所升高,其他基因的表达水平均显著降低。Fe处理显著提高了CsMTP6和CsMTP11的表达。Mo处理下,CsMTP4、CsMTP7和CsMTP9的表达水平基本没有变化,其他基因的表达水平均显著降低(图6)。

*和**分别表示处理与对照在根和叶中的显著差异(n = 3,P < 0.05)图6 重金属胁迫下黄瓜MTP基因在根系和叶片中的表达水平* and ** indicate significant differences between the treatment and the control in root and leaf, respectively (n = 3, P < 0.05)Fig.6 Expression level of cucumber MTP gene in roots and leaves under heavy metal stress
3 讨 论
土壤中高浓度的重金属影响植物正常生长发育,甚至导致植株死亡。金属耐受蛋白(MTP)在重金属转运过程中发挥重要作用。目前,水稻[27]、拟南芥[28]、黄瓜[29]、山茶[30]、遏蓝菜[31]和芥菜[32]等植物中金属转运蛋白的功能已有所研究。但很多物种中MTP基因家族成员组成以及其重金属响应机制尚不清楚。本研究共鉴定到10个黄瓜CsMTP基因家族成员,分别命名为CsMTP3至CsMTP12。前人研究表明,MTPs通常包含6个跨膜结构域(TMD),以及C端阳离子结合结构域以及N端信号肽序列[10]。黄瓜CsMTP蛋白除了CsMTP7(4个)和CsMTP12(11个)之外均含有6个TMDs。类似的,在小麦中MTP蛋白具有4~14个TMD。空心莲子草中大部分MTP蛋白具有2~6个TMD,ApMTP12-1含有14个TMDs[33]。本研究中,黄瓜CsMTP蛋白质氨基酸数目差异较大,长度为313~876个氨基酸不等(表2)。类似结果在其他物种中也有报道,例如拟南芥MTP的氨基酸数目为398个(AtMTP1)[34]至789个(AtMTP12)[15]。这些结果暗示这些CsMTP基因可能具有功能上的多样性。
目前已发现的CDF蛋白大部分定位于细胞膜上,但也有些存在液泡膜、高尔基体膜等细胞器膜上[25]。亚细胞定位预测结果表明,黄瓜Zn-CDFs和Zn/Fe-CDF亚家族中的所有成员均定位于液泡膜上。两个Mn-CDF成员CsMTP8和MTP9被预测定位于细胞膜或液泡上。类似的,12个甜橙CitMTP中,分别有5个和4个CitMTP被预测定位在液泡膜和细胞膜上[11]。这些结果暗示不同的CDF蛋白可能在不同的细胞器中发挥其功能。但是CsMTP基因的亚细胞定位情况仍需通过实验进行验证,以便更好地解释其在重金属转运过程中的功能。外显子-内含子结构多样性通常能够在基因家族进化中发挥关键作用,并可以为系统发育分类提供依据[35]。甜橙、水稻、拟南芥和黄瓜MTP基因中包含的内含子数量在1~13之间。且黄瓜CsMTP不同亚家族内含子-外显子数目差异较大,Zn-CDF亚家族成员除了内含子数目普遍较少,而Zn/Fe-CDF亚家族成员所含内含子数目最多。但是外显子-内含子结构在CsMTP的功能和进化过程中所发挥的作用还需要进一步的分析和验证。
同拟南芥同源关系分析结果显示,黄瓜中大多数MTP基因存在AtMTP的同源基因。但是本研究在黄瓜中未鉴定到拟南芥同源基因MTP1、MTP2和MTP10(图1)。此外,AtMTP2和AtMTP10的同源基因在玉米和水稻中也没有鉴定到,这可能是由于黄瓜、玉米和水稻中这些基因在进化过程中丢失,或者是拟南芥通过近期独立的进化事件而产生的新基因。此外,MTP8、6、7和9在单子叶植物玉米、小麦和双子叶植物黄瓜和拟南芥中均被鉴定到,表明这些基因进化上具有一定的保守性。拟南芥中,AtMTP8是定位于液泡膜生的Mn转运体,参与调控缺铁胁迫,以及种子中Mn和Fe的分布[36]。黄瓜中,定位于液泡膜的CsMTP8在黄瓜根系中特异性表达,并且表达水平可以被高锰或者缺锰胁迫诱导[37]。OsMTP8在水稻茎中表达丰度最高,其主要功能是将多余的Mn2+转运至液泡中,降低水稻地上部的Mn毒害[38]。Zhang等[13]克隆到一个膜定位的Mn转运蛋白基因CsMTP8.2,且拟南芥中的异源表达结果表明该基因可将多余的Mn2+转运到细胞外。这些结果可为其他物种中MTP8的功能研究提供一定的参考。
为了解CsMTPs基因的表达水平,借助已经发表的RNA-seq数据,对黄瓜MTP基因表达水平和表达模式进行了初步分析,结果表明CsMTPs在不同组织和处理下均有表达,但不同CsMTP基因表达水平差别较大。其中CsMTP11、CsMTP3、CsMTP7的表达水平在不同组织和处理下普遍较高(图5)。为进一步揭示黄瓜CsMTPs基因对重金属胁迫的响应,本研究对黄瓜进行了包括Zn、Cd、Mn、Cu、Fe和Mo在内的5种金属处理,并借助qRT-PCR对根系和叶片中9个CsMTPs的表达水平进行了分析。结果表明,CsMTPs的表达水平可被不同金属诱导,即使有些金属不是MTP家族潜在的重金属底物。例如Cu可以诱导CsMTP4、CsMTP5、CsMTP6、CsMTP8、CsMTP9、CsMTP11和CsMTP12在根系和叶片中的差异表达。此外,CsMTP基因也可能不受其潜在的转运底物的诱导,例如Zn-ZDF亚家族的CsMTP6、CsMTP9和CsMTP12,在黄瓜叶片中均未受到Zn离子处理的显著诱导。类似的结果在杨树[13]和甜橙[11]中也有报道。这一结果可能与重金属浓度以及处理时间有关,后续实验应该设置更多重金属浓度梯度以及取样时间点,以便于更好地揭示CsMTP基因对不同金属离子的响应模式。
研究黄瓜CsMTP基因家族成员对不同重金属处理的响应情况可为其进一步的功能研究奠定基础。在拟南芥、水稻和黄瓜中,AtMTP1[34]、AtMTP3[28]以及CsMTP4[29]蛋白被证实不仅可以转运Zn离子,还能够将Cd离子(OsMTP1[39]、CsMTP1[29]和CsMTP4[29])、Co离子(OsMTP1[40]、HvMTP1[41]和AtMTP3[28])或Fe离子(OsMTP1[40])转运到植物细胞的液泡中。本研究中CsMTP3和CsMTP4的表达也受到Zn、Cd和Fe处理的诱导。拟南芥中,MTP5与MTP12可形成蛋白复合体,将Zn2+转运到拟南芥的高尔基体中[15]。本研究中,黄瓜根系MTP5与MTP12的表达水平在Zn2+处理后均显著下调,表明其表达受到Zn2+的诱导,但是其在黄瓜中的具体作用机制尚不清楚。拟南芥MTP8蛋白与Mn2+的稳态维持密切相关[16],Mn2+处理后,黄瓜叶片MTP8的表达水平显著下调。MTP9定位于质膜上,参与黄瓜根系细胞Mn2+和Cd2+的外排[17],类似的,本研究中,黄瓜根系CsMTP9的表达水平受到Mn2+和Cd2+处理的诱导,其表达水平在Mn2+和Cd2+处理后显著上调。在拟南芥和水稻中,MTP11转运蛋白可增强植物对Mn2+的耐受性[18]。Mn2+处理后,CsMTP11的表达水平在叶片和根系中分别显著上调和下调表达。这些结果表明,不同物种MTP基因的表达模式和功能存在一定的差异,且MTP基因对重金属处理的响应可能受到金属处理浓度和处理时期的影响。另外,也有研究显示,重金属转运也受到翻译水平的影响,包括MTP蛋白含量、定位等。由此可见,植物MTP对金属胁迫的响应十分复杂,受到转录和翻译等多个水平的影响。鉴于葫芦科物种的重要性,后续亟需对葫芦科物种MTP进行更加深入的研究。
