生姜淀粉的分子结构及理化特性
2021-07-21袁甜甜李奕霏叶发银刘栗君赵国华
袁甜甜,李奕霏,叶发银,2*,刘栗君,陈 婷,赵国华,2
淀粉是大多数植物的主要储能物质,也是重要的食品配料。与大宗粮食作物如玉米、小麦、大米、马铃薯中的淀粉得到广泛研究不同,具有药食同源特色植物中淀粉的研究相对不足。近年来,传统药食同源食材包括板栗[1]、莲子[2]、银杏果[3]、山药[4]、葛根[5]、贝母[6]、薏苡仁[7]等的淀粉结构及功能特性得以解析。Zeng 等[5]研究结果表明葛根淀粉中慢消化及抗消化组分含量高达59%,经普鲁兰酶脱支及温度循环处理,其抗性淀粉含量最大增幅81.9%。Chen 等[4]研究发现40 ℃及80 ℃热风干燥的山药粉的抗性淀粉含量最高,升糖指数GI<55;在其它温度热风干燥的山药粉GI 值则较高,其原因在于淀粉结晶结构及近程有序结构因干燥条件不同而发生不同程度改变,山药粉中多酚等共存组分在干燥中的变化对淀粉消化性可能存在影响有待阐明。Zeng 等[2,8]发现3 型莲子抗性淀粉(LRS3)能促进益生菌增殖,促进双歧杆菌生长的活性强于高直链玉米淀粉;LRS3 的20%乙醇沉淀物可以提高长双歧杆菌和德氏乳杆菌等益生菌对胃酸和胆酸耐受性。这些药食同源植物淀粉在对应食材里所起的营养作用及健康效应逐渐受到重视,其特殊的化学组成及分子结构为开发新型淀粉功能性配料提供了良好的物质基础。
生姜(Zingiber officinale Roscoe)是姜科姜属多年生草本植物,种植广泛,是我国的特色农产品之一。其块茎不仅是传统中药材、常用烹饪和炮制辅料,而且是重要的加工原料,可加工成姜片、泡姜、糖姜、姜汁、姜茶、生姜精油等产品。现有研究主要关注姜多糖、姜黄酮、姜辣素等生姜中的生物活性成分,对生姜淀粉认识不够深入。有研究报道生姜中淀粉含量从12.3%[9],45%[10]到56.0%[11]不等,加工副产物姜渣中淀粉含量更高[12-13],对其研究不仅有利于生姜资源综合利用,而且对探索新型淀粉配料大有裨益。Tetchi 等[14]研究指出,相比于山药、芋艿、木薯、甘薯等的淀粉,生姜淀粉的溶解性和膨润性小,具有良好的耐热性。Vieira 等[15]指出生姜淀粉经湿热处理相对结晶度无变化,而淀粉酶水解率增加了28.3%,回生值和冷糊黏度大幅降低。Braga 等[10]研究发现超临界流体法提取精油不会对姜渣淀粉组成及结晶度产生影响,而会造成崩解值增加和回生值降低。本研究以农艺学性状及种植环境存在较大差异的四川竹根姜和莱芜大姜的淀粉为对象,对比分析其结构组成和理化特性,以期为生姜淀粉的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
莱芜大姜和四川竹根姜(如图1),当地超市;马铃薯直链淀粉及蜡质玉米支链淀粉标准品、真菌淀粉葡萄糖苷酶,猪胰腺α-淀粉酶,Sigma 公司;氢氧化钠、盐酸、碘、无水乙醇、葡萄糖、3,5-二硝基水杨酸,均为分析纯,国药集团化学试剂有限公司;其它试剂为国产分析纯。
1.2 仪器与设备
L535-1 低速离心机,湖南湘仪实验室仪器开发有限公司;JA3003B 分析天平,上海精天电子仪器有限公司;HH-W420 恒温水浴锅,金坛市大地自动化仪器厂;HQ60 漩涡振荡器,北方同正生物技术发展公司;JA3003B 数显酸度计,杭州雷磁分析仪器厂;DHG-9070A 电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;JSM-6510 扫描电子显微镜,日本电子(JEOL)公司;TechMaster RVA 快速黏度分析仪,澳大利亚Newport Scientific 公司;D8 Advace 粉末X-衍射仪,德国Bruker 公司;L6可见分光光度计,上海精科科学仪器厂。
1.3 试验方法
1.3.1 生姜淀粉提取 将生姜洗去泥沙,刮去表皮后切碎,加水打浆,将浆液经100 目尼龙滤布过滤,滤渣再加水打浆提取一次,渣浆分离,合并浆液在室温下静置,去除上层清液,将剩余浆液进行离心(4 000 r/min,5 min),倾掉上清,刮去沉淀物表面褐色层物质(如图1),向沉淀中加入纯水,混匀后离心,重复上述操作直至沉淀物为洁净白色。将沉淀物置于45 ℃烘箱中干燥16 h,制得生姜淀粉。

图1 生姜原料及提取的生姜淀粉照片Fig.1 Images of ginger rhizomes and the extracted starches
1.3.2 生姜淀粉显微结构及结晶特性表征 显微结构:将少许淀粉样品用双面胶固定在载物台上,放入镀金设备中,使用离子溅射镀膜法给淀粉样品镀金20 min,置入扫描电镜中观测,电子枪加速电压15 kV,放大倍率1 000。淀粉颗粒尺寸测量及统计采用Nano Measurer 1.2 软件进行。结晶结构:取0.5 g 淀粉样品置于D8 Advace-Bruker X-衍射仪的样品盒中,采用步进扫描法。靶及波长:Cu,Kα,1.5406 A,Ni 滤波片;狭缝系统:DS/RS/SS=1.0/0.1/1.0 mm;探测器:闪烁计数器;电压:40 kV;电流:40 mA;扫描速度:2°/min;扫描范围:5~50°;步宽:0.02°。淀粉颗粒相对结晶度的计算方法参考Zhang 等[16]的计算方法,并采用MDI jade 6.5进行图形处理,相对结晶度=(衍射峰强度/总强度)×100%。近程结构:采用配制衰减全反射ATR组件的Nicolet iS50 傅里叶变换红外光谱仪(Thermo Fisher 公司),波数400~4 000 cm-1,分辨率4 cm-1,扫描次数32。
1.3.3 生姜淀粉基本组分分析 水分:直接干燥法测定(GB 5009.3-2016);灰分:灼烧法测定(GB 5009.4-2016);表观直链淀粉:碘比色法测定(GB/T 15683-2008);总淀粉:酸水解法测定(GB/T 5009.9-2016 第二法)。
1.3.4 生姜淀粉相对分子质量测定 生姜淀粉的相对分子质量采用凝胶渗透色谱-示差-多角度激光光散射仪(GPC-RI-MALLS)测定[17]。取10 mg 淀粉样品,加入1 mL 含0.45% LiBr 的DMSO,混匀后沸水浴使淀粉分子充分溶解,过0.22 μm PTFE膜去除不溶性杂质,取100 μL 上 样。分析 柱Styragel HR 3,Styragel HMW 6E 及Styragel HMW 7 三柱依次串联,流动相含0.45% LiBr 的DMSO(色谱级),流速0.3 mL/min,多角度激光光散射仪He-Ne,λ=658 nm。采用系统自带软件Astra 5.3.4.20 计算重均分子质量(Mw)及数均分子质量(Mn)。
1.3.5 支链淀粉链长分布测定 采用丁醇沉淀法去除样品中的直链淀粉[18],接着对支链淀粉进行脱支处理制备分析样品,采用阴离子交换色谱(HPAEC-DAD)测定其链长分布[19]。步骤为,样品采用0.5 mol/L 氢氧化钠溶液制备悬液,在沸水浴中搅拌至体系清澈透明,离心 (8 000 r/min)10 min,用2 mol/L 盐酸调至中性,加入丁醇-异戊醇(3∶1)混合液,沸水浴中搅拌10 min 后,冷却至室温,于4 ℃冰箱中静置24 h 取出,离心(8 000 r/min)10 min,上清液即为粗支链淀粉。上清液置于分液漏斗中,加入体积比1∶1 的丁醇-异戊醇混合液,沸水浴10 min,冷却后4 ℃冰箱中静置48 h,离心(8 000 r/min)10 min,离心液中缓缓加入两倍体积无水乙醇,4 ℃冰箱中静置24 h,将沉淀溶于热的0.5 mol/L 氢氧化钠溶液中,用无水乙醇洗涤,室温下干燥48 h 得纯支链淀粉。称取5 mg 样品,加5 mL ddH2O,沸水浴60 min。取2.5 mL 糊化样品,加入125 μL 乙酸钠,25 μL NaN3和5 μL 异淀粉酶,38 ℃放置24 h,灭酶、干燥。将样品溶于600 μL 流动相,离心10 min,取上清上样。HPAEC-DAD 测定条件为,流动相:0.1 mol/L NaOH+0.5 mol/L NaAC。流速:0.5 mL/min。采用Chromeleon 7.2 软件对数据进行分析。以链长(DP)为横坐标,百分比为纵坐标生成柱状图。
1.3.6 生姜淀粉的水合性质测定 称取0.1 g 干淀粉(预先105 ℃处理2 h)于试管,向其中加入10 mL 去离子水,室温下搅拌30 min;接着将样品分别置于65,75,85,95 ℃水浴中保温1 h。然后迅速将其冷却到室温,并转移到离心管中离心(3 000 r/min,15 min)。溶解性(%)为上清液干物质(105 ℃烘干至恒重)占干淀粉(0.1 g)的百分比;膨润性(g/g)为湿淀粉(离心沉淀物)与其干物质之比。
1.3.7 生姜淀粉的糊化性质测定 准确称取3.000 g 淀粉,倒入已加入定量蒸馏水(根据淀粉含水量,由软件得出)的RVA 专用铝盒中,混合均匀,置于RVA 仪测定糊化参数。测定条件:10 s 内转速由960 r/min 的速度降到160 r/min 并保持稳定。50 ℃维持1 min,以10 ℃/min 升温至95 ℃,在95 ℃保持5 min,然后以10 ℃/min 的速度冷却到50 ℃,在50 ℃保持2 min。测得淀粉糊黏度曲线,并通过RVA 专用测试软件分析计算糊化温度、峰值黏度、谷值黏度、崩解值、最终黏度和回生值等参数[20]。
1.3.8 生姜淀粉的流变学性质测定 取生姜淀粉样品在RVA 仪器下制备质量分数为6%的淀粉糊,参考张雅媛等[21]的方法,采用平板-平板测量系统,平板直径40 mm,设置间隙1 mm。动态黏弹性测定:测定温度25 ℃,通过预实验中对线性黏弹区的测定,确定扫描应变值为1%,测定振荡频率设为0.1~10 Hz 内贮能模量 (G')、损耗模量(G'')、损耗角正切tanδ 随角频率(0~500 rad s-1)变化的情况,测定样品的黏弹性。动态时间扫描:将样品置于平板上进行温度平衡5 min,温度25℃,扫描应变1%,在频率1 Hz 条件下测定2 400 s内样品贮能模量(G')和tanδ 的变化情况。
1.3.9 生姜淀粉凝胶的冻融稳定性测定 配制质量分数为6.0%的淀粉乳,于沸水浴中加热糊化并维持15 min。称取一定质量的淀粉糊置于离心管中,在-18 ℃的冰箱中放置,每隔24 h 取出于室温下解冻,离心(3 000 r/min,15 min)弃上清,称取沉淀物质量,按照式(1)计算析水率。

式中:P——析水率,%;M1——脱水前淀粉凝胶的质量,g;M2——脱水后淀粉凝胶的质量,g。
1.3.10 生姜淀粉凝胶的质构特性表征 配制质量分数为10%的生姜淀粉乳沸水浴加热糊化并保温20 min,取一定量的淀粉糊置于10 mL 烧杯中,静置冷却至室温,密封,于4 ℃冰箱中静置24 h,切成φ20 mm,高10 mm 的圆柱形样品。样品用TA-XT2i 质构分析仪测定,测定模式为T.P.A 模式;TA4/1000 探头(直径0.4 英寸的圆柱状平头探头);测试前探头速率:2.0 mm/s;测试时探头速率:1.0 mm/s;测试后探头速率:1.0 mm/s;压缩程度:45%;触发类型:自动;触发力:4 g。
1.3.11 生姜淀粉的消化特性表征 分别测定生淀粉和糊化后淀粉的酶解消化性,参照Miao 等[22]的方法,具体步骤为,将样品加入到磷酸盐缓冲液(0.2 mol/L,pH 5.2)中,与猪胰腺α-淀粉酶、真菌淀粉葡萄糖苷酶混合,37 ℃振荡(150 r/min),分别于20,120 和180 min 取样,用无水乙醇终止反应后,3,5-二硝基水杨酸法测定还原糖含量。对于熟淀粉,用磷酸盐缓冲液制备淀粉悬液,沸水浴中充分糊化后于37 ℃保温5 min,按前述方法酶解。快消化淀粉(RDS)、慢消化淀粉(SDS)及抗性淀粉(RS)分别按照式(2)、式(3)和式(4)计算[6]。
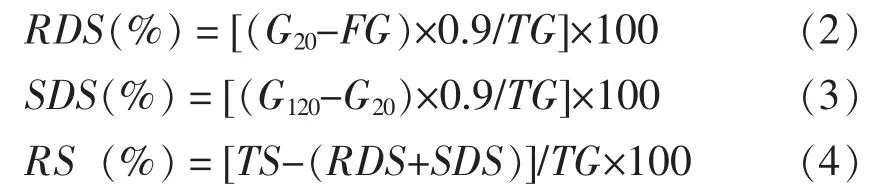
式中:G20和G120分别为20 min 及120 min 时葡萄糖的释放量(mg);FG 和TG 分别为原样中游离葡萄糖含量(mg)和总葡萄糖当量(mg)。
1.4 数据处理及统计分析
所有试验至少重复3 次,结果以平均值±标准差表示;通过SPSS 18.0 对数据进行单因素方差分析,采用Duncan's 多重比较,以P<0.05 为差异具有统计学意义。
2 结果与讨论
2.1 生姜淀粉的颗粒形态及结构特性
2.1.1 生姜淀粉的显微结构 由图2可知,生姜淀粉颗粒呈现不同形态特征,较大颗粒呈葵花籽型(长轴30~37 μm,短轴15~23 μm),与芒果姜(Curcuma amada Roxb.)淀粉的形态极相似[23];中等大小的颗粒呈圆盘状(直径10~15 μm);较小颗粒呈椭球或多角型(5~10 μm)。Reyes 等[9]报道生姜淀粉长轴均值(24.4±8.7)μm,短轴均值(21.1±7.0)μm。Braga 等[10]报道生姜淀粉颗粒长轴10~28 μm。莱芜大姜淀粉与Braga 等[10]报道的生姜淀粉的形态大小基本一致。四川竹根姜淀粉的平均粒径 (16.83±0.89)μm 大于莱芜大姜淀粉(13.63±1.60)μm,这一方面与品种有关,另一方面可能与生长周期有关。相对而言四川竹根姜生长周期较长,因而淀粉颗粒有较长的生长时间。此外,Li等[24]的研究发现姜黄淀粉同样具有形态和尺寸上的多样性。

图2 生姜淀粉的扫描电镜图Fig.2 Scanning electron micrographs of ginger starches
2.1.2 生姜淀粉的结晶结构 由图3可知,生姜淀粉在15.0°,17.3°,18.2°和23.1°具有典型衍射峰,不同之处是四川竹根姜淀粉在5.8°有一个小衍射峰。四川竹根姜淀粉为CA 型(即接近A 型的C 型[25]),莱芜大姜淀粉为A 型。Reyes 等[9]报道生姜淀粉为A 型结晶;Zhang 等[16]报道黄姜(Dioscorea zingiberensis C.H.Wright) 以及Li 等[24]报道姜黄(Curcumae longae L.)的淀粉均为A 型结晶,而Braga 等[10]报道生姜淀粉为C 型结晶。同一作物的淀粉具有多种晶型是常见现象,例如甘薯淀粉有A、B、CA、CB 及CC 等多种晶型[25-26]。莱芜大姜淀粉的相对结晶度为29.9%,而四川竹根姜淀粉的为37.5%,与Li 等[24]报道姜黄淀粉的结果(相对结晶度39.62%)接近。
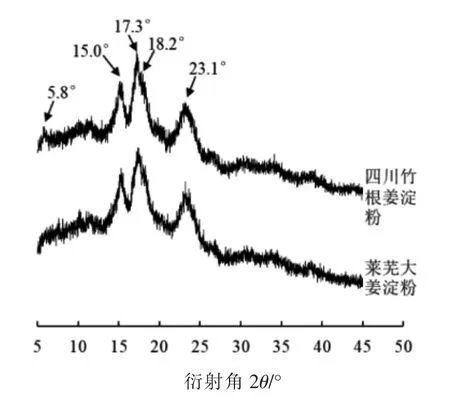
图3 生姜淀粉的X-射线衍射图谱Fig.3 X-ray diffraction pattern of starches from two ginger cultivars
2.1.3 生姜淀粉的近程结构 红外光谱常与X-射线衍射组合用于解析淀粉分子的有序结构[1,6]。由图4a 可知,两个品种生姜的淀粉在IR 吸收谱带上无明显差异。3 000~3 650 cm-1范围的宽峰为淀粉的游离羟基(-OH)的伸缩振动峰,1 154 cm-1是C-O 键伸缩振动峰,928 cm-1是D-吡喃葡萄糖环的非对称伸缩振动峰[27]。同时,IR 谱带上(1 045/1 022) cm-1及(1 022/995) cm-1峰强度比值常被看作是淀粉分子近程有序结构的指征,原因在于1 022 cm-1附近吸收峰的吸光值随无定型程度增加而增加,1 045 cm-1对应吸收峰的吸光值随近程有序 (short-order) 程度增加而增加,995 cm-1对应吸收峰则随淀粉分子螺旋结构的增加而增加[6,24]。结果表明,四川竹根姜淀粉及莱芜大姜淀粉的(1 045/1 020) cm-1分别为0.545±0.004 和0.528±0.002(P<0.05);对于(1 020/995) cm-1前者0.907±0.006 后者0.918±0.003,表明四川竹根姜淀粉(CA型)近程有序程度高于莱芜大姜淀粉(A型)。
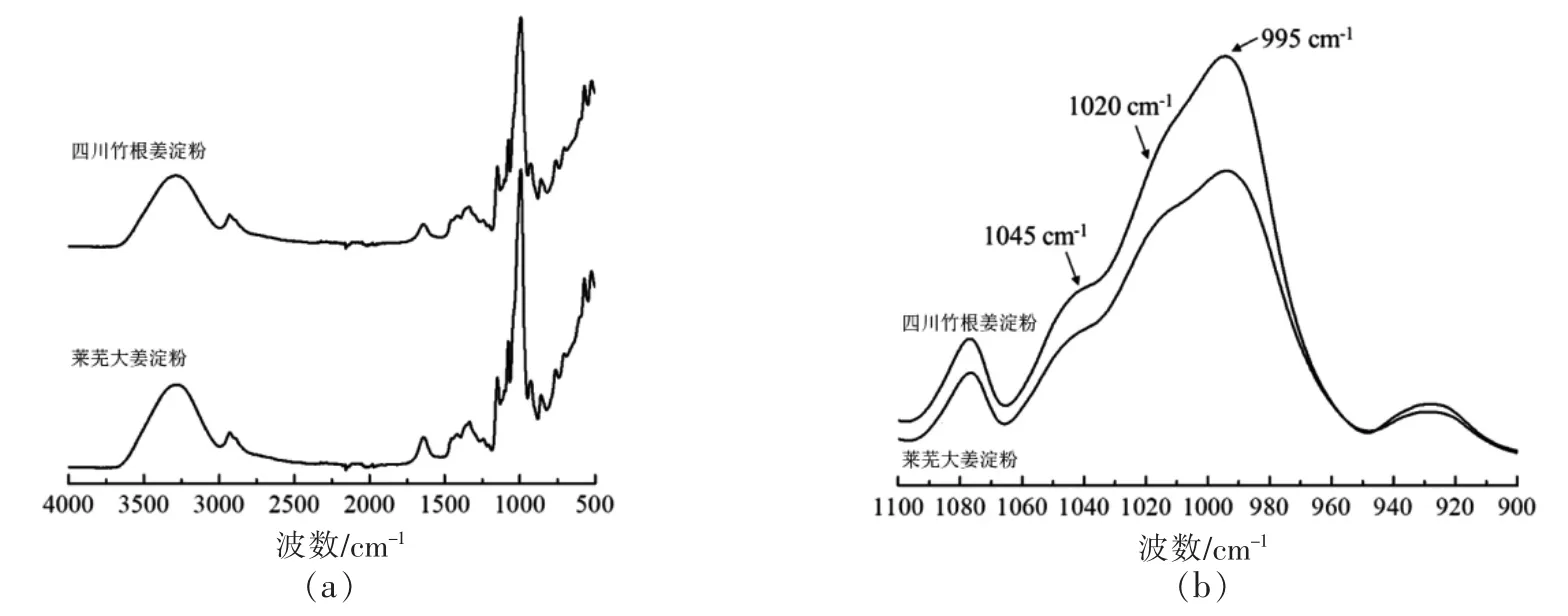
图4 生姜淀粉的FT-IR 图谱(a)和FT-IR 局部放大图谱1 100~900 cm-1(b)Fig.4 The full range of FT-IR spectra (a) and enlarged FT-IR spectra in the range of 1 100~900 cm-1 (b)of ginger starches
2.2 生姜淀粉的基本成分
结果表明,四川竹根姜淀粉及莱芜大姜淀粉的水分含量分别为(8.51±0.11)g/100 g、(9.83±0.47)g/100 g;灰分含量:前者(0.41±0.06)g/100 g(干基),后者(0.52±0.08)g/100 g(干基);总淀粉含量依次为(86.40±0.50)g/100 g(干基)和(87.85±0.36)g/100 g (干基);表观直链淀粉含量分别为(34.10±0.45)g/100 g(干基)和(31.67±0.52)g/100 g(干基),具有显著性差异(P<0.05)。Reyes 等[9]报道生姜淀粉中直链淀粉含量为22.2%,李媛等[12]报道莱芜生姜直链淀粉含量为27.47%,而Braga 等[10]报道生姜淀粉中直链淀粉含量为34%。
2.3 生姜淀粉的分子结构
由图5a 可知,两个品种的生姜淀粉在GPCRI-MALLS 图谱上的洗脱峰基本相似,均方根半径矩(rms radius moments) 四川竹根姜淀粉Rw=102.7 nm,莱芜大姜淀粉Rw=97.4 nm;重均分子质量,前者Mw=2.22×107g/mol,后者Mw=1.58×107g/mol;同时,四川竹根姜淀粉中淀粉分子的多分散性(Mw/Mn=1.28)要高于莱芜大姜淀粉(Mw/Mn=1.05)。从图5b 可见,两种淀粉颗粒的淀粉分子的共同点在于均呈多峰分布,主峰均在(1~1.5)×107g/mol,第二峰在(1.5~2)×107g/mol;区别在于莱芜大姜淀粉只检测到(1.05~2.24)×107g/mol 范围的组分,而且存在精细分离的小峰,说明其组分的聚合度不是连续变化的,但是四川竹根姜淀粉中存在可检测的物质的量大于2.24×107g/mol 的组分,这些组分占比达20.1%,最大分子质量可能达到4.81×107g/mol,故四川竹根姜淀粉的重均分子质量更大且分子质量的分布更宽。Li 等[24]报道姜黄淀粉Mw=2.208×107g/mol,Mw/Mn=1.146,与本研究的结果相近。
图5 生姜淀粉摩尔质量及MALLS 信号的洗脱时间曲线(a)和相对分子质量分布(b)Fig.5 GPC-RI-MALLS chromatograms (a) and the molar distribution profiles (b) of starches extracted from ginger
由图6可知,两种生姜的淀粉具有不同的支链淀粉链长分布特征。其中,四川竹根姜淀粉中的支链淀粉链长呈双峰(DP12 和DP46)分布,且含有相对较多的长链(DP≥37),而莱芜大姜淀粉的支链淀粉链长呈单峰分布,分子中以短链(DP=6~12)为主。结果表明,四川竹根姜淀粉的平均链长为31.08,莱芜大姜淀粉平均链长为20.78,具有显著性差异。由此可见两种原料因品种及栽培环境不同,使得合成的淀粉颗粒中支链分子存在链长分布的多样性。在块茎块根类淀粉如马铃薯和甘薯淀粉(主峰在DP13,次峰在DP48)及山药淀粉中,支链淀粉侧链链长一般呈双峰分布[28-29]。支链淀粉的链长分布主要与淀粉分支酶的活性有关,如玉米粒中分支酶I 优先催化DP>10 的支链生成且分支位点较稀疏,而分支酶II 主要催化DP3~9支链生成且促使形成较高支化度的支链淀粉[30]。Sawada 等[31]通过基因工程手段可将稻米胚乳中支链淀粉的链长分布从双峰调整为单峰。因此,相对于莱芜大姜淀粉,四川竹根姜淀粉中DP≤12 的短链减少以及DP≥37 的长链增加可能与各自对分支酶活性的调节有关。此外,鉴于四川竹根姜淀粉中表观直链淀粉含量与支链淀粉平均链长均高于莱芜大姜淀粉,有可能颗粒结合型淀粉合成酶I(GBSSI)在负责催化直链淀粉合成的同时,参与了支链淀粉侧链的合成[32]。
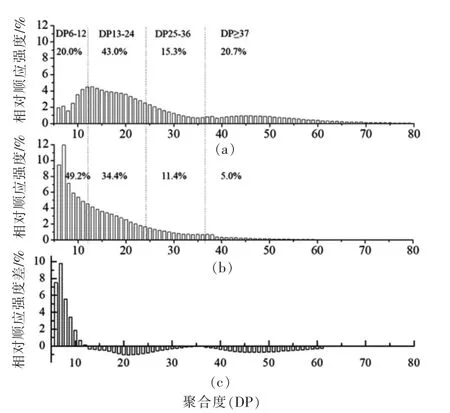
图6 生姜淀粉支链淀粉链长分布谱图Fig.6 Chain length distribution of amylopectin molecules from ginger starches
2.4 生姜淀粉的水合性质
由图7可知,两种生姜淀粉的溶解性及膨润性均随温度上升而增加,且85 ℃以上时增加幅度明显增大。这是因为起初温度较低水分子主要进入淀粉颗粒的无定型区,淀粉颗粒吸水膨胀及淀粉分子漏出程度有限;当温度上升到可以使结晶结构破坏时,水分子大量进入此区域与淀粉分子结合,淀粉颗粒迅速吸水膨胀且漏出量大幅增加[24]。Reyes 等[9]研究也发现生姜淀粉的溶解性和膨润性在90 ℃以上时才大幅上升。Afolayan 等[33]报道生姜淀粉的膨润性为11.07 g/g,与本研究接近。两种淀粉在不同温度条件下的膨润性无显著性差异,但溶解性有所不同,莱芜大姜淀粉溶解性高于四川竹根姜淀粉,这可能与其直链淀粉更易漏出有关。相对于马铃薯、木薯等的淀粉,生姜淀粉具有较低的膨润性[34]。
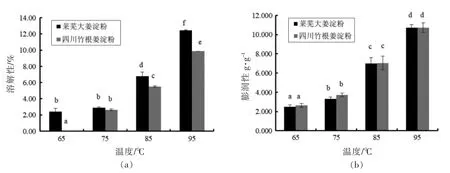
图7 两种生姜淀粉的溶解性及膨润性比较Fig.7 The solubility and swelling power of starches extracted from two ginger cultivars
2.5 生姜淀粉的糊化及胶凝特性
从图8可知,四川竹根姜淀粉比莱芜大姜淀粉的糊化起始时间靠前,其糊化温度(87.8 ℃±0.5℃) 显著低于后者(91.06 ℃±0.49 ℃),且在整个RVA 图谱上,前者的黏度呈单调上升趋势,这与Reyes 等[9]对生姜淀粉进行布拉班德黏度测试时观测的结果一致。在对应于莱芜大姜淀粉热糊失稳区间(指从峰值黏度到热糊黏度的温度区间)上,四川竹根姜淀粉体系的黏度从(2 314.33±127.89)cp 上升到(2 418±105)cp,而莱芜大姜淀粉体系从峰值黏度(1 999.33±73.8)cp 下降到(1 923±55.05)cp,后者表现出轻度的热糊失稳 (衰减值76.33 cp±19.03 cp),表明四川竹根姜淀粉具有良好的耐热及耐剪切性[29]。在从95 ℃到50 ℃的程序降温过程中,川竹根姜淀粉体系的回生值 (1 327.67±31.02)cp(冷糊黏度与降温点黏度的差值)显著高于川竹根姜淀粉体系的回生值(699±14.42)cp,且前者冷糊黏度为(3 642±155)cp,远高于后者(2 622±64.55)cp,表明川竹根姜淀粉具有更强的增稠能力[1]。
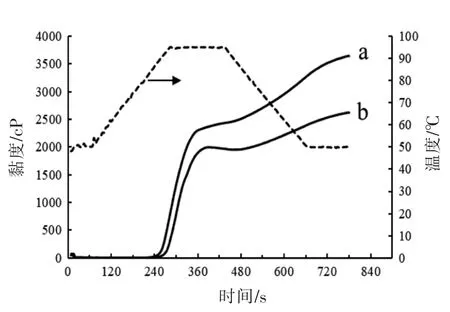
图8 生姜淀粉的糊化曲线Fig.8 Pasting profiles of ginger starches
由图9可知,从0~360 rad/s,淀粉糊的弹性模量(G′)和储能模量(G′′)表现出一定的频率依赖性;同时,两种生姜淀粉糊的损耗角正切值(tanδ)均<1,表明淀粉糊具有一定刚性。四川竹根姜的tanδ 更小,糊的刚性更强[35]。随着角频率增加,两种淀粉糊的tanδ 均呈增大趋势,表明淀粉糊的刚性随之减弱。
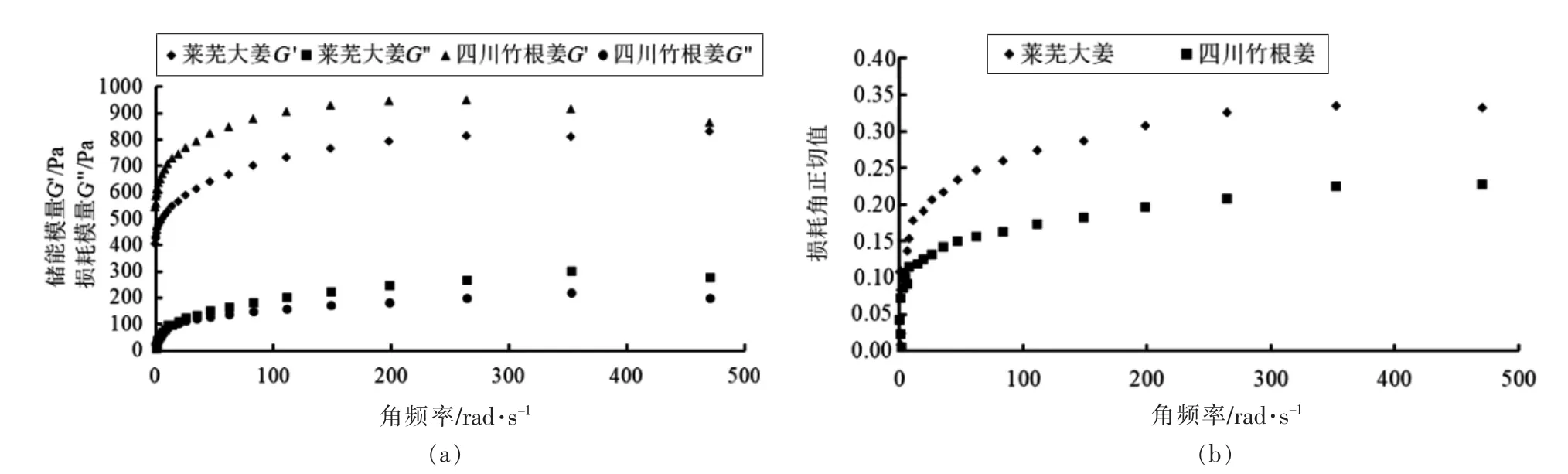
图9 生姜淀粉糊的弹性模量(G′)、储能模量(G′′)和损耗角正切值(tanδ)随角频率变化图谱Fig.9 Variation of G′,G′′,and tanδ with angular frequency for ginger starch pastes
由图10可知,生姜淀粉糊在保温期间(0~2 400 s)弹性模量(G′)随时间增加,tanδ 则逐渐降低,表明淀粉糊因淀粉分子重结晶使得刚性逐渐增强,淀粉糊发生了明显的胶凝作用[36]。由于两个样品的G′随时间逐渐拉大,四川竹根姜淀粉具有较大的重结晶速度[37]。
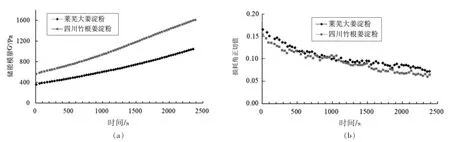
图10 生姜淀粉糊(质量分数6%)的时间扫描图谱Fig.10 Time sweeps of the ginger starch pastes (6% w/w)
淀粉凝胶在反复冻融过程中常发生析水,这是由于冻融过程中淀粉分子链之间的自聚集造成水合能力下降和凝胶网络收缩,使水从凝胶结构中析出[38]。由图11可知,生姜淀粉糊在首次冷冻-解冻处理后即产生析水,且析水率随冻融次数增加而增加,但第3 次的析水速度明显放慢;此外,相同循环次数时两种生姜淀粉糊的析水率并无显著性差异(P>0.05)。析水率过高会影响其在凝胶食品中的应用[39]。生姜淀粉凝胶的析水率高于木薯、糯粳稻等的淀粉凝胶,但相对而言仍偏低,远低于疣柄魔芋、芭蕉芋、土豆和板栗等的淀粉凝胶[1,40]。
由表1可知,四川竹根姜淀粉凝胶比莱芜大姜淀粉凝胶的硬度高,弹性更好,这可能与前者含有较多直链淀粉及较长侧链的支链淀粉分子有关,更有利于形成机械强度更好的凝胶结构[35],这与图11观测到的结果一致。黏性指下压1 次后将探头从试样中拔出所需的能量,反映了凝胶被咀嚼时,其对口腔咀嚼接触面黏着的性质。表1中四川竹根姜淀粉凝胶比莱芜大姜淀粉凝胶的黏性低,表明前者可赋予淀粉制品更好的口感,实际上四川竹根姜淀粉凝胶的咀嚼性显著高于莱芜大姜淀粉凝胶(表1)。

表1 生姜淀粉凝胶的质构参数Table 1 Texture parameters of ginger starch
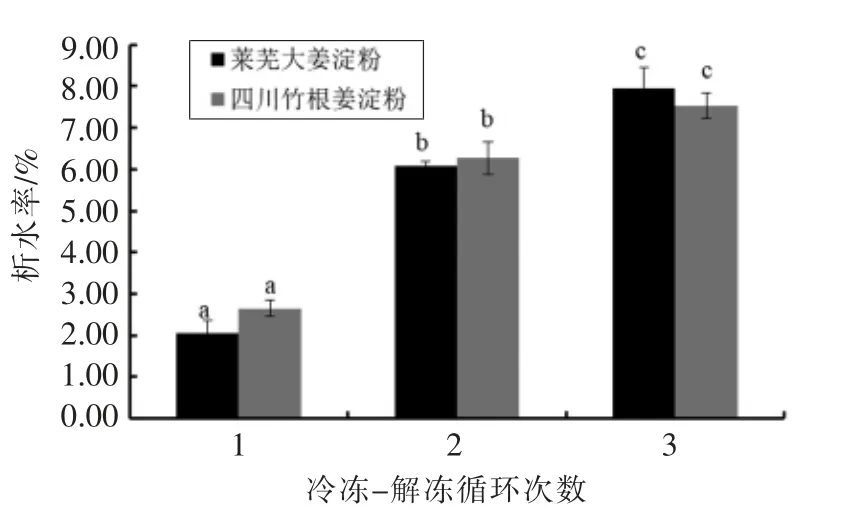
图11 生姜淀粉糊的析水率Fig.11 Syneresis of ginger starch pastes
2.6 生姜淀粉的消化特性
由表2可知,生淀粉颗粒对淀粉酶不敏感,两种淀粉的RDS 和RS 组分含量无显著性差异,但莱芜大姜淀粉的SDS 组分含量高于四川竹根姜淀粉。这可能与莱芜大姜淀粉的支链淀粉分子中具有较高比例的短链有关,这些短链分布在外链,由于无法形成螺旋结构而容易酶解[41]。生姜淀粉糊化后,淀粉分子从结晶区解聚,对酶的敏感性增强,因而RS 组分含量大幅下降[42]。此外,莱芜大姜熟淀粉含有较多RDS 组分和较少SDS 及RS 组分,这可能与它含有短侧链的支链淀粉分子以及较慢的重结晶速度有关。

表2 未糊化的及已糊化的生姜淀粉体外消化后RDS,SDS 和RS 的质量百分比Table 2 The percentage of RDS,SDS and RS of uncooked and cooked ginger starches
3 结论
从四川竹根姜和莱芜大姜中提取淀粉,对比研究了两种淀粉的结构组成和功能特性。研究发现,生姜淀粉颗粒具有形态多样性,四川竹根姜淀粉的平均粒径较大。四川竹根姜淀粉为CA 型,而莱芜大姜淀粉为A 型。四川竹根姜淀粉分子的近程有序程度更高,重均分子质量、分子质量分布系数、直链淀粉含量以及支链淀粉平均链长均大于莱芜大姜淀粉。两种生姜淀粉的溶解性及膨润性随温度升高而增加;快速黏度分析结果表明,生姜淀粉具有良好的耐热及耐剪切能力,成糊后容易回生;流变学分析结果表明,生姜淀粉呈现一定刚性,且刚性随着老化时间延长而增强。生姜淀粉经冻融处理会产生析水,但两种淀粉析水率无显著性差异。质构分析结果表明,四川竹根姜淀粉凝胶比莱芜大姜淀粉凝胶的硬度高,弹性更好,咀嚼性更佳。体外消化结果表明,生淀粉颗粒较难被淀粉酶水解,但糊化后抗消化组分含量大幅降低,但糊化后的四川竹根姜淀粉比莱芜大姜淀粉含有更多抗消化组分。
