大米储藏期间风味品质的变化研究
2021-07-21赵卿宇王占占陈博睿
赵卿宇,王占占,陈博睿,沈 群
大米是许多国家的重要食物,为其饮食提供必需和微量营养素[1]。2014年中国的大米产量约为1.72 亿t,位居世界第一[2]。大米主要分为粳米、籼米和糯米。粳米主要分布于我国东北、华东太湖流域、华北、西北等温度较低的地区,其中盐丰和辽星大米是东北地区重要粳米品种。为在全年或紧急情况下维持消费者需求,应储存一定数量的大米。温度是大米储藏的重要因子,低温可以延缓大米表面脂质氧化变质,保护其免受真菌、昆虫的侵害。然而,中国东南部和南部的夏季温度高达38~41℃,海洋运输中的储藏温度甚至可达70℃,故研究不同温度对储藏大米的影响是必要的。
在储存期间,大米发生物理、化学变化,品质劣变过程便立即开始,其营养成分和感官品质均下降[3-5]。已有许多研究报道储藏大米的糊化特性、质地特性、理化特性和蒸煮特性等的变化[6-9],然而,目前对风味的变化研究主要集中在挥发性物质上,较少关注味感物质,对大米储藏期间风味的研究尚不充分。影响大米味感的物质主要是游离性氨基酸和可溶性糖,其中游离性氨基酸主要分为鲜、甜和苦3 类,可溶性糖主要包括蔗糖、葡萄糖和果糖。先前的研究[10]发现大米在室温储存期间,蔗糖和游离氨基酸含量降低,葡萄糖和果糖含量显著增加,麦芽糖含量变化很小,这些变化会影响大米的甜味和鲜味。此外,通过快速检测技术(电子舌、电子鼻等)预测样品质量参数已有相关研究[11-12],而关于储藏大米中味感物质的预测鲜有报道。挥发性物质的组成及含量和大米的新陈度密切相关,目前国外已将大米挥发性物质变化作为其品质劣变的特征标志物。储藏期间大米气味的不良变化可能是由于气味成分的结构破坏和迁移损失,也可能因形成与挥发性脂质氧化产物有关的异味[13]。
本文以盐丰和辽星大米为研究对象,通过含量和滋味活性值变化揭示储藏期间氨基酸和可溶性糖对大米味感的贡献程度。采用GC-MS 对储藏期间的大米挥发性物质进行定性分析,找出储藏大米产生异味的原因。同时运用电子舌和电子鼻技术,建立储藏期间大米的指纹图谱和味感物质含量预测模型,旨在为大米实际储藏和流通过程中风味品质保障提供技术支持。
1 材料与方法
1.1 材料与试剂
原料与预处理:“盐丰”和“辽星”大米,中储粮沈阳直属库提供。两种大米收获年份均为2017年。取新收获稻谷用小型砻谷机去壳得到糙米,在碾米机上制成GB 1354-2018《大米》规定的标准一等大米,两种大米理化成分见表1。将制得的大米密封于聚乙烯袋中,置4,30 ℃和70 ℃以及50%相对湿度下的生化培养箱中300 d,每隔75 d取样,随后将大米研磨后过35 目筛,备用。
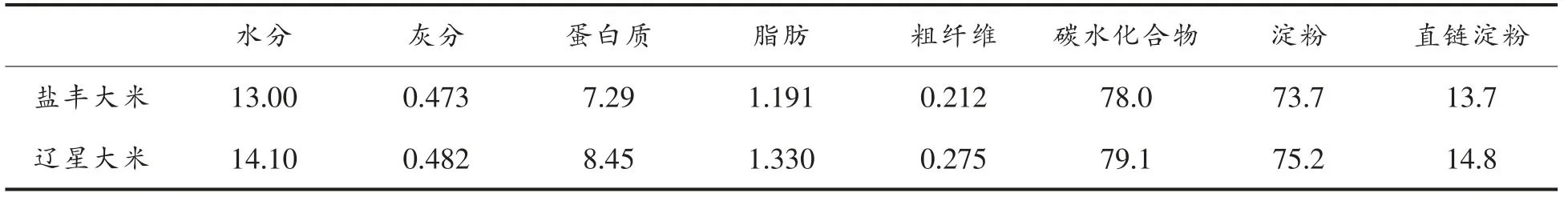
表1 两种大米的基本营养成分(g/100g)Table 1 Basic nutrients of two kinds of rice(g/100g)
试剂:混合氨基酸标准溶液、葡萄糖、蔗糖、果糖、麦芽糖标准品,Sigma 公司;其它试剂均为分析纯级,北京化学试剂公司。
1.2 仪器与设备
L-8900 氨基酸分析仪,日立高新技术公司;ICS-3000 离子色谱仪,配电化学检测器Thermo公司;DIONEX CarboPacTM PA1 柱,Thermo 公司;α-Astree 电子舌,法国Alpha M.O.S 公司;7890A-5975C 气质联用仪,美国安捷伦公司;FOX4000 电子鼻,法国Alpha M.O.S 公司。
1.3 方法
1.3.1 氨基酸的测定 采用GB 5009.124-2016《食品中氨基酸的测定》 测定大米中天冬氨酸、谷氨酸、苏氨酸、丝氨酸、甘氨酸、丙氨酸、脯氨酸、缬氨酸、赖氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、组氨酸、精氨酸和蛋氨酸的含量。
1.3.2 可溶性糖的测定 采用GB5009.8-2016《食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》测定大米中葡萄糖、蔗糖、果糖的含量。
1.3.3 TAV 的计算 TAV 是各种呈味物质在样品中的含量与它对应的味道阈值之比。它反映单一化合物对味道特征的贡献:当TAV 小于1 时,该物质对味道的贡献很小,当TAV 大于1 时对味道贡献显著。其中,氨基酸和可溶性糖的阈值参见文献[14-15]。
1.3.4 电子舌分析 称量3 g 米粉用300 mL 沸水浸泡30 min。冷却至室温后,过滤样品,滤液用于测定。电子舌中每个样品的采集时间为120 s,清洗时间10 s。
1.3.5 固相微萃取 取3 g 大米置于20 mL 顶空瓶中,加入3.9 mL 饱和食盐水。在70 ℃下平衡40 min,然后将固相微萃取头插入顶空瓶中距液面1 cm 处,萃取60 min 后迅速拔出,直接进入气相色谱进样口,热解吸5 min,最后通过GC-MS 分析、鉴定。
1.3.6 GC-MS 参数条件及分析
1.3.6.1 气相色谱条件 DB-WAX 毛细管柱(30 m×0.25 mm,0.25 μm);载气为氦气,流速1 mL/min。无分流模式,进样口温度250 ℃。初始柱温40 ℃,保持2 min,以4 ℃/min 升至230 ℃并保持4.5 min,全程54 min。
1.3.6.2 质谱条件 接口温度250 ℃,离子源为EI,离子源温度200 ℃,电子能量70 eV,扫描范围(m/z)33~450 amu,采用全扫描采集模式。
1.3.6.3 定性与定量分析 通过计算机检索与NIST14 标准质谱库匹配(>80)以及比对保留指数进行定性,采用峰面积归一化法定量分析,求各挥发性成分的相对含量。
1.3.7 电子鼻 称取3 g 样品放入10 mL 进样瓶,压盖密封。电子鼻系统参数见表2。
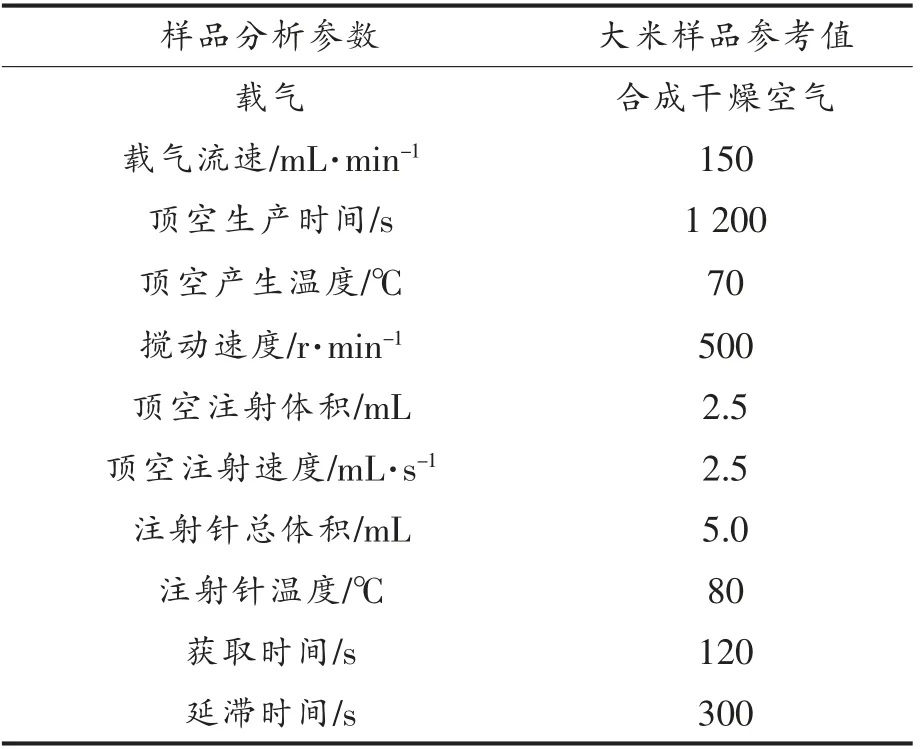
表2 电子鼻测试相关设置参数Table 2 Electronic nose test related setting parameters
1.3.8 数据分析 采用Alpha SOFTV9.1 软件对电子鼻和电子舌试验数据进行判别因子分析;采用SPSS 22.0 软件对数据进行方差分析,当P<0.05 时表示差异显著;采用Matlab 软件进行偏最小二乘法回归分析;采用OriginPro9.0 软件绘制图表。
2 结果与分析
2.1 氨基酸含量及呈味分析
大米中的游离性氨基酸主要分为鲜、甜和苦3 类,其中谷氨酸和天冬氨酸属于鲜味氨基酸;丝氨酸、甘氨酸、苏氨酸、丙氨酸和脯氨酸属于甜味氨基酸;亮氨酸、酪氨酸、异亮氨酸、苯丙氨酸、缬氨酸、赖氨酸、组氨酸、精氨酸和蛋氨酸属于苦味氨基酸[16]。
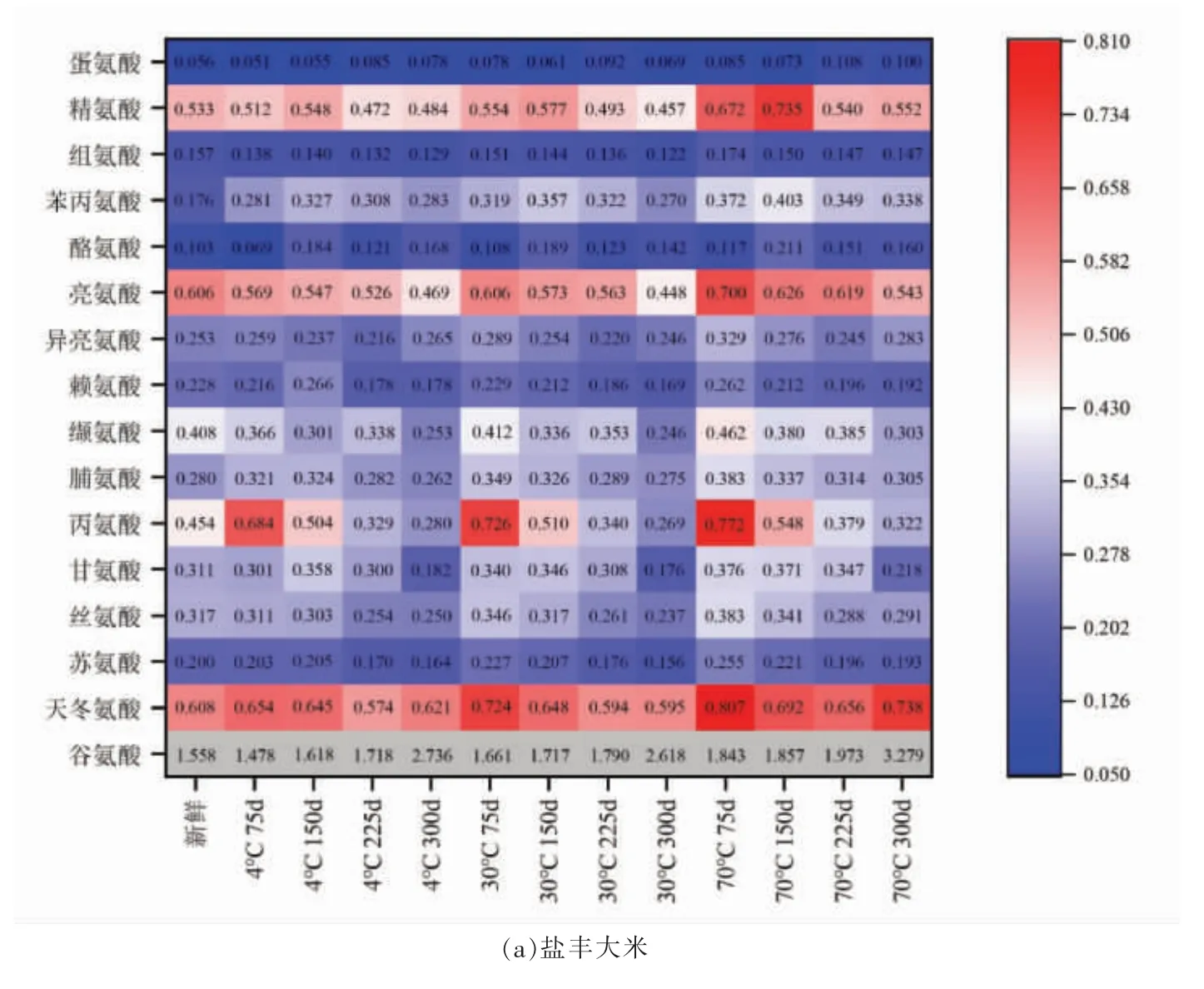
由图1可得,相同储藏温度下,鲜味氨基酸中的天冬氨酸在一定范围波动,而鲜味氨基酸中含量最高的谷氨酸呈上升趋势。谷氨酸是生物体碳氮代谢的关键氨基酸,其含量一方面受谷氨酸合酶、脯氨酸脱氢酶、蛋白酶和谷氨酰胺合成酶等积累,一方面受谷氨酸脱氢酶降解调节[17]。谷氨酸含量的增加可能是因为丙氨酸在丙酮酸转氨酶的作用下转换为谷氨酸,或脯氨酸在脯氨酸脱氢酶的作用下降解为谷氨酸[17]。甜味氨基酸中甘氨酸和丙氨酸变化明显,尤其是丙氨酸。丙氨酸含量的降低一方面和参与谷氨酸的生成有关,另一方面可能是因本身发生Streeker 降解产生乙醛。甘氨酸在储藏期间会自动降解和参与美拉德反应产生2,5-二甲基吡嗪[18]。此外,脯氨酸作为一种保护性氨基酸,有抑制蛋白降解的作用[19]。储藏期间脯氨酸含量降低,在某种程度上促进了游离性氨基酸含量的增加。苦味氨基酸中赖氨酸含量降低,是因为参与美拉德反应,并使大米表观颜色发生改变[20]。精氨酸和亮氨酸含量降低分别是因为参与挥发性物质的生成和Streeker 降解。
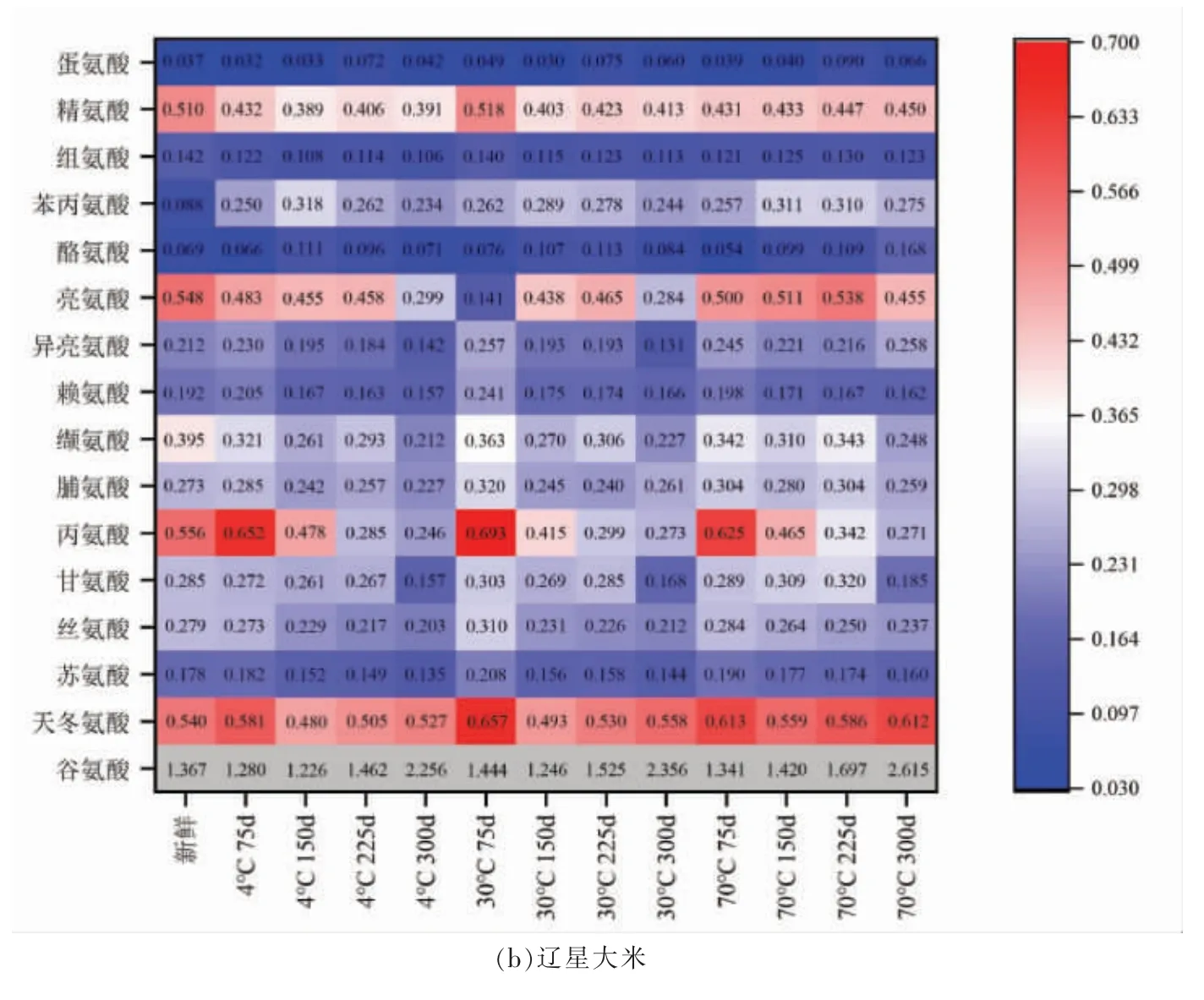
图1 储藏期间大米氨基酸含量变化热图Fig.1 Heat map of amino acid content in rice during storage
相同储藏时间下,高温比低温条件下游离性氨基酸含量高。早前研究发现大米在高温储藏期间蛋白质含量降低[21],说明温度升高可能促进蛋白质降解为游离性氨基酸。
食品体系中不同氨基酸的呈味作用不仅取决于本身具有的味道特征,还取决于各自的阈值、含量及与其它成分的相互作用。图2显示两种大米在储藏期间呈味氨基酸的TAV 变化。在鲜味氨基酸中,储藏期间天冬氨酸和谷氨酸的TAV 均大于1,其中谷氨酸鲜味最强,是重要的鲜味剂[22]。在甜味氨基酸中,两种大米中苏氨酸的TAV 均小于1,说明苏氨酸对甜味贡献较小;丝氨酸、甘氨酸和丙氨酸在储藏期间TAV 均大于1,其中丙氨酸对甜味的贡献较大。在苦味氨基酸中,精氨酸、缬氨酸和组氨酸对苦味的贡献较大,而大米中没有产生明显的令人不悦的苦味,这可能是由于在复杂的基质中呈味物质的相互作用产生消杀现象(即一种物质减弱或抑制另一物质味感的现象),使其它化合物的存在掩盖或抑制了苦味的呈现[23]。其中,天然精氨酸以L 型存在,有增加呈味复杂性和提高鲜度的作用[24]。组氨酸可以增强呈味效果。
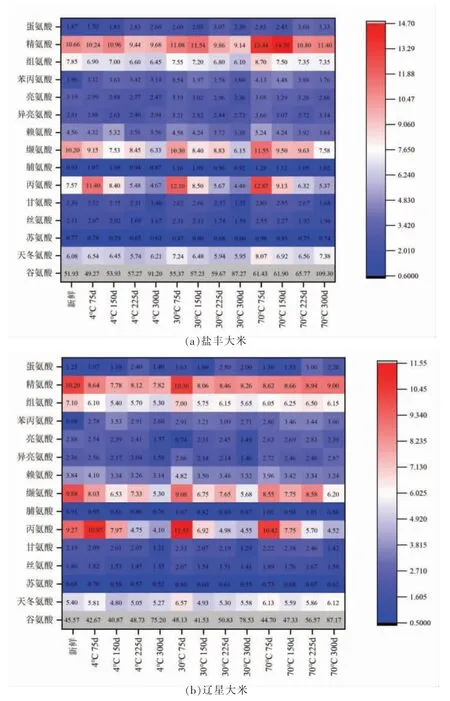
图2 储藏期间大米氨基酸TAV 变化热图Fig.2 Heat map of amino acid TAV in rice during storage
2.2 可溶性糖含量及呈味分析
由图3可得,至储藏期结束,盐丰的蔗糖含量均低于初始样品,而辽星4 ℃和30 ℃的大米样品蔗糖含量高于初始样品,70 ℃的大米样品蔗糖含量低于初始样品。先前的研究[10]指出大米在储存期间蔗糖减少,这表明淀粉和高分子质量糖经活性脱支酶催化后水解,降低了蔗糖和棉子糖等二糖和多糖的含量。随着储藏时间的延长,葡萄糖含量大致变化趋势是先上升后下降。至储藏期结束,4 ℃和30 ℃两种大米样品的葡萄糖含量几乎都高于初始样品,而70 ℃样品的葡萄糖含量都低于初始样品。葡萄糖含量上升可能是因淀粉发生了水解,而其下降则是因储藏期间大米的呼吸作用旺盛,消耗了大量的葡萄糖[25]。至储藏期结束,盐丰大米的果糖含量均低于初始样品,而辽星大米样品4 ℃时的果糖含量低于初始样品,30 ℃和70 ℃样品的果糖含量则高于初始样品。其原因可能是果糖含量由淀粉和棉子糖等物质水解为果糖的量以及果糖被微生物分解利用的量两者共同决定,含量降低是因生物体内果糖被微生物分解的量大于其合成的量,含量增加则因温度升高促进了水解,导致淀粉和棉子糖等物质水解为果糖的量大于其被分解的量。
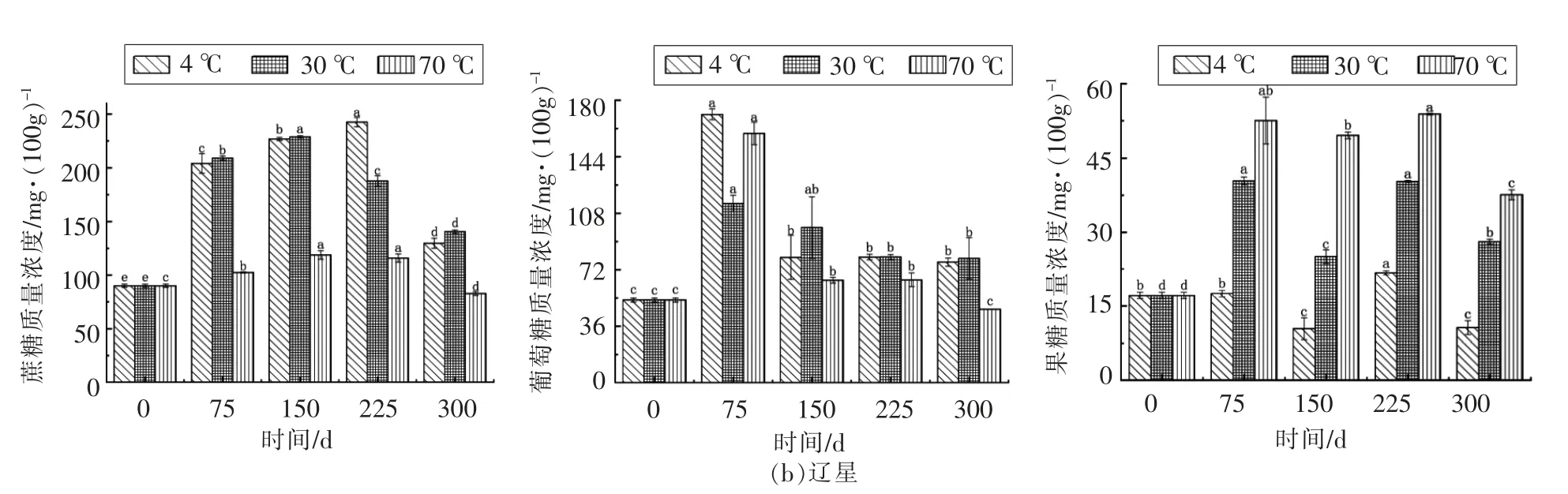
图3 储藏期间蔗糖、葡萄糖和果糖含量变化Fig.3 Changes in the contents of sucrose,glucose and fructose during storage
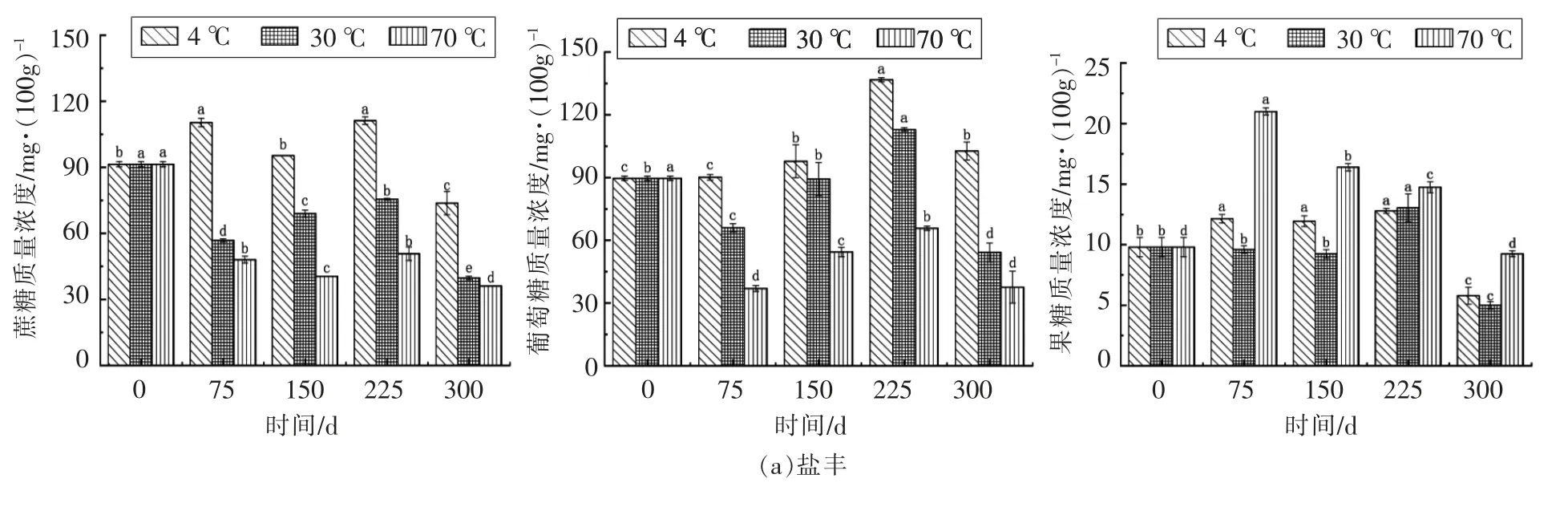
相同储藏时间,高温下蔗糖和葡萄糖含量比低温时低,可能是因高温促进呼吸作用和糖的水解、氧化反应等。而果糖恰恰相反,可能是因为高温水解为果糖的量大于其被分解的量。
表3列出两种大米在储藏期间可溶性糖的TAV 变化值。储藏期间,除部分盐丰大米样品的蔗糖和葡萄糖TAV 值大于1 外,其它均小于1;除70 ℃储藏300 d 的辽星大米样品的蔗糖TAV 值小于1,其它时间样品的蔗糖TAV 值均大于1。这说明储藏期间蔗糖仅对辽星大米有甜味贡献,而两种大米的葡萄糖和果糖几乎没有甜味贡献。
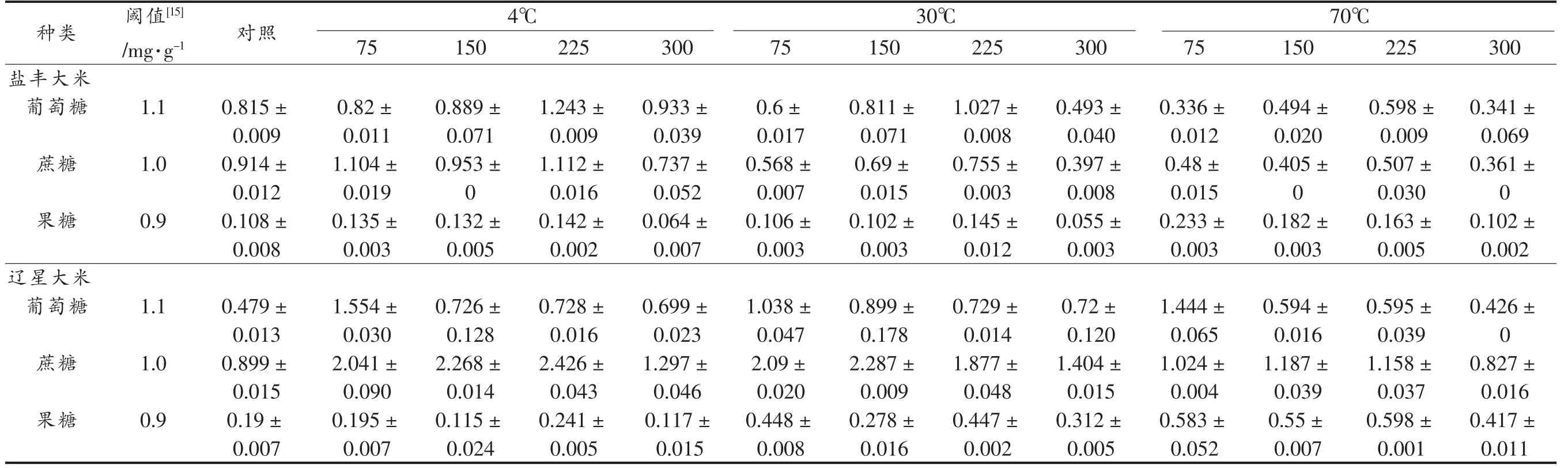
表3 储藏期间大米可溶性糖TAV 的变化Table 3 Changes in soluble sugar TAV of rice during storage
2.3 电子舌分析结果
电子舌是一种20世纪80年代中期发展起来的利用多传感器阵列检测液体样品,对样品进行定性或定量分析的仪器。然而,电子舌得到的不是被测样品中某种或某几种成分的定性与定量结果,而是样品的整体信息[26]。
图4显示电子舌判别因子分析结果。在4,30℃和70 ℃时盐丰和辽星两判别因子的总贡献率分别为93.757%,93.673%,96.119%和94.676%,96.419%,99.508%,这表明两判别成分包含大米样品的大部分信息,可用来表明大米的整体信息。从图4可看出,随着储藏时间的延长,各储藏温度下的大米样品有逐渐远离新鲜大米的趋势,并且代表各样品的数据点大致集中在5 个相对独立的区域,每个区域聚合程度都比较高,相互间没有重叠部分。这个结果既说明该方法可实现储藏期间大米的区分,又说明不同储藏条件的大米具有不同的味感信息。
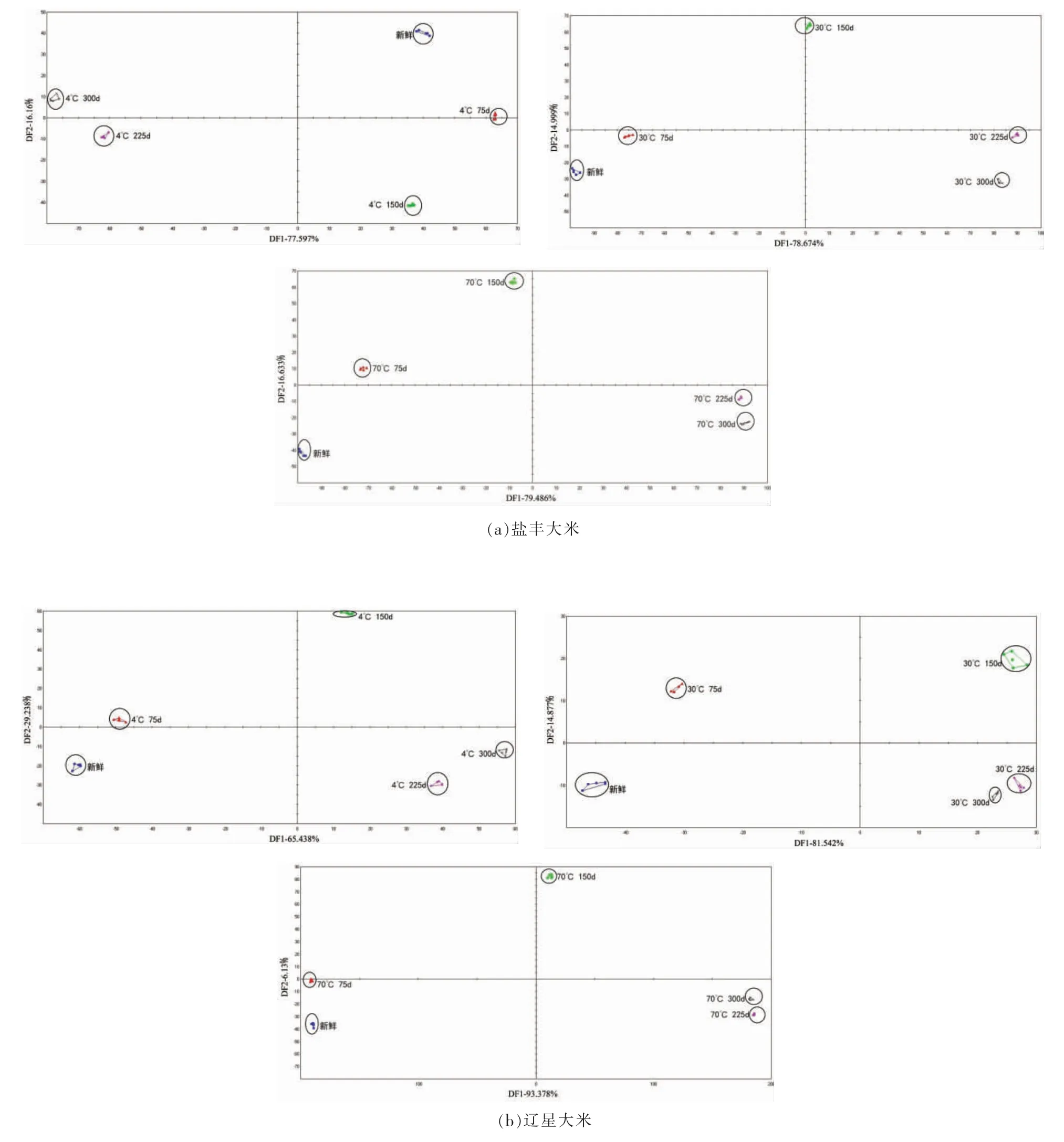
图4 储藏期间电子舌判别因子分析Fig.4 Analysis of electronic tongue discrimination factor during storage
2.4 基于偏最小二乘法回归分析的味感物质含量预测模型
偏最小二乘法是建立在主成分回归和主成分分析基础上的多元数据分析方法。它聚集了主成分分析、典型相关分析和多元线性回归分析的优点,且方法简单、便利[12]。由上文可知,在储藏期间对大米味感品质起主要作用的是鲜味、甜味氨基酸、葡萄糖和蔗糖。以电子舌7 根传感器信号值(SRS、SWS、BRS、STS、UMS、GPS、SPS,分别代表酸、甜、苦、咸、鲜5 种味觉和2 种复合味觉)为自变量,储藏期间两种大米鲜味、甜味氨基酸,葡萄糖和蔗糖含量为因变量,建立预测模型。由图5可知,鲜味、甜味氨基酸、葡萄糖和蔗糖预测模型的拟合系数分别为0.8110,0.8373,0.7994 和0.8990,均接近或超过80%,说明预测效果较好。

图5 基于偏最小二乘法回归的味感物质预测模型拟合图Fig.5 Fitting diagram of taste substance prediction model based on PLSR
2.5 GC-MS 分析结果
在大米储藏期间,因呼吸作用和各种酶的作用,大米中的挥发性物质随着时间的增加而发生变化。这些挥发性物质主要分为醛类、醇类、酯类、酮类、酸类、酚类、烃类及杂环等。大米中挥发性物质的产生一方面因为脂质氧化,另一方面因为氨基酸和还原糖发生美拉德反应,且不同储藏条件大米中挥发性物质的种类以及含量不同[27]。通过GC-MS,盐丰大米中检出7 大类103 种物质(不计烷烃),其中醛类20 种、醇类15 种、酯类15 种、酮类16 种、酸类6 种、酚类6 种、杂环及其它类25种。从辽星大米中检出7 大类113 种物质(不计烷烃),其中醛类21 种、醇类14 种、酯类19 种、酮类19 种、酸类7 种、酚类4 种、杂环及其它类29 种。图6显示两种大米在储藏期间部分挥发性物质的热图分析。
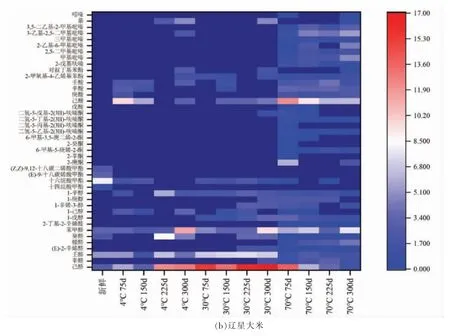
图6 两种大米在储藏期间部分挥发性物质的热图分析Fig.6 Heat map analysis of some volatile substances of two kinds of rice during storage
适量的醛类物质赋予大米令人愉悦的青草味和水果味,而含量过高产生腐败味[28]。本试验储藏期间,己醛、辛醛、壬醛、(E)-2-辛烯醛、糠醛、癸醛、苯甲醛、2-丁基-2-辛烯醛等的含量高于新鲜样品。其中,己醛被证明是储藏期间增加最多的羰基化合物[29]。先前的研究[30]发现陈米中己醛、戊醛含量明显高于新鲜大米,它们导致大米香气下降,出现陈化臭味。辛醛是亚油酸和油酸的脂质氧化产物,用作早期氧化标记物[31]。徐晋[32]指出壬醛含量随储藏时间的延长呈上升趋势,其是大米清新味被臭味所取代的标志之一。癸醛是油酸氧化产物。苯甲醛由苯丙氨酸降解产生并具有苦杏仁味。醇类物质如1-戊醇、1-己醇、1-辛烯-3-醇、1-庚醇、1-辛醇等的含量高于新鲜样品。1-戊醇、1-己醇、1-辛烯-3-醇和1-辛醇是亚油酸氧化产物,其中1-辛烯-3-醇具有典型的蘑菇味。通常认为酯类对大米香气有贡献,然而储藏期间十四烷酸甲酯、十六烷酸甲酯、(E)-9-十八碳烯酸甲酯和(Z,Z)-9,12-十八碳二烯酸甲酯等含量下降。酮类化合物可由美拉德反应、氨基酸降解、热降解以及脂肪氧化生成[33]。储藏期间新产生了大量酮类物质,比如2-庚酮、2-辛酮、6-甲基-5-庚烯-2-酮、2-癸酮、6-甲基-3,5-庚二烯-2-酮、呋喃酮类等,其中2-庚酮来源于亚油酸氧化。通常酸类化合物具有不良气味,比如腐臭味、汗味、药味以及塑料味等。储藏期间新产生的己酸、庚酸、辛酸等酸类主要由脂质氧化产生[34],2-甲氧基苯酚、2-甲氧基-4-乙烯基苯酚、对叔丁基苯酚等酚类物质含量增加。有研究指出酚类物质的存在会对大米产生不利影响[35]。2-戊基呋喃是亚油酸氧化分解的主要呋喃类物质,可作为亚油酸氧化初期氧化程度的指标[34]。2-戊基呋喃和2,3-二氢苯并呋喃在储藏期间含量增加,有文献报道其浓度增大会产生豆腥异味[36-37]。储藏期间新产生吡嗪类物质,如甲基吡嗪、2,5-二甲基吡嗪、2-乙基-6-甲基吡嗪、三甲基吡嗪、3-乙基-2,5-二甲基吡嗪、3,5-二乙基-2-甲基吡嗪等。吡嗪具有焙烤和坚果味,其来源于氨基酸和碳水化合物之间的美拉德反应[38]。此外,吲哚的存在提供不良气味,而萘也有刺激性气味[39-40]。

2.6 电子鼻分析结果
电子鼻利用电仿生技术,模拟人体嗅觉对样品气味进行检测,克服了传统感官评价结果易受主观因素影响等缺点。同电子舌相似,电子鼻得到的也是样品的整体信息。
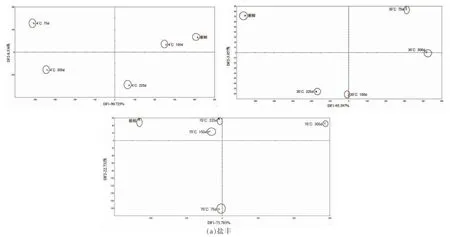
图7显示判别因子分析的结果。4,30 ℃和70℃时盐丰大米和辽星大米两判别因子的总贡献率分别为99.261%,99.354%,96.571%和98.541%,99.593%,99.591%,这表明两判别成分包含大米样品的大部分信息,可以表明大米的整体信息。从判别因子分析可以看出,代表各样品的数据点分别在不同的区域,说明此方法可以实现储藏期间大米的区分,表明不同储藏条件下的大米具有不同的气味信息。

图7 储藏期间电子鼻判别因子分析Fig.7 Analysis of electronic nose discrimination factor during storage
3 结论
以盐丰、辽星大米为研究对象,对其储藏期间的风味特征进行分析、鉴定。储藏期间,谷氨酸含量增加,甘氨酸、丙氨酸、赖氨酸、精氨酸和亮氨酸含量降低;蔗糖含量在辽星大米中是先上升再下降,在盐丰大米中储藏后期表现为先上升后下降;葡萄糖含量大致变化趋势也是先上升后下降;果糖含量上升后一直处于波动状态,并呈下降趋势。相同储藏时间,高温增加氨基酸和果糖,减少蔗糖和葡萄糖。味道成分的TAV 变化表明,储藏期间天冬氨酸、谷氨酸、丝氨酸、甘氨酸、丙氨酸、缬氨酸、赖氨酸、异亮氨酸、亮氨酸、组氨酸、精氨酸和蛋氨酸的TAV 值均大于1,谷氨酸的TAV 值始终最大。蔗糖仅对辽星大米有甜味贡献;葡萄糖和果糖在储藏期间几乎没有甜味贡献。通过偏最小二乘回归分析建立储藏大米味感物质预测模型,鲜味、甜味氨基酸、葡萄糖和蔗糖的相关系数均接近或超过80%,预测效果较好。挥发性物质储藏期间也发生明显的变化,新生成吡嗪类、呋喃酮类、呋喃类、醛类、醇类、酸类等。此外,运用电子舌和电子鼻判别因子分析成功区分储藏期间的大米样品,表明储藏导致大米的总体味感和气味产生差异。
