水中微量金属离子对大豆蛋白凝胶特性的影响
2021-07-21王睿智高若珊朱秀清范洪臣刘琳琳石彦国
王睿智,高若珊,朱秀清,范洪臣,刘琳琳,石彦国
大豆蛋白营养丰富,价格低廉,易于制取,在食品工业中有着广泛的应用,常作为食品的原料及辅料。大豆蛋白由10%的清蛋白和90%的球蛋白组成,其中球蛋白是主要的贮藏蛋白。根据沉降系数的不同,可将大豆蛋白分为4 个组分:2S(15%)、7S(34%)、11S(41.9%)、15S(9.1%)[1]。
大豆蛋白具有在加热条件下形成凝胶的能力。这种能力以及大豆蛋白凝胶自身的物理性质,对传统食品品质(如豆腐、豆干等)、食品体系的结构特性及调控意义重大[1-3]。大豆蛋白凝胶可以分为两类:热诱导凝胶和冷凝胶。前者是蛋白的质量分数较高时(通常≥10%)加热蛋白溶液至变性温度以上并保持一段时间后冷却至室温或更低温度,蛋白分子间通过疏水相互作用、二硫键等相互交联,形成三维空间网络结构;后者则是在低于凝胶临界蛋白质量分数(≤8%,通常为2%~6%)下加热蛋白溶液至变性温度以上,然后添加盐类、酸或酶等诱导剂,促使蛋白交联,形成凝胶网络结构[4-6]。Maltais 等[7]研究表明,与热诱导凝胶不同,大豆蛋白冷凝胶的形成有以下两个步骤:首先是在高于变性温度的条件下加热蛋白溶液,使蛋白的结构伸展,活性基团暴露;然后冷却并添加Ca2+,诱导热聚集体交联、聚合,形成凝胶。Ca2+的作用是中和蛋白聚集体的静电排斥力并在蛋白分子间形成钙桥,进而形成凝胶骨架,这种结构主要由范德华力及疏水相互作用维持[7-8]。冷凝胶因其所需蛋白浓度较低、加热时长较短,在食品工业中的应用较热凝胶广泛。在我国北方地区的卤水豆腐就是含水量较高,由氯化镁诱导的大豆蛋白冷凝胶。
温度、pH 值、离子种类及强度等都会对大豆蛋白的凝胶特性造成影响[9-12],其中离子的影响比较显著。翁頔等[13]和杨芳等[14]发现,Na+、Ca2+、Mg2+对大豆蛋白凝胶的形成、质构、微观结构及水分状态均有影响;Lakemond 等[3]指出,离子强度升高会显著降低大豆球蛋白凝胶的持水性,凝胶的储存模量随着离子强度的上升呈现先上升后下降的变化,同时凝胶的粗糙程度与离子强度成正比;Lu等[1]研究表明,Ca2+浓度由0.02 mol/L 升至0.03 mol/L 时大豆蛋白凝胶的凝胶强度增加,而由0.03 mol/L 升至0.04 mol/L 时凝胶强度开始下降;Nagano 等[2]的试验表明,Na+有助于凝胶网络的形成,同时Mg2+对11S 凝胶的网络平均密度影响很大,凝胶密度随Mg2+浓度的升高而显著增加,而大豆分离蛋白凝胶的网络平均密度对Mg2+浓度不敏感。
从前述研究可以看出,目前在金属离子与大豆蛋白凝胶方面有较多的研究,研究方向多集中于Na+、Ca2+、Mg2+等常量元素,对诸如Zn2+、Cu2+等水中常见微量元素较少涉及。诱导剂也以氯化钙、石膏等钙盐居多,鲜见采用氯化镁。本研究以大豆分离蛋白(soybean protein isolate,SPI)为原料,通过流变学分析、质构分析等手段,探明锌、铜等常见的微量元素对氯化镁诱导的SPI 凝胶特性的影响,以期为传统食品加工、食品体系的调控提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白,北京索莱宝科技有限公司;氯化镁、氯化锌、氯化铜,天津市天力化学试剂有限公司;氯化锰、氯化铁,天津市东丽区天大化学试剂厂;叠氮钠,美国Sigma-Aldrich 试剂公司;所有试剂均为分析纯。
1.2 仪器与设备
MCR-102 流变仪,奥地利安东帕公司;ZEN3700 纳米粒度和Zeta 电位仪,英国马尔文公司;TA.new plus 质构分析仪,美国ISENSO 公司;TG16-WS 台式高速离心机,上海卢湘仪离心机仪器有限公司;JC-2500 旋涡振荡器,江苏省金坛区白塔金昌实验仪器厂;DF-101S 集热式恒温加热磁力搅拌器,郑州市亚荣仪器有限公司;电子天平,赛多利斯科学仪器(北京)有限公司;电热恒温水浴锅,北京市永光明医疗仪器有限公司。
1.3 方法
1.3.1 样品制备 分别配制不同浓度的含有Zn2+、Cu2+、Mn2+、Fe3+的溶液,将大豆蛋白粉溶解于含有不同浓度金属离子的溶液中,使蛋白质量分数达到5%。大豆蛋白溶液在25 ℃条件下磁力搅拌2 h,使之充分水化并加入叠氮钠(0.001%)以防止微生物污染。将大豆蛋白溶液在10 000 r/min 条件下离心10 min 以除去不溶物,取部分上清液进行巯基及二硫键含量测定;将余下上清液转移至水浴锅内,95 ℃加热5 min 后迅速冷却至25 ℃,制得大豆蛋白热聚集体,用于测定聚集体粒径;将充分水化后的大豆蛋白溶液转移至水浴锅内,95 ℃加热5 min,一部分迅速冷却至25 ℃用于流变学测量,另一部分维持在85 ℃,以进行凝胶质构特性、持水性测定。
1.3.2 流变学测量 采用改良的Liu 等[15]及Wang等[16]所述的方法测量大豆蛋白溶液的流变学行为。在大豆蛋白溶液中加入氯化镁,使体系中Mg2+浓度达到0.01 mol/L,充分振摇后迅速吸取2.0~2.5 mL 滴加于MCR 102 流变仪的平板间。采用小振幅振荡频率扫描模式对大豆蛋白凝胶在不同离子种类及浓度下的动态黏弹特性进行表征。设定扫描频率0.1~20 Hz,固定应变0.1%,所有测量均在确定的线性黏弹性区域内进行。试验温度25 ℃,平板尺寸50 mm,板间距1 mm。在试验过程中,采集了具有频率依赖性的储能模量(G′)数据。每个试验至少做3 次平行。本试验中,将频率扫描过程开始后得到第一个数据点的G′值定义为起始G′值,将扫描过程结束后所得到的G′值定义为终止G′值。
1.3.3 粒径测量 采用动态光散射(DLS)法测定上清液中热聚集体的粒径。将处理后的上清液稀释500 倍并过滤,取1.0~1.5 mL 滤液于塑料比色皿中进行测定。测试温度25 ℃,设定大豆蛋白的折射率为1.450,分散剂的折射率为1.000。
1.3.4 巯基及二硫键含量的测定 游离巯基含量测定采用Wang 等[16]的方法。取1 mL 上清液加入4 mL pH 值8.0 的Tris-Gly 缓冲溶液及50 μL DTNB 试剂,25 ℃保温60 min 后在412 nm 波长下测定吸光值A412。
总巯基测定参考江连洲等[17]的方法。取1 mL上清液加入4 mL pH 值8.0 的Tris-Gly-尿素溶液、50 μL DTNB 试剂及50 μL 2-巯基乙醇,25℃反应60 min;加入20 mL 12%三氯乙酸,25 ℃反应60 min 后以5 000 r/min 离心10 min,取沉淀,用12%三氯乙酸洗涤2~3 次后加入10 mL pH 值8.0 的Tris-Gly 缓冲溶液摇匀,吸取4 mL 样液并加入40 μL DTNB 试剂,25 ℃反应60 min 后在412 nm 波长下测定吸光值A412。按如下公式计算游离巯基及总巯基的含量:
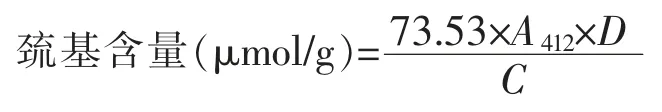
式中:A412——412 nm 波长处的吸光值;D——稀释倍数;C——样品浓度,μmol/g。
按此公式计算二硫键的含量:

1.3.5 凝胶质构的测定 采用改良的Zhao 等[18]的方法对大豆蛋白凝胶进行质构测定。为方便测定,所有样品在20 mL 塑料皿中制备。按照1.3.4节中的方法制备大豆蛋白凝胶,试验前需将凝胶在室温下平衡至少30 min。质构仪使用TPA 模式,选择P/36R 探头,设定压缩程度50%,测试前速度、测试中速度、测试后速度均为1 mm/s,停留时间5 s,触发力5 g。采集了硬度与弹性的数据,并以硬度作为评价凝胶强度的指标。每个试验至少做3 次平行。
1.3.6 凝胶持水性(WHC)的测定 采用改良的Wang 等[19]和Chen 等[20]所述的方法,对大豆蛋白凝胶的持水性进行测定。本试验中,其被定义为离心后原凝胶质量的损失率。在大豆蛋白溶液中加入氯化镁,使体系中Mg2+浓度达到0.01 mol/L,充分振摇后在85 ℃条件下保温10 min,然后在4 ℃冰箱内静置过夜,以使其充分形成凝胶。试验前需将凝胶在室温下平衡至少30 min。称取3 g 凝胶,于8 000 r/min 条件下离心20 min,弃去上清液,倒置离心管5 min 并用滤纸小心地吸干管壁内残留的水分后称重。按如下公式计算凝胶的持水性:
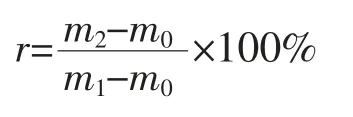
式中:r——失水速率;m0——空离心管的质量,g;m1——离心前凝胶与离心管的总质量,g;m2——离心后凝胶与离心管的总质量,g。每个试验至少做3 次平行。
1.3.7 数据处理 采用SPSS 16.0 和Excel 2007软件进行统计分析及数据处理,各组间均值比较采用S-N-K 分析法(P<0.05),所有测定结果以平均值±标准差的形式表示。图像采用Origin 2018软件处理。
2 结果与分析
2.1 金属离子对大豆分离蛋白凝胶流变学特性的影响
储能模量(G′)表示动态振荡各周期的能量储备,代表着凝胶结构的固体弹性和强度,两者都对蛋白质的三维凝胶网络有重要贡献[18,21]。图1显示了各处理组的大豆蛋白凝胶在不同离子种类及浓度下G′的频率依赖性。可以观察到,所有样品的G′值都随着角频率的增加而增加,显示出良好的频率依赖性。
如图1a~1d 所示,添加金属元素后各处理组的G′值显著提升(P<0.05),这表明凝胶的结构与强度随着金属元素的加入而增强。其中锌、铜、锰处理组的储能模量变化趋势较为相似,而铁处理组的起始G′值明显高于其它处理组,可能的原因是铁离子所携带的正电荷数较高,相比于锌、铜等二价离子其促进蛋白分子间交联的能力更强,从而使得凝胶的固体弹性增加。另外,各处理组G′值的变化与离子浓度呈正相关,这说明随着离子浓度的升高,金属元素与大豆蛋白的作用增强,促进了蛋白间的相互作用,使得凝胶骨架的结构得到加强,固体弹性明显上升。这与Lu 等[1]以及Maltais 等[8]的部分研究结果相同,这是由于本试验采用的离子浓度较低,未能达到“转折浓度”[13],故未出现先上升后下降的变化。此外,当锌、铜、锰3种元素的质量浓度均为0.05 mg/L 时,铜处理组的终止G′值最大(257.27 Pa),锌处理组次之(250.03 Pa),锰处理组最小(249.68 Pa),此结果与3 种元素的电负性变化规律相吻合(Cu 1.9>Zn 1.65>Mn 1.55),元素的电负性越大,该元素中和蛋白表面电荷的作用越强,可以促使蛋白进行更大程度的交联,从而导致G′的增大。
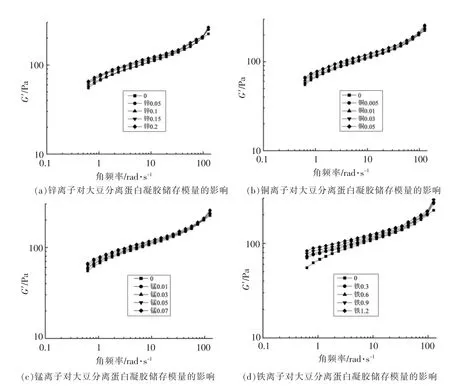
图1 微量金属离子对大豆分离蛋白凝胶储存模量的影响Fig.1 Effect of trace metal ions on storage modulus of soybean protein isolate gel
整体而言,金属元素对大豆蛋白凝胶的固体弹性行为产生了显著影响。随着金属元素的加入,大豆蛋白凝胶的G′值显著提升,且G′值与离子浓度成正比,其中铁离子的作用效果明显强于锌、铜、锰。
2.2 金属离子对大豆蛋白聚集体粒径的影响
通过粒度分析,可以评价蛋白质的交联和聚集的程度。添加不同金属离子的大豆分离蛋白聚集体的平均粒径如表1所示,可见金属元素加入后聚集体的平均粒径显著增大(P<0.05),且平均粒径的变化与离子浓度呈正相关,其中铁离子处理组尤为明显。这种差异可能归因于与聚集程度相关的正电荷数。三价离子和二价离子都能屏蔽蛋白质分子间的静电相互作用,但是三价离子所携带的正电荷比二价离子多,因此三价离子具有更强的屏蔽能力,可以交联或桥接更多相邻的带电基团,从而形成更大的聚集体,且浓度越高效果越明显。可以推测,较高浓度的金属离子可以更有效地促进较大聚集体的交联和聚集,且三价离子的效果强于二价离子。
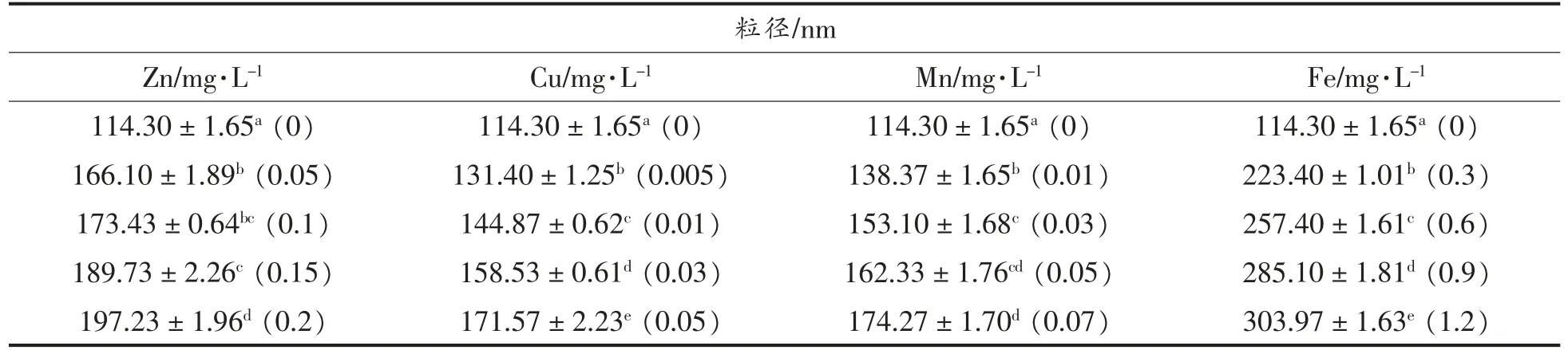
表1 金属元素对大豆分离蛋白粒径的影响Table 1 Effects of metal elements on particle size of soybean protein isolate
2.3 金属离子对大豆蛋白巯基和二硫键的影响
巯基对大豆蛋白的胶凝性能有重要的影响。总巯基基团包含氧化态的巯基(-SH-)和还原态的二硫键(-S-S-),其中巯基组分既包括蛋白表面暴露的部分(即游离巯基),也包括在蛋白内部埋藏的部分。金属元素对大豆分离蛋白巯基和二硫键的影响见图2。
如图所示,随着金属离子的加入,各处理组的总巯基和游离巯基含量呈浓度依赖性下降,二硫键含量则随着离子浓度的升高而上升。这可能是由于离子加入后引起蛋白分子聚集,蛋白分子间相互作用增强并形成盐桥,进而生成新的二硫键。另外,图2d 中铁离子加入后总巯基、游离巯基以及二硫键含量的变化幅度明显高于其它处理组,一方面的原因是铁离子携带的正电荷数较多,相比于二价离子其引起的聚集程度更大,另一方面可能归因于铁离子具有较高的氧化电势,这有助于通过巯基的氧化形成新的二硫键。

图2 微量金属离子对大豆分离蛋白巯基和二硫键的影响Fig.2 Effects of trace metal ions on sulfydryl group and disulfide bond of soybean protein isolate
2.4 金属离子对大豆蛋白凝胶质构的影响
金属离子对大豆分离蛋白凝胶强度的影响如表2所示。引入金属离子后各处理组的凝胶强度均显著上升(P<0.05),且凝胶强度与离子浓度呈正相关,这说明金属离子促进了蛋白分子间的相互作用,它们的加入明显增强了凝胶的结构,且浓度越高作用越明显;铁离子加入后凝胶强度的上升幅度大于其它处理组,这可能与前述原因相同。此外,由表2及图1可以看出凝胶强度的变化与G′呈正比,这与Donato 等[22]的结论相同,表明凝胶的固体弹性越高,凝胶强度越大。
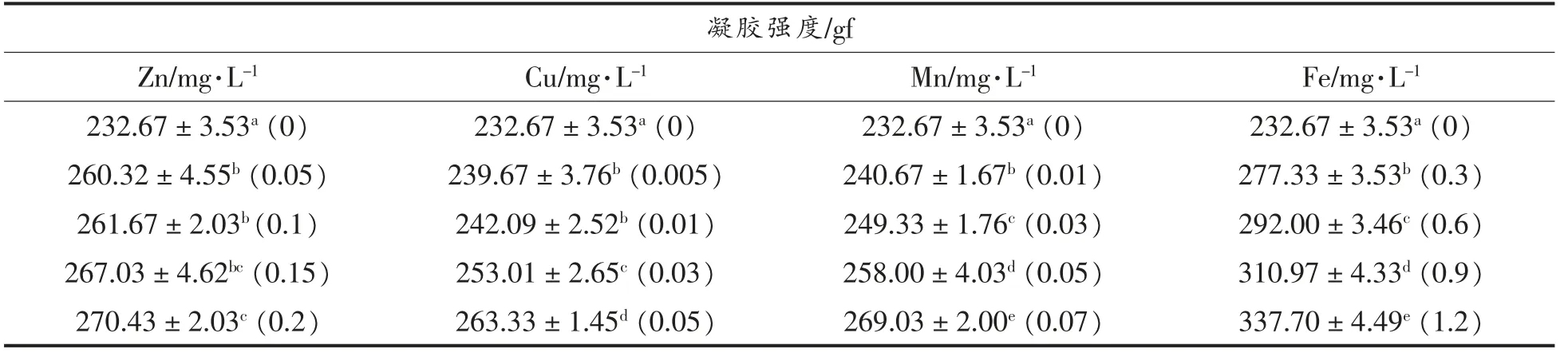
表2 金属元素对大豆分离蛋白凝胶强度的影响Table 2 Effects of trace metal elements on gel strength of soybean protein isolate
金属离子对大豆分离蛋白凝胶弹性的影响如表3所示。锌、铜、铁处理组的弹性提升较为显著,其中锌、铁处理组的弹性随着离子浓度的升高呈现出先上升后下降的趋势并分别在0.1,0.6 mg/L时达到弹性最大值,铜处理组的弹性则与离子浓度呈正相关;锰处理组的弹性随着离子浓度的升高虽呈现出小幅上升的趋势但是变化不显著。这说明锌、铜、铁对凝胶弹性具有积极的影响,而锰对凝胶弹性几乎没有贡献。另外,锌、铁处理组的弹性低于铜处理组,可能的原因是锌离子和铁离子可以改变蛋白质的构象,使分子链交联和聚合,从而使部分分子链失去弹性,导致凝胶抵抗机械压缩的能力较差[23-24]。
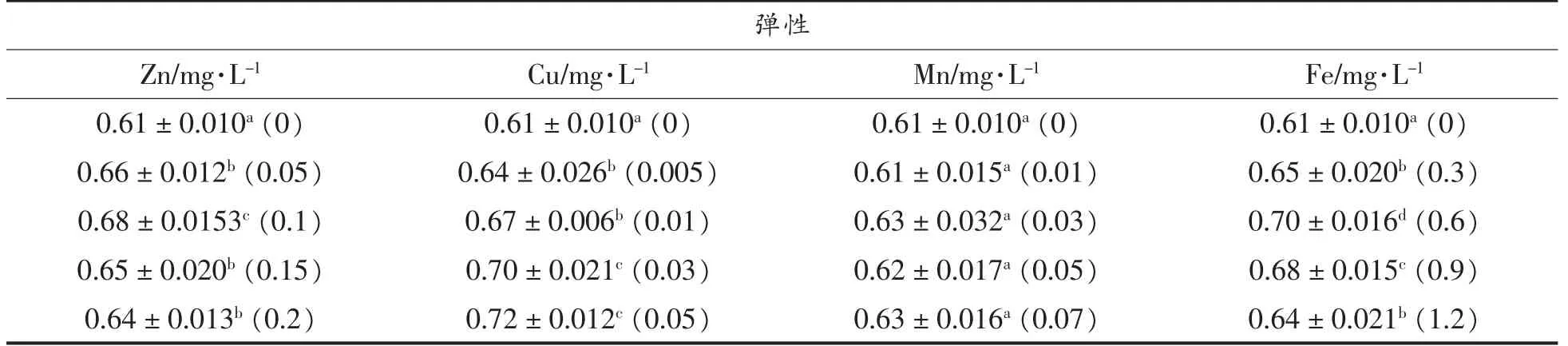
表3 金属元素对大豆分离蛋白凝胶弹性的影响Table 3 Effects of trace metal elements on gel springiness of soybean protein isolate
2.5 金属离子对大豆蛋白凝胶持水性的影响
凝胶的持水性是指通过凝胶基质的毛细管作用来有效地固定水分的能力,是食品系统中最重要的特性之一[24]。如图3a~3d 所示,所有处理组的失水速率均出现明显升高,失水速率与离子浓度成正比并与粒径的变化趋势相同,表明持水性的变化与离子浓度和粒径均呈负相关。其原因是较高的离子浓度会形成较大的聚集体,而由较大的聚集体构成的凝胶孔隙较大,凝胶骨架与水的结合能力变弱,故较大粒径聚集体形成的蛋白凝胶持水性较低,此结果与Wang 等[25]和Urbonaite等[26]的结论相同。结合图1与图2可以发现,凝胶的失水速率与G′成正比,表明凝胶的持水性与G′呈负相关,这与Urbonaite 等[27]的观察结果相符,说明凝胶的固体弹性越大,蛋白之间的相互作用越强,蛋白与水的作用越弱,持水性越低。但该结论与Wang 等[21]及Yang 等[28]的研究相反,这可能是由于交联剂不同导致的结果。此外,在图3d 中,当铁离子加入后凝胶的失水速率显著提高,这可能是由于铁离子自身所带电荷数较多,相比于二价离子,它的电荷屏蔽作用更强,降低了蛋白质与水的相互作用,使得凝胶基质中的水分更容易排出,进而表现为较高的失水速率,这与已有的研究报道结果相同[25,29]。
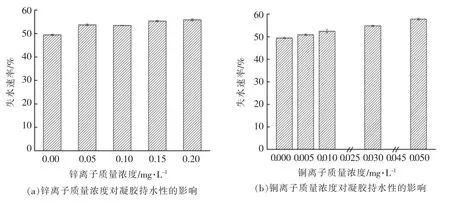
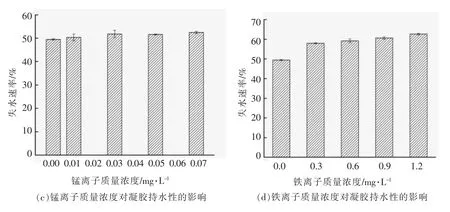
图3 微量金属离子对凝胶持水性的影响Fig.3 Effects of trace metal ions on water holding capacity of gel
3 结论
本试验通过向大豆蛋白中添加ZnCl2、CuCl2、MnCl2和FeCl3,探究了金属元素对氯化镁诱导的大豆蛋白凝胶特性的影响。可以发现较之于对照组,添加金属元素后凝胶的储存模量、二硫键含量和凝胶强度显著增加,热聚集体尺寸明显增大,凝胶的持水性和巯基含量则明显下降,其中铁离子的作用较为明显;凝胶的储存模量、二硫键含量、凝胶强度和热聚集体尺寸与离子浓度成正比,持水性和巯基含量则与离子浓度成反比;锌、铜、铁对凝胶弹性具有积极影响,锰几乎对凝胶弹性没有贡献。此外,本试验还发现各处理组的凝胶强度与储存模量呈正相关,凝胶的持水性与储存模量及热聚集体尺寸呈负相关。
