超声引导下经皮肝穿刺抽脓法和置管引流法治疗艾滋病并发肝脓肿患者临床效果分析
2021-07-14王雪梅杨学平
王雪梅,张 瑶,杨学平,王 玥,张 记
肝脓肿是细菌、真菌或溶组织阿米巴原虫等多种微生物引起的肝脏化脓性病变。近年来,报道肝脓肿患者的病死率为5.6%~15.0%[1,2]。获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)患者存在免疫功能不同程度的受损,是肝脓肿的好发人群。因起病隐匿,且常常并发肝外其他感染,可能早期遗漏诊断。因此,早发现、早诊断并给予有效的治疗,对于AIDS并发肝脓肿患者非常重要。以往治疗肝脓肿常用的方法有外科手术治疗和药物治疗。随着介入超声技术的不断发展,超声引导下经皮肝穿刺抽脓法(percutaneous aspiration,PA)和置管引流法(percutaneous catheter drainage,PCD)已逐渐取代传统的外科手术引流,在肝脓肿治疗方面发挥着极其重要的作用[3,4]。本研究分析总结了我院诊治的AIDS并发肝脓肿患者的临床特点和治疗情况,可为临床医师及时诊断和有效治疗提供参考。
1 资料与方法
1.1 研究对象 2013年6月~2019年12月我院诊治的肝脓肿患者74例,其中AIDS患者39例。根据临床症状、实验室检测和影像学检查诊断肝脓肿。艾滋病的诊断符合中华医学会感染病学分会颁布的《艾滋病诊疗指南第三版(2015年版)》的标准[5]。排除标准:肝门区、肝裸区的脓肿、伴有大量腹腔积液或有凝血功能障碍性疾病、存在恶性肿瘤。
1.2 治疗方法 入院后,综合国际指南推荐的意见和中国较高的耐药发生率的实际,根据病情的危重程度,选择应用能覆盖革兰阳性和革兰阴性细菌的广谱抗生素,并适当加用抗厌氧菌药物[6]。在抗感染治疗的同时,使用GE Log E9彩色多普勒超声仪和腹部探头C1-5MHz,监测脓肿的液化程度,选择合适时机进行超声引导下介入治疗。术前,与患者及其家属沟通,签署知情同意书,并告知引流管保护和护理方法。根据脓肿的位置、与周围血管和胆管的关系,选择合适的穿刺路径。根据脓腔大小及液化程度,选择PA或PCD法治疗。对于多发脓腔,采取多个点穿刺方案,采取PA和PCD两种方法联合应用[7]。PA法用于液化范围较小的脓腔(3.0~5.0cm),选用16 G PTC穿刺针,长度为15/18 cm。在超声引导下,将PTC针穿刺入脓肿液化区,抽尽脓液,用生理盐水反复冲洗脓腔,单次盐水量小于抽出的脓液量,直至冲洗液清亮为止。术后3~7 d,使用超声复查脓腔情况,必要时再次抽吸或置管引流;对于直径≥5 cm的脓腔,采用PCD治疗,使用8 F猪尾管引流。术中,将最先抽出的脓液进行细菌培养和药敏试验,将脓液和冲洗液收集于引流袋中。术后,给予生理盐水冲洗脓腔,1次/d,直至冲洗液清亮[8]。使用超声监测脓腔情况,及时调整引流管位置,必要时重复置管或同时置入多根引流管。拔管指征:超声复查脓腔已消失,24 h引流量<10 ml,行夹管2~3 d后,临床症状无反复,拔管。

2 结果
2.1 临床资料 39例AIDS患者均为男性,平均年龄为38.3±9.4岁。肝脓肿单发28例,多发11例(28.2%)。右叶28例(71.8%),左叶4例(10.3%),左右叶7例(17.9%);在35例非AIDS患者中,男性25例,女性10例,平均年龄为48.6±12.7岁。脓肿单发25例(71.4%),多发10例(28.6%)。右叶29例(82.9%),左叶3例(8.6%),左右叶3例(8.6%)。两组患者主要临床表现为发热、腹痛或腹部不适,少数患者症状不典型,仅表现为乏力、恶心、食欲不振等。AIDS组并发肝外感染率显著高于非AIDS组,AIDS组肺部感染率为51.3%,腹腔感染率为17.9%,胆道感染率为5.1%;非AIDS组胆道感染率为25.7%,肺部感染率为20.0%。采用PCD法治疗68例,PA法治疗5例(AIDS组4例,非AIDS组1例),1例采取PA联合PCD法治疗。术后,两组并发症主要为置管脱管、引流不畅、穿刺处疼痛等,均未发生出血、感染加重、剧烈疼痛和胆漏等严重并发症。
2.2 两组临床资料和实验室指标比较 见表1、表2。

表1 两组临床资料比较

表2 两组炎性指标【M(P25,P75)】比较
2.3 抗生素应用及病原菌培养情况 本组以应用碳青霉烯类和头孢类为主,AIDS组应用碳青霉烯类较多,占64%,非AIDS组为40%,两组均有约半数患者加用硝基咪唑类,另有9例患者联合应用了万古霉素,其中AID组7例,非AIDS组2例。在AIDS组,3例脓液培养出致病菌,其中1例为金黄色葡萄球菌,1例为表皮葡萄球菌和阴沟肠杆菌,1例为嗜水汽单胞菌;在非AIDS组,11例培养出致病菌,其中8例为肺炎克雷伯菌,1例为金葡菌,1例为大肠埃希菌,1例为阴沟肠杆菌。
2.4 典型病例治疗前后超声和CT扫描变化 见图1~4。
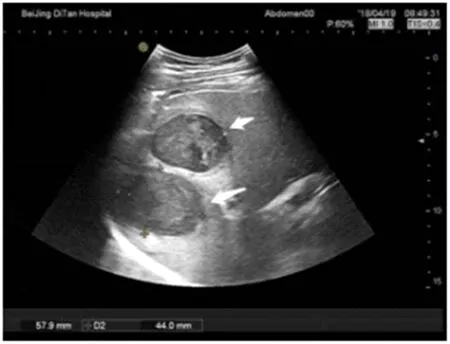
图1 肝脓肿患者腹部超声表现 治疗前,超声检查提示肝右叶可见两个相邻的脓腔

图2 肝脓肿患者腹部超声表现 治疗后1周,超声检查提示脓腔消失,肝右叶可见两个边界不清的稍低回声区

图3 肝脓肿患者腹部CT表现 治疗前,CT检查提示肝右叶可见两个相邻的低密度灶

图4 肝脓肿患者腹部CT表现 治疗后3周,CT检查提示肝右叶低密度灶明显缩小
3 讨论
由于艾滋病患者免疫功能受损,极易引发严重的感染性脓肿,比如腹腔脓肿和肝脓肿等[9]。本研究两组患者在性别和年龄方面存在很大的差异,与艾滋病患者的好发人群有关。发热常常是肝脓肿患者的主要临床表现,其次为腹痛或腹部不适,少数患者症状不典型,仅表现为乏力、恶心、食欲不振等症状[10]。本研究结果显示,约半数患者无腹痛或肝区不适症状,因此在肝脓肿早期不容易被发现,AIDS患者中出现腹痛或肝区不适症状者较非AIDS组比例增高,相对容易被早期发现。因此,对于发热病人应常规进行腹部超声检查,明确腹部脏器有无感染。
肝脓肿是由于细菌经肝动脉、门静脉和胆道等各种途径进入肝脏,或与肝毗邻的感染病灶细菌直接入侵造成肝实质发生炎症坏死,从而形成脓肿[11],其中,胆源性疾病是主要致病因素,呼吸道感染与细菌性肝脓肿的关系也不容忽视[12,13]。本研究显示两组均以右叶脓肿多见,AIDS组较非AIDS组并发感染率更高,且多并发多部位感染,主要以肺部感染多见,其次为腹腔感染和胆系感染等。非AIDS组以胆系感染多见,其次为肺部感染。因此,两组患者在感染途径上可能存在差别,需进一步深入探究。明确病原菌类型可以指导临床合理应用抗生素。目前,肺炎克雷伯菌已超越大肠埃希菌成为肝脓肿患者最常见的致病菌[14,15],有文献报道,大多数AIDS并发肝脓肿的致病菌培养比较困难[16],本研究结果与文献报道一致。AIDS组仅7%患者脓液培养阳性,且致病菌种类多样,在抗生素选择方面存在困难,而非AIDS组致病菌以肺炎克雷伯菌为主。本研究中患者在抗生素应用方面有以下特点:主要以碳青霉烯类和头孢类为主,因碳青霉烯类抗菌谱广,因此AIDS组应用相对较多。万古霉素对于重症感染的疗效确切且比较安全, 多应用于AIDS组重症患者。根据患者临床实际情况适当加用硝基咪唑类以覆盖厌氧菌感染,同时根据患者体温、炎性指标、药敏实验和抗生素使用疗程,随时调整抗生素的种类和用量。
本研究显示,两组患者肝功能均有不同程度的受损,但两组外周血白细胞计数存在显著性差异。AIDS组WBC和中性粒细胞比率正常或者偏低,可能与AIDS患者免疫功能严重缺陷有关。有资料显示,AIDS患者感染程度越重,其白细胞计数也越低[17]。CRP明显升高,因此对于AIDS并发肝脓肿患者CRP较WBC更为敏感。
AIDS患者免疫功能低下,一般情况差。本组AIDS患者自发病到入院治疗时间长,平均为14.0天,且体温均在38.5度以上,因此对传统外科手术耐受性差。为减轻患者痛苦及术后并发症,微创治疗显得尤为重要[18,19]。本组患者中最大脓肿为21.6×15.6 cm,仅仅内科抗感染治疗效果差,周期长。随着影像学的发展,超声引导下介入治疗已经普遍应用于肝脓肿的治疗,其主要并发症有引流管阻塞或脱落、胆瘘和局部出血或感染[20]。本组1例AIDS患者引流管脱出,可能由于术后护理不当所致,因此术前向患者及其家属讲解引流管的护理方法很重要。4例因脓液粘稠而引流不畅。当出现以上两种情况时,应及时复查超声,合理评估脓肿情况,可选择再次置管或行外科手术。本组1例患者先后8次置管,1例患者同时置入3根引流管。对于难治性患者可先行超声介入治疗,缓解症状,待全身情况好转,可耐受手术时,再行外科手术治疗。2例患者术后穿刺处疼痛,经药物治疗后疼痛缓解,可能由于穿刺中损伤膈神经。AIDS并不会增加患者治疗时间和并发症的发生。
