人EFTUD2基因靶向小分子化合物筛选细胞模型的建立*
2021-07-14田安然徐瑞瑞胡平平李毓雯朱传龙
田安然,徐瑞瑞,胡平平,李毓雯,朱传龙
延伸因子结合蛋白2(elongation factor Tu GTP-binding domain-containing 2,EFTUD2)是一种剪接体GTP酶,参与机体许多重要的生物学过程,例如针对肝炎病毒入侵时的先天免疫应答[1,2]、癌症的发生[3,4]、神经发育[5]、细胞的成熟分化[6]和颅面畸形[7,8]等。EFTUD2在肝炎病毒感染过程中发挥不可或缺的调控作用。然而,针对EFTUD2的靶向细胞模型还较少。因此,本研究旨在利用HepG2细胞构建以EFTUD2为靶点的化合物筛选细胞模型,不仅为后续筛选可上调EFTUD2表达的化合物奠定研究基础,而且也为开发治疗慢性乙型肝炎新型药物提供新思路。
1 材料与方法
1.1 细胞、试剂与仪器 HepG2细胞株由哈佛大学Wenyu Lin教授提供。LV6载体、pGag/Pol、pRev、pVSV-G质粒(上海吉玛基因股份有限公司);高纯度质粒小提试剂盒、DNA凝胶回收试剂盒(天根生化);中量质粒抽提试剂盒(杭州爱思进生物技术有限公司);XbaI和BamHI DNA内切酶(加拿大MBI Fermentas公司);嘌呤霉素(生工);青霉素和链霉素(上海碧云天生物有限公司);Polybrene(美国Sigma-Aldrich公司);荧光素酶报告基因检测试剂盒(美国promega公司);ClonExpress© Entry One Step Cloning Kit(南京诺唯赞生物科技有限公司);胎牛血清、DMEM培养基、Opti-MEM培养基(美国Gibco公司)。AIRTECH 超净工作台(苏州安泰公司);GloMaxTM20/20 发光检测仪,GloMaxTM96 微孔板发光检测仪(美国promega公司)。
1.2 细胞培养 取HepG2细胞,用含有10%胎牛血清的DMEM培养基培养,常规加入抗生素(青霉素100 u/ml,链霉素0.1 mg/ml)。细胞的培养环境为37℃,5% CO2。当单层贴壁细胞生长密度约80%时进行传代。
1.3 LV6慢病毒载体构建和包装 LV6载体含有EF-1a启动子,嘌呤霉素筛选标记,无荧光标签。通过融合PCR技术将hEFTUD2pro-0.5kb基因片段和来自LV17载体的荧光素酶基因片段组成目的片段Epro0.5-LUC。在37℃恒温下,用XbaI和BamHI DNA内切酶酶切LV6载体2 h。随后,对酶切条带用琼脂糖凝胶电泳进行鉴定,并回收LV6载体条带。将回收好的Epro0.5-LUC目的片段利用克隆试剂盒重组到线性化的LV6载体中,构建成LV6-Epro0.5-LUC穿梭质粒。配置好反应体系并混匀(5 × CE Entry缓冲液4 μl;LV6载体1 μl;Epro0.5-LUC 2 μl;Exnase Entry 2 μl;DEPC水11 μl),于37℃环境下反应30 min。在反应结束后,迅速取出反应管,转移到低温水浴中,冷却后置4℃冰箱备用。待293T细胞生长较好时,用胰酶消化离心,用完全培养基重悬并接种到15 cm培养皿中,继续培养至细胞密度约为70%~80%。重组慢病毒穿梭质粒LV6-Epro0.5-LUC,与包装质粒pGag/Pol、pRev和pVSV-G共转染293T细胞72 h,收集病毒液并进行滴度检测。
1.4 嘌呤霉素药物筛选浓度的确定 按照5×104细胞/孔,将HepG2细胞接种于24孔板,每孔液体总量为500μl,均匀铺板后,于37℃,5% CO2条件下培养24 h。每孔加入嘌呤霉素,终浓度分别为0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3和2.4 μg/ml。维持嘌呤霉素浓度培养细胞,并根据细胞生长状态适时换液,连续观察6 d,选择能在6 d内完全杀死细胞的最低浓度作为嘌呤霉素的工作浓度。
1.5 感染慢病毒构建细胞模型及其筛选 对HepG2细胞进行计数,按照1×104细胞/孔将HepG2细胞接种于48孔板,在37℃,5% CO2条件下培养24 h,进行慢病毒感染。每孔加入5 μg/mL 的 Polybrene,对病毒原液按照MOI值100感染HepG2细胞,8 h后更换新鲜含10% FBS的培养基,继续置于37℃,5% CO2条件下培养24 h。再将每孔的培养基更换成含嘌呤霉素的选择性培养基(含1.0μg/ml嘌呤霉素),每隔2~3 d换液一次,维持嘌呤霉素浓度在选择压力下持续培养2 w左右。
1.6 单克隆细胞的获取 成功感染病毒细胞能够继续存活,待长出多克隆细胞后,进行荧光素酶活性检测。选择荧光素酶活性较强的细胞继续扩大培养。将扩大培养的多克隆细胞株消化离心,制备成单细胞悬液,计数后将细胞数调制为5000细胞/ml,再逐级稀释成1000细胞/ml、100细胞/ml、50细胞/ml、20细胞/ml、10细胞/ml和5细胞/ml。按不同细胞数梯度分别接种96孔板,每孔加入细胞悬液100μl,使每孔含有一个细胞,维持嘌呤霉素浓度不变。待细胞贴壁后,在显微镜下观察并将含有单个细胞的培养孔进行标记,置于37℃,5% CO2培养箱培养。待长出单克隆细胞株后(约15~20 d),挑取生长状态良好的5株细胞进行测序检验,并留取适量相应的细胞进行荧光素酶检测。选择测序结果正确且荧光读值最高的细胞株继续扩大培养。同时,维持嘌呤霉素浓度。筛选出具有正常细胞周期且能稳定传代20代以上的单克隆细胞株,大量冻存,将获得的细胞命名为Epro-LUC-HepG2细胞。
2 结果
2.1 LV6-Epro0.5-LUC慢病毒载体构建成功 通过融合PCR技术,将前期实验筛选出的具有最强启动活性的hEFTUD2pro-0.5kb启动子序列与萤火虫荧光素酶报告基因整合成融合基因,通过限制性内切酶XbaI和BamHI双酶切将融合基因同源重组进LV6载体中,构建LV6-Epro0.5-LUC穿梭质粒。酶切穿梭质粒并进行琼脂糖凝胶电泳鉴定,经测序比对,验证正确无误后,与包装质粒(pGag/Pol、pRev、pVSV-G)一起转染293T细胞,进行慢病毒包装并进行滴度检测。LV6-Epro0.5-LUC载体图谱见图1。利用琼脂糖凝胶电泳和测序鉴定重组慢病毒载体(图2、图3),将成功获得的慢病毒命名为LV6-Epro0.5-LUC慢病毒。

图1 LV6-Epro0.5-LUC载体图谱
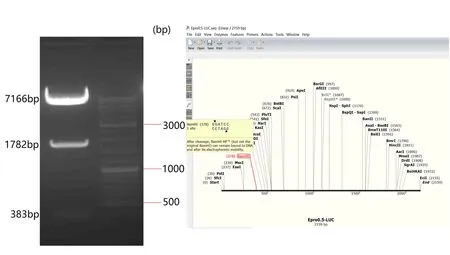
图2 琼脂糖凝胶电泳鉴定LV6-Epro0.5-LUC重组载体 采用Xba I和BamH I双酶切构建LV6-Epro0.5-LUC重组载体,在Epro0.5-LUC融合基因中存在一个BamH I酶切位点,在双酶切重组载体进行电泳鉴定时,产生了3个酶切条带

图3 测序鉴定重组LV6-Epro0.5-LUC载体
2.2 嘌呤霉素药物筛选浓度的确定结果 在HepG2细胞,摸索嘌呤霉素药物筛选浓度,连续观察6 d加入嘌呤霉素培养的细胞并拍照记录(图4),能在6 d内完全杀死细胞的最低浓度被确定为1.0 μg/ml,并以该浓度作为后续单克隆细胞筛选时所用的嘌呤霉素的浓度。

图4 嘌呤霉素致死浓度的筛选
2.3 获得Epro-LUC-HepG2单克隆稳转细胞株 在LV6-Epro0.5-LUC慢病毒感染HepG2细胞,感染后8 h更换新鲜完全培养基继续培养24 h,加入终浓度为1.0μg/ml的嘌呤霉素进行药物筛选。维持药物选择压力持续培养2 w左右,用长出的多克隆细胞通过有限稀释法挑选出5株单克隆细胞株。对5株细胞进行测序验证,验证目的序列是否克隆入细胞基因组,并利用荧光素酶报告基因系统检测5株单克隆细胞株的荧光素酶活性,选择荧光素酶活性最高的细胞株进行扩大培养(图5),结果成功建立了单克隆细胞模型,将其命名为Epro-LUC-HepG2细胞。

图5 各克隆细胞株的荧光素酶活性的比较 在挑出的5株单克隆细胞中,第4株细胞生长状况较差,被弃用
3 讨论
乙型肝炎病毒(hepatitis B virus,HBV)是一种嗜肝DNA病毒。HBV不直接杀死被感染的肝细胞。当它被识别为外来抗原时,宿主免疫系统就会锁定并破坏受感染的肝细胞,从而导致肝组织的炎症和坏死[9]。慢性HBV感染是一个重大的公共卫生问题。世界卫生组织在2015年估计,约有2.57亿人(全球人口的3.5%)慢性感染HBV,其中大多数人群出生于广泛使用乙肝疫苗之前。除此之外,长期感染HBV可导致肝脏纤维化和硬化,进一步会引起25%~40%HBV携带者发生失代偿期肝病和/或肝细胞癌[10]。
传统的治疗HBV感染的药物主要是核苷(酸)类似物和干扰素-α(IFN-α)[11]。前者主要是靶向在干扰HBV生命周期中的逆转录过程而发挥作用,其优点是良好的耐受性和强效的抗病毒活性[12]。但是,它们不能完全抑制病毒逆转录酶的DNA合成[13]。细胞因子介导的治疗例如IFN-α,能够调节免疫系统,通过诱导各种干扰素刺激基因(IFN-stimulated genes,ISGs)表达来发挥抗病毒作用。有研究提示聚乙二醇化干扰素的使用会产生较多的副作用,比如流感样综合征、体质量减轻、中性粒细胞减少和血小板减少等,可能增加感染和出血风险。因此,被禁用于晚期肝病以及出现白细胞减少和严重血小板减少的患者[14]。所以,要根据患者的基本情况来考虑是否进行IFN-α治疗,也使IFN-α的应用受到一定的限制。因此,迫切需要更加安全、有效、便捷的治疗方法,让尽可能多的慢性乙型肝炎患者受益。
U5小核糖核蛋白是剪接体激活的关键部分,而EFTUD2是U5小核糖核蛋白的核心成分,它属于一种GTP酶,能够与GTP/GDP结合[15-17],这一特性对于维持剪接体的正常功能至关重要。有研究发现EFTUD2基因是肝细胞癌患者的一个预后独立预测因子,其表达水平较高的患者总体生存时间和肿瘤复发时间明显较短[4]。本课题组前期的研究已经证明EFTUD2在丙型肝炎病毒感染过程中能够发挥抗病毒作用,主要通过其pre-mRNA剪切作用来调控下游的调节因子,例如视黄酸诱导基因蛋白I和黑色素瘤分化相关基因5,进而激活干扰素调节因子3,促进ISGs的表达[2]。所以,EFTUD2基因在机体对抗肝炎病毒感染过程中具有重要的免疫调节作用,对其进行多方面的深入研究将为治疗病毒性肝炎提供更多思路和选择。
人类原代肝细胞是HBV复制研究的金标准。然而,由于人肝脏组织的来源有限和存在遗传多样性,并且这类细胞容易丧失其本身特性和持续支持HBV复制的能力,使得该细胞模型的有效性和可用性受到了不少限制[18,19]。HepG2细胞是一种人肝癌细胞系,最初来源于一名15岁男性高分化肝癌患者[20],它在感染HBV后能够支持HBV的复制。因此,是HBV相关研究较为理想的细胞系。除了在病毒性肝炎研究领域被广泛使用外,HepG2细胞已经被成熟应用于药物的毒性试验、自噬损伤和细胞代谢通路等其他方面的研究。此外,由HepG2衍生而来的细胞,如HepG2.2.15和HepG2-NTCP细胞也在各种病毒性肝炎研究中得到广泛使用。
本研究根据前期实验的结果,选择具有较强启动活性的hEFTUD2pro-0.5kb启动子片段,通过构建含有目的启动子片段和Luciferase基因片段的慢病毒载体,将两种基因片段克隆入HepG2细胞基因组,筛选出阳性克隆株并进行测序验证。由于LV6重组载体中插入了Luciferase基因片段,因此能够利用荧光素酶基因报告系统来检测细胞内荧光素酶基因的表达,从而可以间接地反映该启动子片段是否能够有效启动EFTUD2基因表达。该细胞系含有人EFTUD2基因启动子片段,更加便于后续寻找能够上调EFTUD2表达的化合物的研究。
