LPS 激活的星形胶质细胞在iPSCs 增殖中的作用及机制*
2021-07-14沈剑虹陈一楠倪兰春
蒋 锐,沈剑虹,陈一楠,林 毅,倪兰春,施 炜*
(南通大学附属医院神经外科,南通 226001)
创伤性脑损伤(traumatic brain injury,TBI)是临床上最常见的中枢神经系统(central nervous system,CNS)损伤,目前研究[1-2]认为TBI 后的继发性脑损伤是以神经细胞丢失、凋亡为主要特征的病变,同时CNS 中神经元损伤后自身无法获得再生。尽管近年来细胞移植治疗成为TBI 后神经修复治疗的热点[3],但由于CNS 中自身内源性神经干细胞(endogenous neural stem cells,eNSCs)数量有限,造成了内源性神经修复途径受到限制。所以,通过外源性种子细胞移植来获得神经修复成为目前TBI 后细胞替代治疗的主要研究方向。对于外源性种子细胞的选择,虽然神经干细胞(neural stem cells,NSCs)作为外源性干细胞最早被用于细胞移植,然而NSCs 实际操作中获取十分困难,不利于使用;近年来,诱导多能干细胞(induced pluripotent stem cells,iPSCs)成为神经修复中的热门种子细胞并被寄予厚望[4]。由于iPSCs 本身具有多潜能分化能力及复制能力等特点;更为重要的是,相较于NSCs、胚胎干细胞(embryonic stem cells,ESCs)等其他类型的干细胞,iPSCs 可以利用患者自己的体细胞来制备其专有的诱导多能干细胞,因而不会产生免疫排斥[5];此外,iPSCs 还具有来源广泛、相对容易获得的优点。因此,iPSCs 作为组织工程中极为重要的一种外源性种子细胞得到了极大的推广。在各种原因引起脑损伤时,星形胶质细胞对神经细胞的保护作用包括调节胞外环境、产生及释放生长因子、调节免疫反应、提供神经递质前体物质及三羧酸循环中间产物、摄取神经递质支持神经元、参与突触神经元的生成。此外,星形胶质细胞中的线粒体是细胞能量代谢及氨基酸类神经递质(谷氨酸、γ-氨基丁酸等)物质前体合成的主要场所,与神经元的存活有关[6-7]。因此,本研究将星形胶质细胞与iPSCs 进行共培养,体外研究其对于iPSCs 的作用及机制,以期将星形胶质细胞与iPSCs 共同进行移植,为移植细胞的存活及神经元的生长及发育提供更有利的环境。
本研究首先验证炎症激活的星形胶质细胞对于iPSCs 增殖的作用;然后,将炎症激活的星形胶质细胞与iPSCs 共同进行体内移植,在一定的时间后切片观察体内iPSCs 的存活情况;最后,对产生上述现象的机制进行初步研究,通过转录组测序等方法初步明确激活的星形胶质细胞产生促进iPSCs 增殖作用的机制。
1 材料和方法
1.1 实验动物 新生1 d 的SD 大鼠,雌雄不限,由南通大学实验动物中心提供。
1.2 实验方法
1.2.1 体外大鼠星形胶质细胞原代培养及鉴定 取新生1 d 的SD 大鼠,75%乙醇消毒后在超净台下剪开头部皮肤及颅骨,取出完整脑组织,分离出双侧大脑皮质并置于有DMEM/F12 的细胞培养皿内,将大脑皮质剪至1 mm3大小的组织块,将组织机械吹打至无明显组织块,静置10 min 后,取上层悬液以1 000 r/min 的速度离心5 min,重复3 次;用含10%胎牛血清的DMEM/F12 完全培养基重悬细胞,以不锈钢滤网(Φ=200 μm)过滤,用细胞计数板进行细胞计数;以24 孔板每孔5×104个细胞接种至多聚赖氨酸包被后的孔内,置于37 ℃、5%CO2培养箱中进行培养。后用胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体进行荧光染色验证。本实验方案获南通大学实验动物伦理委员会批准(S20200315-002)。
1.2.2 重编程星形胶质细胞为iPSCs 并鉴定 大鼠iPSCs 细胞诱导生成慢病毒试剂盒购于上海斯丹赛生物有限公司,根据试剂盒说明书进行操作。
1.2.3 Western Blot 用50 μL 2×样品缓冲液重悬细胞,置于开水煮沸10 min。待样品冷却至室温后,12 000 g 离心2 min,取20 μL 上清进行十二烷基硫酸钠-聚丙酰胺凝胶电泳,待电泳完成后,将蛋白样品转印至PVDF 膜上,使用相应抗体作为一抗,检测相应蛋白的表达情况。标记β-actin 抗体作为对照。
1.2.4 免疫荧光 实验前准备好明胶预包被的小圆片并放入24 孔板中,加入iPSCs 细胞培养液并置于37 ℃细胞培养箱中培养;第2 天,将iPSCs 消化后重悬,根据细胞密度按比例加入已准备好的24 孔板中,待克隆重新形成,大小适中时吸去培养液,0.01 mol/L磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗3遍,加入适量4%多聚甲醛,室温固定30 min,吸去多聚甲醛,用0.01 mol/L PBS 洗3 遍,添加封闭液,室温封闭2 h,再用0.01 mol/L PBS 洗3 遍,添加一抗鼠抗SSEA1 单克隆抗体(1∶500 稀释),放入4 ℃冰箱孵育过夜,0.01 mol/L PBS 洗3 遍,加入羊抗鼠二抗(1∶1 000 稀释)、Hoechst33342(1∶2 000 稀释),避光下孵育20 min,0.01 mol/L PBS 洗3 遍后,甘油缓冲液封片,于荧光显微镜下观察并拍照。
1.2.5 细胞增殖检测 将星形胶质细胞接种至24孔板专用Transwell 小室内,添加培养液至1 mL/孔,并按5 μg/mL 加入脂多糖(lipopolysaccharide,LPS),将iPSCs 接种于24 孔板,培养24 h 后,将载有星形胶质细胞的Transwell 小室转移至24 孔板内,并添加iPSCs 细胞完全培养基至1.5 mL,分别于24、48、72、96 h 取出Transwell 小室,加入500 μL 含10%细胞计数试剂盒(cell counting kit-8,CCK-8)溶液的DMEM/高糖基础培养基孵育2 h;用酶标仪测定在450 nm 处的吸光度值(optical density,OD)。
1.3 统计学方法 数据分析采用SPSS 10.0 统计软件,数据均以表示,组间比较采用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结 果
2.1 LPS激活的星形胶质细胞促进iPSCs 的增殖首先采用不同浓度LPS 刺激星形胶质细胞,通过聚合酶链式反应(polymerase chain reaction,PCR)验证刺激后释放出的白细胞介素-6(interleukin-6,IL-6)等炎症因子的表达水平,结果显示5 μg/mL LPS 刺激下星形胶质细胞活化程度最高(图1A)。使用大鼠iPSCs 生成试剂盒感染大鼠星形胶质细胞后,干细胞基因Sox2、Oct4、Nanog 和Rex1 的表达增加(图1B~C)。接着,在体外共培养经LPS 激活的星形胶质细胞和iPSCs。将iPSCs 与活化的星形胶质细胞按不同浓度、不同时间共培养,CCK-8 法结果显示,当炎症激活的星形胶质细胞按5∶1 的比例与iPSCs 细胞共培养72 h 时,其OD450值较不同时间点组差异更为明显(图1D)。这表明可通过与星形胶质细胞共培养来促进iPSCs 的增殖活性。进一步通过流式细胞术证实了这一结果,当iPSCs 与活化的星形胶质细胞共培养时,处于S期的细胞更多(图1E)。免疫荧光也确认了这些结果(图1F)。共培养组的Ki-67 阳性iPSCs 比对照组多。结果表明,LPS 活化的星形胶质细胞可以促进iPSCs 增殖。
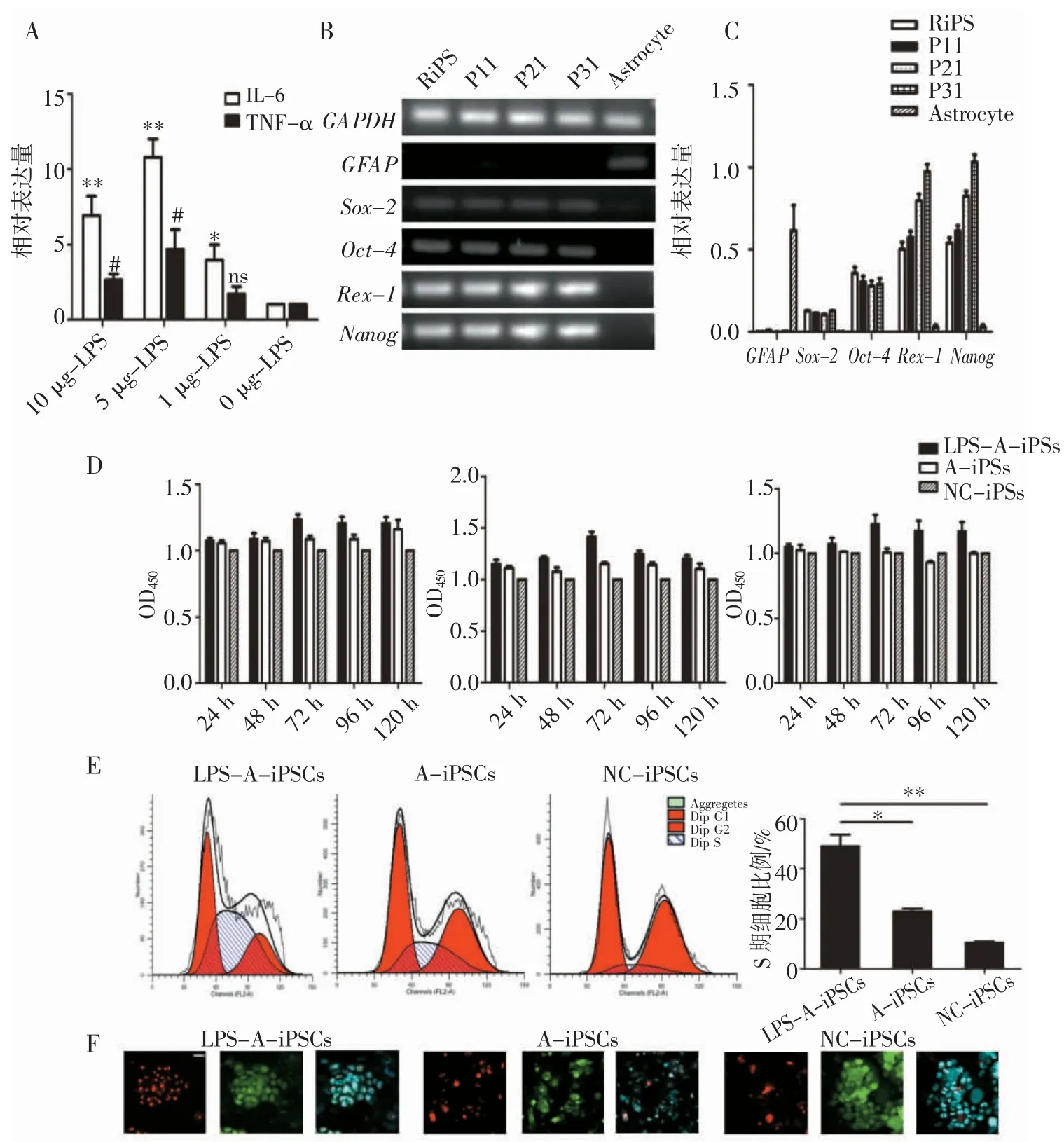
图1 LPS 激活的星形胶质细胞促进iPSCs 的增殖
2.2 转录组测序 尽管已经证明活化的星形胶质细胞会促进iPSCs 增殖,但是具体机制仍然未知。因此,对iPSCs 进行了转录组分析。使用京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)分析检查了原始星形胶质细胞和活化的星形胶质细胞,发现LPS 刺激后胰岛素样生长因子1(insulin like growth factor 1,IGF-1)的表达显著增加(图2A)。还发现,IGF-1 与癌症通路以及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路相关(图2B)。通过对共培养的iPSCs 进行KEGG分析,发现PDZ 结合激酶(PDZ-binding-kinase,PBK)和细胞周期相关的途径高度丰富,包括磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/AKT)途径(图2C~D)。

图2 转录组测序
2.3 LPS 激活的星形胶质细胞通过IGF-1 分泌促进iPSCs 存活和增殖 在活化的星形胶质细胞中,IGF-1 的表达明显上调(图3A~C)。IGF-1 的释放与细胞密度有关。当细胞密度≥104个细胞时,检测到IGF-1 的表达水平达到高峰(图3D)。此外,使用不同浓度的LPS 刺激星形胶质细胞,发现LPS 达到10 μg/mL 时,IGF-1 的表达水平最高(图3E)。为了进一步证明星形胶质细胞分泌的IGF-1 在iPSCs 增殖中的作用,在星形胶质细胞中过表达IGF-1,结果表明iPSCs 与过表达IGF-1 的星形胶质细胞共培养时发生增殖,并且共培养的iPSCs 的生存能力得到了提高(图3F),而且,免疫荧光分析也证明了iPSCs 细胞膜上存在IGF-1 受体的表达(图3G)。
2.4 上调PBK 通过直接与PI3K 结合来激活PI3K/AKT 信号通路 为进一步阐明活化的星形胶质细胞分泌的IGF-1 促进iPSCs 增殖的机制,对共培养的iPSCs 进行了转录组学分析。通过差异基因表达的分析,发现与活化的星形胶质细胞共培养的iPSCs 中PBK 的表达显著上调,而p-PI3K、p-AKT 的趋势与之相仿(图4A~C)。免疫荧光检测结果也显示PI3K、AKT、p-PI3K 和p-AKT 在与活化的星形胶质细胞共培养的iPSCs 中高表达(图4D)。为了进一步研究PBK 对PI3K/AKT 途径的影响,使用病毒干扰iPSCs中的PBK,并检测了下游分子p-AKT 和p-PI3K。结果显示,当PBK 的表达降低时,AKT 和PI3K 的表达没有改变,而p-AKT 和p-PI3K 的表达则明显降低(图4E)。

图4 PBK 通过直接与PI3K 结合来激活PI3K/AKT 信号通路
随后,使用免疫荧光和蛋白质印迹进一步检测了PI3K/AKT 通路下游蛋白的表达。结果表明,XIAP、P27KIP、mTOR 和p-mTOR 这些下游分子在与活化的星形胶质细胞共培养的iPSCs 中均显著上调(图5A~C)。

图5 PI3K/AKT 通路起的下游蛋白表达检测
3 讨 论
TBI 分为原发性脑损伤和继发性脑损伤[8-9]。外部机械力的损伤作用是原发性脑损伤最主要的发病机制,而炎症反应则是继发性脑损伤的重要发病机制[10]。TBI 后的脑实质内有大量的细胞因子及趋化因子表达量发生变化,这些因子的变化使炎症水平级联式升高,从而导致氧自由基过载、线粒体功能紊乱、兴奋性氨基酸释放过多等,造成大量细胞凋亡及神经功能缺失[11]。
细胞移植治疗TBI 后所造成的神经功能障碍成为目前研究的热点。近年来,NSCs、间充质干细胞(mesenchymal stem cells,MSCs)、ESCs 及iPSCs 等作为种子细胞在多种神经系统疾病中的作用被广泛研究[12-15]。目前,iPSCs 移植治疗的方法已经在诸如帕金森病、阿尔茨海默病、侧索硬化等神经系统疾病研究中获得了理想的结果[16-19]。因此,在本研究选择iPSCs 作为种子细胞。
但值得一提的是,尽管细胞移植治疗技术已经获得较大突破,但iPSCs 移植与其他细胞移植一样,都存在细胞移植效率低的难题,从而导致了缺乏足够量存活的种子细胞来补充丢失的神经细胞。最近,有研究[20]表明,相对于传统的单细胞移植,脑损伤后通过干细胞联合其他辅助细胞的“双细胞”移植更有利于移植的种子细胞在大脑中存活、增殖。星形胶质细胞是CNS 中含量最为丰富的胶质细胞。最新的研究[20]结果发现,体外LPS 诱导炎症活化的星形胶质细胞与MSCs 共培养,可以促进MSCs 的增殖,并且在TBI 后将受LPS 炎症激活的星形胶质细胞与MSCs 双细胞联合移植有利于MSCs 在体内的存活及增殖。因此,在本研究中,将LPS 诱导的活化星形胶质细胞与iPSCs 在体外共培养,以期发现炎症激活的星形胶质细胞能否促进iPSCs 增殖,从而有利于iPSCs 移植后存活。本研究首次发现活化的星形胶质细胞在体外能够促进iPSCs 的增殖;这提示双细胞共同移植具有良好的应用价值。
进一步实验阐明了活化的星形胶质细胞可导致IGF-1 生长因子表达上调,由活化的星形胶质细胞分泌的IGF-1 等可能通过作用于iPSCs 表面相应的IGF-1R,从而与PBK 发生反应,导致PI3K/AKT 信号通路磷酸化增强,进而促进了iPSCs 的增殖。为以后选择合适靶点促进iPSCs 增值提供了相应的理论基础。
当然,阐明IGF-1 作用于iPSCs 促进其增殖的内在机制仍有许多问题值得深入研究,如:活化的星形胶质细胞中IGF-1 上调的原因是什么?PBK 与PI3K是如何产生相互作用的?这些问题还需要进一步明确。
总之,本研究为星形胶质细胞重编程而来的iPSCs 作为TBI 后干细胞移植的种子细胞奠定了实验基础,同时为TBI 后通过活化的星形胶质细胞与iPSCs 联合移植促进iPSCs 的存活提供了思路,为开展双细胞联合移植进行CNS 神经再生修复提供了理论依据。
