非小细胞肺癌患者血浆高迁移率族蛋白B1水平与临床病理的关系*
2021-07-14胡亚娥茅家慧
胡亚娥,杨 萍,茅家慧,杨 勇
(1 南通大学医学院病理生理学系,南通 226001;2 苏州大学附属第二医院检验科)
肺癌是严重威胁人类生存的主要恶性肿瘤之一。全球范围内肺癌发病率与死亡率在男性人群中均处于各种恶性肿瘤的首位;女性人群中,肺癌的发病率位居第四,而死亡率高居第二[1-2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌病例的85%,NSCLC 主要包括腺癌和鳞状细胞癌两种组织学类型[3]。尽管有手术、化学疗法和靶向疗法等治疗手段,但NSCLC 患者的5 年生存率仅为15%[4]。NSCLC 的高死亡率部分原因是肿瘤细胞的侵袭和转移,另一部分原因是缺乏有效的早期检测及评估预后的手段。因此,鉴定新的肿瘤生物标志物在NSCLC 的临床诊断、病情评估及预后评估过程中显得尤为重要。
高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种非组蛋白染色质结合蛋白,在真核细胞中广泛存在,其蛋白结构包含两个同源的DNA 结合结构域(A 和B 盒)和一个C 末端。细胞核内的HMGB1 可参与基因转录、DNA 复制和基因表达调节,而释放到细胞外的HMGB1 在炎症和肿瘤发生发展过程中起重要作用[5]。研究[6-7]表明,HMGB1 在多种恶性肿瘤组织中高表达,与肿瘤细胞的增殖、侵袭和转移关系非常密切。近年来关于HMGB1在NSCLC 中表达的研究仍存在争议。研究[8-9]发现HMGB1 在NSCLC 组织中表达上调,在NSCLC 的诊断和预后判断中起重要作用。但X.K.SHEN 等[10]发现HMGB1 在NSCLC 组织中表达下调。因此,本研究检测NSCLC 患者肺癌和癌旁组织中HMGB1 mRNA和蛋白的表达及NSCLC 患者血浆HMGB1 水平,并分析患者血浆HMGB1 水平与NSCLC 临床特征的关系,进一步明确血浆HMGB1 水平检测在NSCLC诊疗过程中的意义。
1 对象与方法
1.1 病例来源 本研究选取南通大学附属医院和苏州大学附属第二医院2015 年10 月—2017 年10月收治的NSCLC 患者50 例,年龄45~83 岁,平均64 岁,所有患者经病理检查确诊为NSCLC,未接受过化疗。正常对照组为正常体检人群30 例,年龄42~79 岁,平均62 岁。该研究得到南通大学附属医院和苏州大学附属第二医院医学伦理委员会的批准,研究对象均签署知情同意书。
1.2 组织和血浆标本收集 收集NSCLC 患者术后肺癌肿瘤组织和癌旁组织(距离癌组织边缘5 cm,且病理证实为正常肺组织),-80 ℃保存。研究对象空腹12 h,早晨采集肘静脉血3 mL,置于3.2%枸橼酸钠抗凝管内(抗凝剂∶全血=1∶9),混匀后4 ℃,2 500 g 离心10 min。保留血浆,-80 ℃保存。
1.3 实时定量逆转录聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测HMGB1 mRNA 水平 TrizolTM试剂提取肺癌组织和癌旁组织的总RNA,按照逆转录试剂盒(Fermentas,CA)说明书操作。将2 μg 总RNA 逆转录为cDNA。HMGB1引物上游:5′-TCAAAGGAGAACATCCTGGCCTGT-3′;下游:5′-CTGCTTGTCATCTGCAGCAGTGTT-3′。GAPDH 引物上游:5′-GGTCTCCTCTGACTTCAACA-3′;下游:5′-AGCCAAATTCGTTGTCATAC-3′。SYBR Green 混合液(ABI,USA) 5 μL、cDNA 0.5 μL、上游及下游引物各0.2 μL 和4.1 μL 不含核酸酶的水组成总体积10 μL 的反应体系。反应条件为:95 ℃10 min 1 次循环初始变性,95 ℃15 s 变性,循环40 次,60 ℃30 s 退火,72 ℃30 s 延伸。GAPDH作为内参,2-△△CT方法计算基因表达水平。HMGB1/GAPDH 比值表示HMGB1 mRNA 的相对表达量。
1.4 Western Blot 检测HMGB1 蛋白水平 肺癌组织和癌旁组织在裂解缓冲液(含蛋白酶抑制剂)中4 ℃裂解30 min,12 000 g 离心10 min。10%聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离10 μg 总蛋白,在恒电流(200 mA)下,转膜120 min。PVDF 膜用5%脱脂奶粉室温封闭1 h,兔抗人HMGB1 单克隆抗体(1∶10 000;Abcam,USA),4 ℃摇床过夜,辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(1∶10 000;Bioworld,USA),室温摇床孵育1 h。采用增强的化学发光法进行检测。GAPDH 作为内参,ImageJ 图像软件分析,HMGB1/GAPDH 比值表示HMGB1 蛋白的相对表达量。
1.5 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血浆HMGB1 水平 按照人HMGB1 ELISA 试剂盒(Shino-Test,Japan)说明书操作。酶标板的每个孔中先加入100 μL 样品稀释液,再加入标准品和血浆样品10 μL,37 ℃水浴24 h。洗涤后每孔加入100 μL 过氧化物酶标记的抗HMGB1,2 单克隆抗体溶液,室温2 h。洗涤后每孔加入100 μL 底物溶液(50 μL A 液+50 μL B 液),室温避光孵育30 min。加入100 μL 终止液,多功能酶标仪测定各孔的OD450值。
1.6 统计学方法 采用GraphPad Prism 8.0 软件进行统计分析。计量资料以表示,采用t 检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 HMGB1 在NSCLC 组织中的表达增加 RTqPCR 结果显示,NSCLC 组织中HMGB1 mRNA 的表达水平是癌旁组织的2.98 倍(图1A)。Western Blot结果显示,NSCLC 组织中HMGB1 蛋白表达水平是癌旁组织的1.83 倍(图1B~C)。
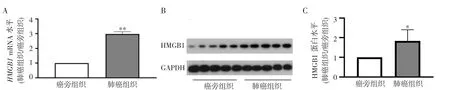
图1 癌旁肺组织和肺癌组织中HMGB1 mRNA 和蛋白的表达水平
2.2 NSCLC 患者血浆HMGB1 水平升高,术后下降ELISA 检测结果显示正常对照组血浆HMGB1 水平为(2.27±0.63)ng/mL,NSCLC 患者为(5.86±1.60)ng/mL。与正常对照组比较,NSCLC 患者血浆HMGB1 水平显著升高(P<0.01)(图2A)。
NSCLC 患者血浆HMGB1 水平在术前为(5.67±0.67) ng/mL,术后为(3.34±0.67) ng/mL。与术前比较,NSCLC 患者术后血浆HMGB1 水平显著降低(P<0.01)(图2B)。
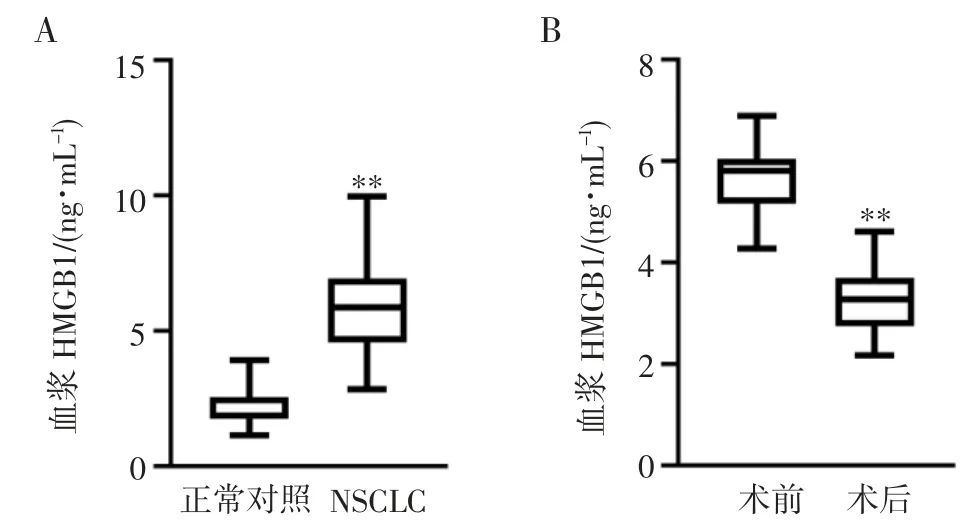
图2 NSCLC 患者血浆HMGB1 水平
2.3 血浆HMGB1 水平与NSCLC 临床特征的关系NSCLC 患者按照年龄、性别、肿瘤大小、病理类型、临床分期及有无远处转移进一步分组,结果表明,肿瘤直径≥3 cm 的NSCLC 患者血浆HMGB1 水平明显高于肿瘤直径<3 cm 者(P<0.01)。临床分期Ⅲ~Ⅳ期的NSCLC 患者血浆HMGB1 水平明显高于Ⅰ~Ⅱ期的患者(P<0.01)。有远处转移的NSCLC 患者血浆HMGB1 水平较无远处转移者明显升高(P<0.01)。而按照年龄、性别及病理类型分组比较,年龄<60 岁与≥60 岁,男与女,腺癌组与鳞癌组的患者血浆HMGB1 水平差异均无统计学意义(均P>0.05)(表1),提示NSCLC 患者血浆HMGB1 水平与肿瘤大小、临床分期及有无转移密切相关,但与患者年龄、性别及病理类型无明显相关性。

表1 血浆HMGB1 水平与NSCLC 患者临床特征的关系ng/mL
3 讨 论
细胞外HMGB1 作为一种细胞因子参与炎症和肿瘤发生发展过程,HMGB1 在乳腺癌[11]、胃癌[12]、肝细胞癌[13]等多种类型的恶性肿瘤中表达增加并促进肿瘤的侵袭和转移。由于检测方法、样本量大小及统计方法的不同,关于HMGB1 在NSCLC 中的表达是否升高的结论不一致。本研究发现NSCLC 癌组织表达的HMGB1 mRNA 和蛋白水平均较癌旁组织明显升高,这与以往采用免疫组织化学方法检测NSCLC肿瘤组织中HMGB1 蛋白表达的结果[8,14]一致。
HMGB1 释放到细胞外有两种可能的机制:由激活的免疫细胞主动分泌或从受损或坏死细胞被动释放并转移到细胞外[7]。在化疗过程中,坏死的肿瘤细胞核内HMGB1 被动释放增加。肿瘤细胞也可在受到内源性或外源性刺激因素作用下主动分泌HMGB1[15]。本研究发现NSCLC 患者血浆HMGB1 水平与正常对照组比较明显升高,此外患者肿瘤切除术后血浆HMGB1 水平较术前明显降低。这些结果说明NSCLC 患者血浆HMGB1 的升高可能机制是肿瘤细胞表达和释放HMGB1 增加,或肺癌组织中心区域凋亡或坏死细胞分泌HMGB1 增加。当肿瘤细胞分泌HMGB1 时,会进一步促进肿瘤细胞增殖、迁移、侵袭、血管新生和转移[16-17]。NSCLC 患者血浆HMGB1水平升高可以促进病情恶化。检测患者血浆HMGB1水平可作为肺癌筛选和反映病情的指标之一。
本研究发现,NSCLC 患者血浆HMGB1 水平与肿瘤大小、临床分期及有无远处转移有密切关系。随着肿瘤直径的增大、临床分期的增加及远处转移的出现,患者血浆HMGB1 水平明显升高。对于肺癌术后患者,血浆HMGB1 的水平明显下降,结果提示血浆HMGB1 的水平可间接反映肺癌患者体内的肿瘤负荷,同时可作为病情评估和临床疗效评估的重要指标。而对NSCLC 患者不同病理类型血浆HMGB1 水平进行分析发现,腺癌患者和鳞癌患者之间无明显差异,提示血浆HMBG1 水平与NSCLC 病理类型之间并无明显相关性,可能是因为释放HMGB1 的细胞类型并无选择性。本实验中患者血浆HMGB1 水平与NSCLC 临床特征之间的关系与已发现的肺癌组织中HMGB1 的表达与临床特征之间的关系[8]类似。
总之,NSCLC 癌组织中HMGB1 表达高于癌旁组织,NSCLC 患者血浆HMGB1 的水平高于健康人群,术后明显下降,且患者血浆HMGB1 水平与肿瘤大小、临床分期及有无远处转移密切相关。因此,血浆HMGB1 作为一类新型肿瘤生物学标志物,在NSCLC 的诊断、病情和疗效的评估中有应用前景。
