Logistic 回归分析重症急性胰腺炎并发急性呼吸窘迫综合征的危险因素*
2021-07-14沈浩亮崔晓莉
陆 洋,沈浩亮,保 鹏,秦 萌,崔晓莉*
(南通大学附属医院重症医学科,南通 226001)
重症急性胰腺炎(severe acute pancreatitis,SAP)起病急,病情进展迅速且多变,病程长,临床救治难度很大,一直是包括重症医学在内的多学科诊治难点。SAP 病程中有两个死亡高峰,一是早期全身炎症反应剧烈导致多器官功能障碍综合征,约占60%,二是在病程中后期感染及其相关并发症导致的死亡,约占40%[1]。SAP 的病理特点是胰腺组织水肿坏死、胰酶激活破坏脂肪组织、腹腔内大量液体渗出、腹膜后和肠腔内大量液体集聚等,因此早期快速充分的液体治疗对于恢复有效血容量、组织器官的灌注至关重要[2]。然而对包括脓毒症、创伤、胰腺炎、烧伤及术中和术后患者的临床研究发现仅约50%的血流动力学不稳定患者具有容量反应性,不恰当的液体治疗可能会导致并发症的发生,如水肿、急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、循环超负荷等[3]。因此需考虑液体治疗的时机、输液量、输液速度、液体种类及治疗终点。N 端B 型利钠肽前体(N-terminal pro-B type natriuretic peptide,NTproBNP)是心肌细胞受到压力/牵拉刺激后,即心室容积扩张、压力负荷增加时产生,是评估液体负荷、心脏功能、心肌缺血范围及严重程度的灵敏指标。本研究探讨SAP 并发ARDS 的危险因素,以科学地实施SAP 的早期液体治疗。
1 对象与方法
1.1 研究对象 以南通大学附属医院重症医学科(Intensive Care Unit,ICU)2017 年1 月—2019 年12月收治的62 例SAP 患者为研究对象。SAP 的诊断符合《急性胰腺炎诊治指南(2014)》诊断标准[1]。按照是否并发ARDS 分为并发ARDS 组(A 组,32 例)和无ARDS 组(B 组,30 例)。ARDS 的诊断标准符合《急性呼吸窘迫综合征:柏林定义》[4]。排除合并重症肺炎、肺纤维化、急性左心衰、恶性心律失常患者。
1.2 方法
1.2.1 胰腺炎治疗 所有患者接受规范化治疗,主要包括禁食、胃肠减压、抑制胰腺分泌及胰酶活性、早期液体复苏、器官功能支持、镇痛、营养、预防使用抗生素、中药治疗、处理腹腔高压等[1]。
1.2.2 血流动力学监测 所有患者入ICU 后均行颈内静脉或锁骨下静脉及股动脉置管,使用飞利浦监护仪脉搏指示连续心排量监测模块和压力监测套装进行测量,每6 h 进行1 次测量。测量方法:经中心静脉导管“弹丸式”注入冰生理盐水15~20 mL,测量3 次取平均值。
1.2.3 腹内压监测 选择膀胱测压法:将导尿管与三通连接,三通分别接尿袋和压力传感器,测量前先排空膀胱,然后关闭尿袋,向膀胱内注入15~20 mL 生理盐水,测量时监护仪归零,取患者的耻骨联合顶点为零点,于呼气末读取压力数值,测量3 次取平均值。
1.2.4 观察指标 观察两组患者的一般资料、急性生理与慢性健康评分(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)、序贯器官衰竭评分(sequential organ failure assessment,SOFA)、48 h腹内压、48 h 液体输入量、血钙、血淀粉酶、降钙素原、改良CT 严重评分、Murray 肺损伤评分和血清NT-proBNP 浓度等。
1.2.5 统计学方法 采用SPSS 20.0 统计软件进行分析,计量资料以表示,采用t 检验。计数资料以百分比和频数表示,无序计数资料组间比较采用χ2检验,有序计数资料组间比较采用秩和检验。单因素分析及多因素分析采用Logistic 回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两组一般资料的比较 两组年龄、性别、体质量指数(body mass index,BMI)、发病时间、胆石症、高脂血症比例差异均无统计学意义(均P>0.05),见表1。
表1 两组一般资料的比较(n,%,)

表1 两组一般资料的比较(n,%,)
2.2 两组各影响因素的单因素分析 A 组48 h 腹内压、APACHE Ⅱ评分、SOFA 评分、48 h 液体输入量、Murray 肺损伤评分、改良CT 严重评分、血清NT-proBNP 浓度均高于B 组(均P<0.05);两组血钙、血淀粉酶、降钙素原比较差异均无统计学意义(均P>0.05),见表2。
表2 两组各影响因素的单因素分析()
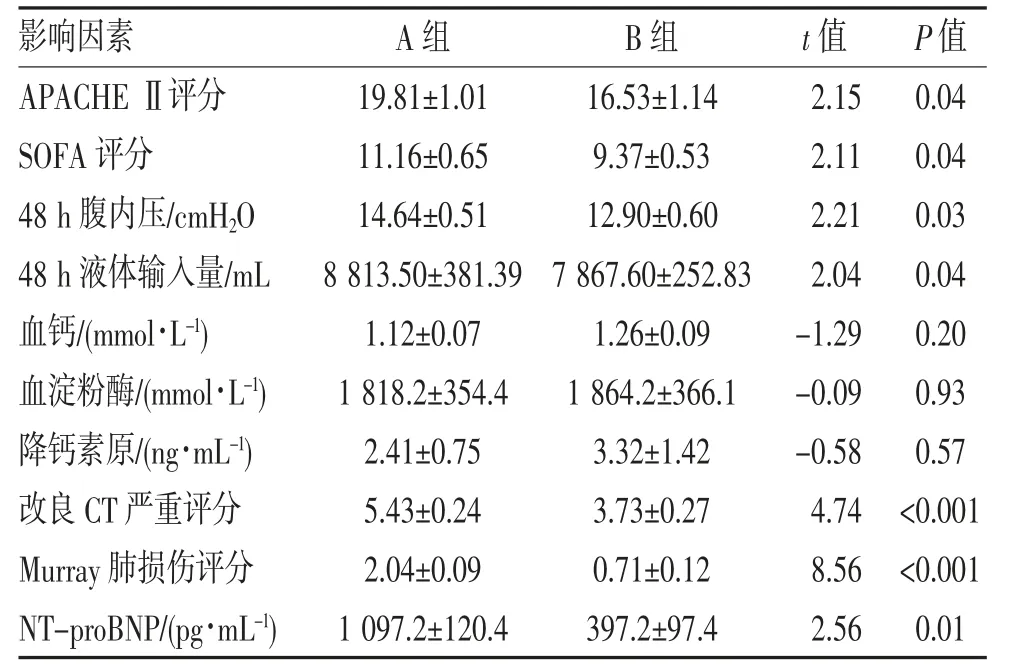
表2 两组各影响因素的单因素分析()
2.3 两组资料多因素分析 两组多因素分析显示48 h 液体输入量、SOFA 评分、APACHE Ⅱ评分、48 h 腹内压、血清NT-proBNP、Murray 肺损伤评分是SAP 并发ARDS的独立危险因素(P<0.05),见表3。

表3 两组资料多因素分析
3 讨 论
SAP 早期胰腺微循环灌注发生改变,导致血流减少、毛细血管渗漏、炎性细胞的聚集和胰腺、胰周水肿及腹腔内液体积聚,有效血容量丢失显著。早期的液体治疗对于纠正容量不足、抗休克、改善组织灌注、防止继发器官衰竭非常重要,也是SAP 的基本治疗措施之一[5]。然而,早期常出现剧烈的全身炎症反应综合征,可累及全身器官,导致多器官功能障碍甚至衰竭,其中心肌细胞也会受到炎症因子、微循环障碍、缺血再灌注等因素的影响而出现损害。研究[6]发现肿瘤坏死因子α 的产生与急性心肌损伤可同时出现,而转化生长因子β 则在随后的时期释放。胰腺炎发生时肾素-血管紧张素系统被激活,并可引起心脏功能的改变[7]。因此,早期液体治疗时关注液体补充量是改善预后的最佳方法,以及有多少液体会导致循环超负荷而产生急性左心衰、肺水肿、腹腔间隔室综合征等并发症。B 型利钠肽(B-type natriuretic peptide,BNP)是心脏分泌的利钠肽家族的一员,主要由心室分泌的利钠肽前体(pro-BNP)裂解而来,同时生成NT-proBNP。NT-proBNP 具有半衰期长,体外稳定性好,样本类型多样等特点,是临床理想的心功能评价标志物[8]。本研究发现SAP 并发ARDS 的患者48 h 腹内压、APACHE Ⅱ评分、SOFA 评分、48 h液体输入量、血清NT-proBNP 浓度要高于无ARDS组。APACHE Ⅱ评分、SOFA 评分高则患者器官功能损害程度更严重,心肺功能损害会导致对液体治疗耐受性的下降。2012 年急性胰腺炎分类标准将收缩压<90 mmHg,且对液体治疗无反应定义为急性胰腺炎诱发的心血管功能衰竭[9]。因此,这类患者在早期进行液体治疗时需谨慎。全身炎症反应综合征时毛细血管渗漏显著,大量的补液会外渗到肺毛细血管外,导致间质水肿,促进ARDS 的发生和发展。J.H.BOYD 等[10]发现适当的液体治疗维持中心静脉压<8 mmHg 会降低感染性休克患者的死亡率,因此液体治疗不必追求较高的中心静脉压,否则会加重呼吸衰竭。NT-proBNP 的释放受心室压力负荷和容量负荷的影响,在调节水钠平衡、血压等方面发挥重要作用。本研究中SAP 并发ARDS 的患者48 h 液体输入量和血清NT-proBNP 浓度较无ARDS 者升高,一方面由于患者病情较重,需要更多的液体来纠正低血容量以维持平均动脉压,另一方面由于患者器官功能损害更重,NT-proBNP 浓度升高反映心功能下降,导致对于液体治疗耐受性下降,更易出现血管外肺水增加引起呼吸衰竭。急性胰腺炎早期心输出量增加,心肌收缩力下降、有效循环容量减少、血管张力降低,表现为低血容量休克和分布性休克的特点,迅速改善血流动力学状态直接与预后相关[11]。但大量输液会造成腹腔高压和腹腔间室综合征,腹腔高压会影响膈肌运动,造成呼吸顺应性下降,从而导致呼吸衰竭[12-13]。本研究SAP 并发ARDS 患者腹内压较无ARDS 组高,反映该组患者由于全身炎症反应、毛细血管渗漏导致大量细胞外液进入细胞内或组织间隙,在早期快速液体复苏后腹膜和内脏进行性水肿,出现腹内压升高,加重呼吸功能障碍。本研究多因素分析显示48 h 液体输入量、SOFA 评分、APACHE Ⅱ评分、48 h 腹内压、血清NT-proBNP、Murray 肺损伤评分为SAP 患者并发ARDS 的独立危险因素。
综上所述,虽然早期液体治疗是SAP 有效的初始支持治疗,但在治疗时需动态评估患者病情的变化,对于存在高危因素患者补液需谨慎,严密监测腹内压、血清NT-proBNP,及时调整液体治疗和器官支持治疗,避免加重呼吸系统损伤。本研究尚有不足:(1)本研究为回顾性研究,一些协变量的数据不完整;(2)数据样本量较小,需增加样本量。本研究仅能证实关联性,需进一步前瞻性研究证实结果的因果关系。
