新型肿瘤靶标环状RNA的研究进展
2021-07-12方梦蝶张衍梅
徐 昊,方梦蝶,李 超,刘 宸,任 娟,张衍梅
浙江省医学科学院杭州医学院分子医学中心,杭州 310013
环状RNA(circular RNA,circRNA)是共价连续的闭合环状体,不具有5’和3’端,这使其结构比线性RNA更加稳定,不易被核酸外切酶降解[1]。起初circRNA被认为是错误剪接的产物[2],或从内含子的套索结构中逃逸的中间产物。随着转录组测序技术(RNA-seq)的广泛应用,众多研究发现circRNA是一类内生的、数量众多的、稳定存在于哺乳动物细胞中的分子,具有一定的组织、时序和疾病特性[3],不再被认为是一类在人体中无作用的RNA分子[4]。circRNA存在于哺乳动物细胞中,正常人体中有超过400种circRNA,其表达异常可诱导肿瘤发生[5-6]。circRNA具有miRNA海绵功能,富含miRNA结合位点,可以解除miRNA对靶基因的抑制作用,进而升高靶基因表达水平,在转录水平上对靶基因进行调控,被称为竞争性内源RNA(competing endogenous RNA,ceRNA)机制[7]。例如乳腺癌中的hsa_circ_0072309(circBase数据库中的ID号)通过miRNA海绵功能调控miR-492,影响乳腺癌发生[8]。circRNA因其特性和生物学功能被认为是一种新型潜在肿瘤标志物,Zeng等[9]研究发现,circRNA作为结直肠癌潜在肿瘤标志物具有较高的诊断价值,circHIPK3是结直肠癌诊断和预后的潜在肿瘤靶标。本文总结了近年来circRNA在癌症中的研究进展,包括circRNA的发生机制、功能、数据库内容和研究方法,以及在肿瘤中的应用研究。
circRNA发生机制
Sanger等[2]于1976年发现了一些单链共价闭合的植物病毒,为circRNA研究奠定了基础,此后越来越多的circRNA逐渐被人们发现[10-12]。1个基因可以产生多种不同的circRNA,甚至有些circRNA的表达量高于其对应的母基因线性RNA。大多数circRNA是由外显子形成的,也有少数是以内含子或外显子-内含子的形式成环的,成环的机制主要是反向剪接[13]。circRNA的种类包括:仅外显子来源的circRNA;上下游外显子反向剪接且保留内含子的外显子-内含子circRNA;以及仅内含子来源的circRNA[4]。大多数circRNA是外显子来源的,且由1个或多个外显子构成,并且反向剪接最小需要1个外显子的长度。有研究显示,在高表达的circRNA中,单外显子circRNA的外显子比多外显子circRNA的外显子长的多[14]。各种来源的circRNA主要由反向剪接形成,在形成过程中也会受到顺式和反式调控[15]。
circRNA形成的剪接方式导致circRNA形成的拼接位点大多为经典的适用于mRNA可变剪切的位点。已有研究利用circRNA表达载体中的突变分析,以及利用剪接抑制剂处理后阻断剪接体装配,表明circRNA的生物发生依赖于经典的剪接机制[16-17]。当mRNA前体加工事件变慢,新生的RNA会被导向另外一条路,即促进反向剪接,导致circRNA形成[18]。一部分circRNA来自编码或非编码基因,可通过外显子跳跃等方式进行剪接,且受到细胞类型特异性调控[19];另一部分circRNA通过内含子保留的方式形成外显子-内含子circRNA。内含子保留是低等真核生物和人类基因中常见的选择性剪接调控形式,最近被发现是一种普遍且受调控的现象[20-22]。线性转录本的内含子保留是由多细胞生物剪接机制产生的,所以有些circRNA中同样保留内含子。RNA-seq技术和Northern杂交等证据表明,circRNA受到细胞类型的特异性调控[19]。
circRNA的形成还依赖于一些非经典的剪接信号[23]。内含子circRNA是套索驱动环化形成的,经过外显子跳跃后形成套索中间体,依赖于5’端剪接位点的GU和C碱基富集基序,经过聚合酶Ⅱ的转录和磷酸二酯键共价连接而环化,3’端的多余序列被降解,最终形成成熟的circRNA[24]。
circRNA形成的顺式和反式调控
顺式调控:circRNA的形成过程中,位于上游和下游内含子中的反向重复元件之间的碱基配对介导下游剪接供体位点和上游剪接受体位点侧翼的内含子序列接近和环化[16,25]。在小鼠的Y染色体性别决定区(sex-determining region of Y-chromosome,sry)研究中发现,circRNA的形成由顺式作用元件调控,受到circRNA两侧的反向重复序列调控[26]。含有互补性Alu重复序列的Alu元件介导外显子环化[7]。此外,在线虫和人中都发现circRNA的侧翼内含子上富集反向互补配对序列(reverse complementary matches,RCMs)[27]。因此参与circRNA环化的剪接位点侧翼内含子中特定的顺式作用元件调控circRNA的形成。有研究表明,小于100 nt的微型内含子只要含有30 nt及以上的反向互补重复序列,就可以促进外显子环化[28]。circRNA侧翼内含子富含RCMs、内含子互补序列(intronic complementary sequences,ICSs)及Alu元件,这些元件对circRNA的环化有促进作用[29-30]。其中Alu元件是驱动circRNA成环的重要基础,也是预测和分析circRNA的重要元件[31]。
反式调控:然而仅顺式作用元件不足以解释circ-RNA复杂的形成机制,RNA结合蛋白(RNA binding protein,RBP)可结合内含子侧翼序列上的顺式作用元件调控circRNA形成。例如:果蝇中虫漆酶2(laccase2,lcc2)基因来源的circRNA受到异质性胞核核糖核蛋白(heterogeneous nuclear ribonucleoprotein,hnRNP)以及SR蛋白(serine/arginine-rich protein,SRp)的共同调节,提示外显子的环化效率可能受多种蛋白调控[32]。有研究者提出,震颤蛋白(quaking,QKI)作为RNA结合蛋白,在上皮细胞-间充质转化过程中能够结合到侧翼内含子特定的结构域上,促进外显子环化[33]。RNA特异性腺苷脱氨酶(adenosine deaminase acting on RNA,ADAR)是双链RBP,可使腺苷脱氨而编辑RNA,研究发现敲低ADAR1可显著上调circRNA的表达,同时发现侧翼内含子上的ICS以竞争性结合方式介导外显子环化[27]。然而,目前少有研究证明反式作用因子与前体mRNA直接产生相互作用[34]。
circRNA的生物学功能
circRNA功能多样,由于其富含miRNA结合位点,因此常被发现具有miRNA海绵功能。此外circRNA亦有调控母基因表达,调控母基因选择性剪接,翻译蛋白的功能。
miRNA海绵功能通过miRNA应答元件,非编码RNA和编码RNA在转录组中形成了大规模的调控网络,miRNA是基因表达的负调节因子,降低靶基因的稳定性或限制其翻译功能[35]。circRNA富含miRNA结合位点,竞争性抑制miRNA的转录调控,是一类新的表达量高、稳定性强的ceRNA[36]。circSRY和CDR1as(ciRS-7)是最先被证明具有miRNA海绵功能的circRNA,与miRNA结合而不被降解使其成为有效的ceRNA分子[37-39]。circSRY上有16个miR-138的结合位点,当miR-138过表达时,circSRY可以与真核翻译起始因子2C2(argonaute 2,AGO2)共沉淀,而当circSRY过表达时,miR-138的作用减弱[40-42];同样地,ciRS-7上含有70个以上的miR-7结合位点,AGO免疫沉淀结合实时荧光定量PCR(quantitative real-time PCR,qPCR)结果分析证明,ciRS-7可与miR-7相互作用,进而抑制miR-7的活性,导致靶基因表达水平上调,其原因与ciRS-7捕获了胞质中大量miR-7有关[12,40,43]。
(5)预裂爆破、梯段爆破和特殊部位的爆破,其参数和装药量应遵守DL/T5389-2007《水工建筑物岩石基础开挖工程施工技术规范》第8章规定的要求。
调控母基因表达circRNA可与RNA相互作用参与转录后调控。circRNA形成过程中,内含子间竞争性互补配对与线性RNA之间保持平衡,从而影响mRNA的表达与翻译。Zhang等[24]研究发现,当敲低ci-ankrd52等内含子来源的circRNA时,其对应的母基因表达也显著降低,说明circRNA对于其母基因的表达有顺式作用。此外,Lu等[44]通过过表达水稻中circRNA发现对应母基因的表达减少,证明circRNA与其线性转录本可能是母基因转录后表达的负调控因子。
通过RNA聚合酶Ⅱ和表观遗传修饰调控母基因。某些来源于内含子的circRNA主要定位于细胞核中,能够与RNA聚合酶Ⅱ相互作用促进自身编码基因转录[1]。circRNA还能通过表观遗传修饰来调控母基因的表达。N6-甲基腺苷(N6-methyladenosine,m6A)修饰普遍存在于高等生物mRNA和长链非编码RNA(long non-coding RNA,lncRNA)上,近来发现某些circRNA也存在m6A修饰,该circRNA会影响母基因的稳定性[45]。由此可见,circRNA可被用于调控疾病相关母基因的转录,进而影响母系基因及其靶基因的表达,为相应疾病的治疗提供新思路。
与RNA结合蛋白相互作用circRNA可以通过与RBP结合,进而改变剪接模式或RNA的稳定性。人类盲肌蛋白(muscleblind,MBL)是人类盲肌样蛋白1(muscleblind-like 1,MBNL1)的同源物,MBL促进circMbl的生成,circMbl上存在特异的MBL结合位点,且circMbl与MBL蛋白有强烈的直接相互作用[25]。circMbl可以调节MBL蛋白水平,当MBL过量时,它通过促进circMbl产生来降低自身mRNA产量。circMbl也可以通过结合MBL来消除多余的MBL[16]。circRNA通过与相关蛋白结合,可以促进DNA、RNA、RBP间的相互作用,发挥生物学功能[46]。
调节选择性剪接circRNA通常来源于蛋白质编码基因中的外显子,所以circRNA形成对前体mRNA的可变剪接能够产生调控作用[7]。Ashwal-Fluss等[16]研究发现,circMbl是由剪接因子MBL基因的第2个外显子产生,它自身成环的剪接与普通的pre-mRNA剪接竞争,MBL蛋白水平调节显著影响了circMbl形成,MBL通过调节circRNA的生物发生,对经典剪接和选择性剪接之间的平衡产生影响。外显子跳跃是pre-mRNA最常见的选择性剪接事件,理论上来说circRNA形成与线性mRNA的外显子跳跃事件呈正相关[47]。这表明circRNA的生物发生对相应线性mRNA产生经典剪接和选择性剪接有着重要作用。
蛋白翻译通常circRNA是不能被翻译的,但随着研究深入,发现一些circRNA的外显子序列可以被翻译成蛋白质。有些circRNA包含内部核糖体进入位点(internal ribosome entry site,IRES)序列,并能直接与核糖体结合,可以在真核细胞中翻译[48]。真核核糖体的40S亚基与circRNA结合,可直接启动翻译[49]。在具有开放阅读框(open reading frame,ORF)的大肠杆菌无细胞翻译系统中,circRNA也可以有效翻译[50]。也有研究表明,真核内源性circRNA可通过m6A甲基化来驱动蛋白质翻译[51]。
circRNA相关数据库
常用的circRNA数据库包括circBase、CSCD、circInteractome和circFunBase等。这些不同的数据库涵盖不同物种中circRNA的信息(表1),包括circRNA对应的染色体区域上重复元件、亚细胞定位、可否翻译、RBP以及miRNA之间的调控和相互作用、与人类疾病或性状的相关性等。
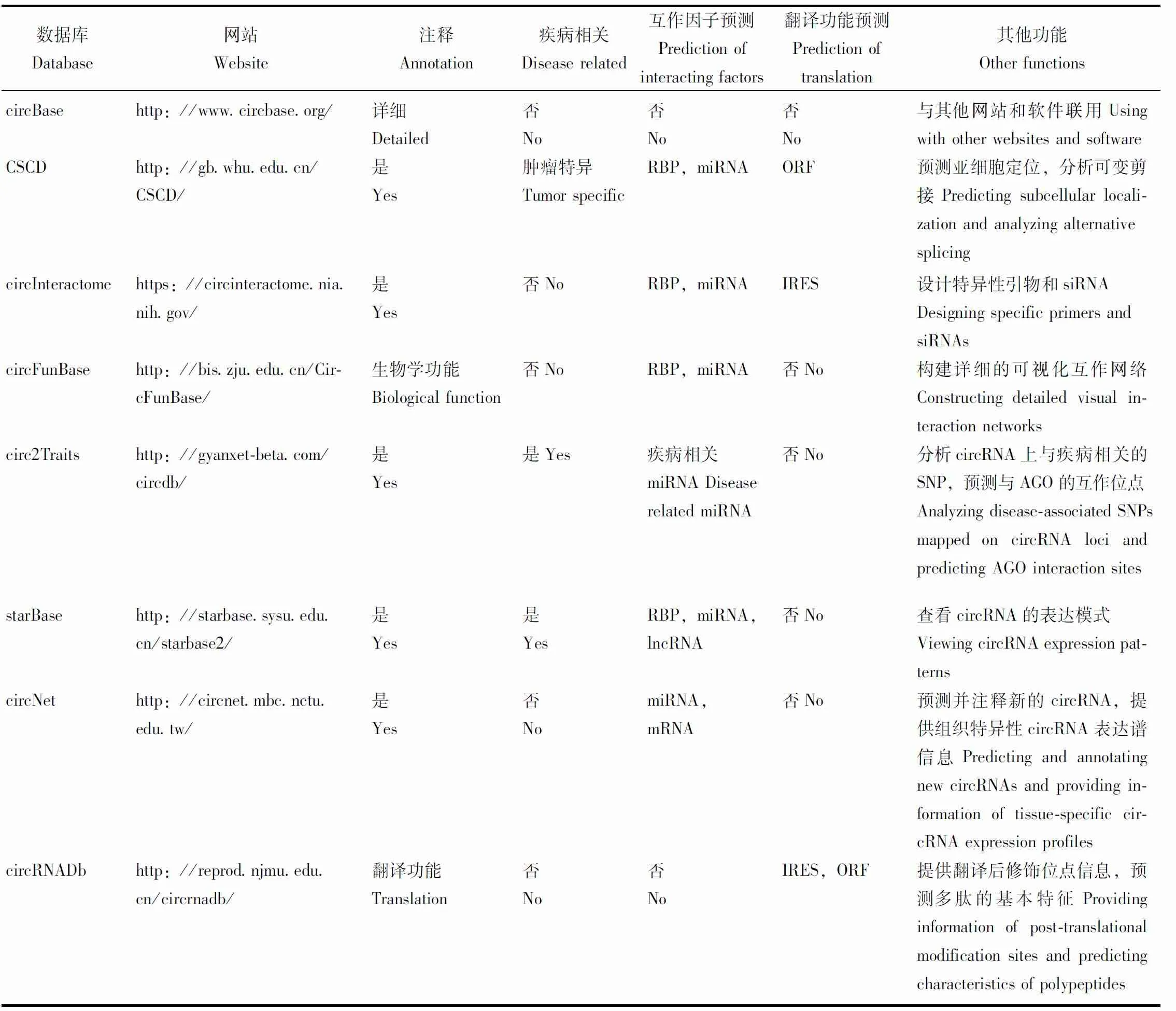
表1 circRNA数据库比较Table 1 Comparison of databases for circRNA
CSCDCSCD是癌症特异circRNA的数据库,从ENCODE中收集了肿瘤组织和正常组织细胞系的circRNA数据。该数据库可以预测circRNA上的miRNA反应元件位点以及RBP的结合位点,circRNA的亚细胞定位,以及潜在的ORF,用来研究可翻译circRNA。该数据库可以提供线性剪接和反向剪接之间的比较信息,预测circRNA线性转录本的剪接事件[53]。
circInteractomecircInteractome数据库主要用于研究circRNA与RBP以及miRNA之间的调控和相互作用。该数据库集合了目前已知的RBP,分析它们与circRNA的结合位点,还利用软件对circRNA和miRNA的潜在结合位点进行预测。此外,该数据库还能设计circRNA的qPCR引物,也可以查询沉默circRNA的siRNA序列,帮助研究者设计siRNA[54]。
circFunBasecircFunBase数据库记录了从PubMed中收集整合所得的7000多个功能性circRNA,主要包括人、鼠等。该数据库可以提供可视化的circRNA-miRNA交互网络,以及circRNA的基因组背景。该数据库中对于circRNA的注释较为全面,包括了位置、组织、表达模式、功能、基因描述等,对于人源的circRNA还提供了互作miRNA和RBP[55]。
其他常用circRNA数据库circ2Traits对miRNA与circRNA、lncRNA和人类蛋白质编码基因进行互作网络的构建,还对circRNA的单核苷酸多态性(single nucleotide polymorphism,SNP)位点进行定位与分析[56]。starBase数据库通过分析已发表的circRNA数据,构建miRNA-circRNA以及circRNA-RBP的互作网络,还展示了RBP与体细胞突变之间的潜在联系[57]。利用通过RNA-seq得到的测序数据,circNet对circRNA进行预测,并对其基因组进行注释,该数据库构建了circRNA-miRNA-gene的ceRNA调控网络,且对circRNA在不同组织中的表达量进行了注释[58]。circRNADb数据库收录了人类circRNA,只包含外显子反向剪接后产生的circRNA,除了染色体位置、序列等基本信息外,还注释了蛋白编码潜能等信息[59]。
circRNA的主要研究方法
qPCR检测circRNA的表达对circRNA进行qPCR可以对circRNA进行鉴定和表达差异分析,是高通量测序筛选后验证的必要步骤。对circRNA进行qPCR需要提取样本RNA并使用RNase R处理以富集circRNA,随后利用随机引物进行反转录,并利用GAPDH作为内参进行定量分析。采用PCR产物的琼脂糖凝胶电泳和Sanger测序进一步鉴定circRNA序列,根据扩增曲线、溶解曲线等参数进行circRNA的表达量分析[60]。circRNA进行qPCR检测需要两对引物:Divergent primer和Convergent primer。Divergent primer扩增和跨越circRNA的拼接位点,即便在相应线性RNA存在的情况下,也能特异性检测circRNA。Divergent primer扩增产物的长度不宜过长,短的扩增子将会增强拼接位点处的扩增效率[61]。Convergent primer用来验证成环方向,且可检测母基因的表达量。
荧光原位杂交检测circRNA的亚细胞定位circRNA在亚细胞定位上呈现多样化,细胞核、细胞质和细胞器中均有circRNA的分布,甚至某些circRNA具有独特的亚细胞定位,可能是全新的亚细胞构成。circRNA细胞定位是决定其调控机制的关键。如果该circRNA主要定位于细胞质,则可能为ceRNA。运用荧光原位杂交技术(fluorescenceinsituhybridization,FISH)对目标circRNA进行定位,以便于后续功能的进一步研究,需要注意的是设计的杂交探针需要跨越环化的拼接位点[62]。
circRNA过表达过表达通常用于研究某个基因表达量增高后的生物学效应。基于circRNA的成环机制大多与成环外显子两侧的内含子侧翼序列中的重复元件有关(如Alu元件)。circRNA过表达可通过克隆包括Alu元件或反向互补配对序列的circRNA序列至真核表达载体,通过转染真核细胞提高circRNA的表达量。对载体的改造包括添加GFP绿色荧光蛋白标记或抗性标记,也可满足不同的实验需求[63]。
pull-down技术检测circRNA互作因子研究circRNA的互作因子是探究其功能的重要方向,circRNA主要与miRNA或蛋白产生相互作用。利用与circRNA剪接位置互补的生物素标记探针,对circRNA结合的分子复合物进行捕获。利用qPCR或者高通量测序鉴定结合的miRNA分子,而结合的蛋白则用Western杂交进行分析。circRNA pull-down技术有利于鉴定circRNA的互作因子,验证其miRNA海绵功能等生物学功能[64]。
其他生物学方法Northern杂交可依次对总RNA、基因组DNA和已经消化掉DNA、核糖体RNA、线性RNA的总RNA进行杂交,验证circRNA的序列[65]。荧光素酶报告系统载体和带有GFP标记蛋白的载体等,可用于验证circRNA的剪接、miRNA海绵和翻译的功能。在验证翻译型circRNA时,也可通过加入相应的标签验证circRNA肽和蛋白或RNA之间的互作关系。此外,也可以通过设计siRNA来敲低目的circRNA,用于验证circRNA的部分生物学功能。
circRNA的应用研究
circRNA因其环化结构具有较高的稳定性,在各种组织和体液中含量丰富,且被发现与乳腺癌、前列腺癌、肺癌、胃癌和肝癌等发生有关[66]。丰富的circRNA表达谱以及其高稳定性使得circRNA可能开发为疾病监测的标志物。此外也有研究发现,circRNA表达改变影响肿瘤发生进程[67-68],因此circRNA有可能成为肿瘤治疗的靶点。
前列腺癌2018年Xia等[69]通过SBC-ceRNA芯片对4对前列腺肿瘤和癌旁组织中差异表达的circRNA进行了筛选,发现了1021个差异表达的circRNA,采用qPCR验证确定了hsa_circ_0057558和hsa_circ_0062019的表达。此外他们还发现这两个circRNA调控miR-5008的表达,且hsa_circ_0057558、hsa_circ_0062019及其母基因均为前列腺癌的潜在生物标志物。
circABCC4在前列腺癌的肿瘤组织和细胞系中显著上调,并通过吸附调控miR-1182促进叉头蛋白4(forkhead box P4,FOXP4)在前列腺癌细胞中的表达。沉默circABCC4能够显著抑制前列腺癌细胞的增殖、细胞周期进展、迁移和侵袭。体内实验也验证了circABCC4的沉默延缓肿瘤的生长。研究结果支持circABCC4通过miRNA海绵功能促进FOXP4的表达,从而促进前列腺癌的恶性行为[70]。在此研究基础上有望开发依据circABCC4-miR-1182-FOXP4调控回路的干预前列腺癌的方法。
乳腺癌circUBAP2在三阴性乳腺癌中被显著上调。circUBAP2的高表达与肿瘤增大、淋巴结转移和不良预后等密切相关。circUBAP2主要定位于细胞质,吸附miR-661上调转移相关蛋白1(metastasis-associated protein 1,MTA1)的表达。通过沉默miRNA-661或过表达MTA1可逆转由circUBAP2干扰引起的恶性肿瘤发生。该研究表明circUBAP2通过调控miR-661/MTA1影响三阴性乳腺癌的发生发展,可作为三阴性乳腺癌的治疗靶点[71]。
另一个潜在的三阴性乳腺癌治疗靶点是circKIF4A。circKIF4A表达上调与三阴性乳腺癌进展相关,circKIF4A能吸附miR-375,抑制驱动蛋白4A(kinesin family member 4A,KIF4A)的表达以减缓三阴性乳腺癌细胞的转移和扩散,circKIF4A是三阴性乳腺癌的潜在预后生物标记物和治疗靶点[72]。
肺癌Yao等[73]研究发现,circRNA_100876在非小细胞肺癌组织中表达上调,circRNA_100876高表达的非小细胞肺癌患者总生存时间明显低于低表达患者,其表达与肿瘤分期和淋巴结转移有关。因此,circRNA_100876可能是非小细胞肺癌一个新的预后标志物和诊断治疗靶点,对指导非小细胞肺癌患者的临床治疗非常有帮助。
Hsa_circRNA_103809/miR-4302/ZNF121/MYC是一种在肺癌中起作用的新型通路,hsa_circRNA_103809在肺癌组织中高表达。通过敲除该circRNA分子能够显著抑制肺癌细胞的体外增殖和侵袭,延缓肿瘤的体内生长。Hsa_circRNA_103809作为miR-4302的海绵,靶向并促进锌指蛋白121(zinc finger protein 121,ZNF121)的表达,可以作为肺癌患者的预后标志物[74]。
胃癌Zhang等[75]研究了circRNA_100269及其下游miRNA靶点的表达情况,结果发现circRNA_100269在胃癌组织中表达下调,所对应的miR-630表达上调,证明它们之间产生互作,circRNA_100269能够抑制胃癌细胞的增殖。这些结果揭示了一种新的参与胃癌细胞生长的信号通路,有望成为肿瘤诊断标记物。
Hsa_circ_0003159在胃癌组织中表达下调,其表达水平与胃癌患者主要临床病理因素有关。hsa_circ_0003159在胃癌中的低表达与远端转移和TNM分期有显著关系,在胃癌诊断中具有潜在价值[76]。
肝癌circMTO1是一个在肝癌组织中显著下调的circRNA,且circMTO1低表达的肝癌患者生存期缩短,肝癌细胞中circMTO1的沉默可以下调癌基因miR-9的靶点p21,促进肝癌细胞的增殖和侵袭,且miR-9抑制剂可阻断circMTO1沉默对肿瘤的促进作用。因此circMTO1可能是肝癌治疗的潜在靶点,肝癌组织中circMTO1的降低也可作为预后不良的预测指标[77]。
Qin等[78]研究发现,hsa_circ_0001649在肝癌组织中的表达显著下调,其表达水平与肿瘤大小有关。当hsa_circ_0001649被敲除后,对促进肝癌转移起关键作用的基质金属蛋白酶9(matrix metalloproteinase,MMP)9、MMP10和MMP13的mRNA水平显著升高,hsa_circ_0001649可能在肝癌的转移中起作用。研究结果进一步表明,hsa_circ_0001649可能作为一种新的肝癌生物标记物,具有较高的准确性、特异性和敏感性。
展 望
circRNA稳定性高、表达丰富、功能多样,近年来开始引起研究者的关注,但目前对于circRNA的研究处于起始阶段。近年来对于circRNA的研究主要集中在其miRNA海绵功能上,研究者通过荧光素酶报告系统对circRNA与miRNA的结合位点进行验证,利用生物素标记的探针进行pull-down实验以捕获miRNA,AGO2免疫共沉淀也可以进一步研究miRNA调节靶点,circRNA和miRNA在细胞中的共定位可以利用FISH技术来验证,目前这些成熟的实验技术证明了circRNA的miRNA海绵功能,使整个ceRNA网络更加完整和复杂。
现在对于circRNA生成机制的研究也越来越多,RBP除了可以与circRNA结合降低RBP对靶基因的调控,影响肿瘤的发生[79],部分RBP还能够调控circRNA的生成,对于肿瘤的发展也产生了重要作用[80]。但现在对于能够直接揭示circRNA与蛋白质互作机制的实验技术还十分有限,需要进一步探索。circRNA的翻译功能也逐渐成为了热点,circRNA的翻译起始机制主要有帽子依赖的、IRES依赖的、m6A依赖的和小ORF(small ORF,sORF)依赖的翻译起始[81],circRNA编码的蛋白具有抑制肿瘤活性、保护蛋白不受降解等功能[82]。综上,circRNA和蛋白之间的互作以及它的翻译功能对于肿瘤的研究有着重要意义,未来应对这方面进行更深入的研究。
circRNA稳定性高,在各种组织和体液中广泛表达,因此可作为潜在的诊断和预后的生物标志物。研究表明circRNA在外泌体中含量丰富且稳定,有些circRNA在血液中的表达量比组织中更高[83],circRNA在体液中的高表达及高稳定性将更有利于其临床应用。然而尽管RNA-seq鉴定出数千种组织和疾病特异的circRNA,但现阶段对于circRNA的生成机制和生物学功能的认识还十分有限。
