甲状腺微小乳头状癌射频消融术后转归的Nomogram预测模型构建
2021-07-09何红莹罗渝昆赵佳航
何红莹,罗渝昆,张 艳,宋 青,李 文,赵佳航,李 怡
1南开大学医学院影像医学与核医学专业,天津 300071 2中国人民解放军总医院第一医学中心超声诊断科,北京 100853
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺恶性肿瘤中最常见但预后较好的一种亚型,约占全部甲状腺癌的90%,近年来其发病率的增长速度受到全世界关注。外科手术目前仍是PTC患者首选的治疗方法[1-3],但随着微创技术的成熟和发展,对于低复发风险且不适合或拒绝手术的甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)患者来说,射频消融(radiofrequency ablation,RFA)是一种近年来备受关注的替代治疗方法,具有较好的有效性和安全性[4-6]。虽然与传统手术相比,RFA引起的并发症少,可实现重复治疗,但其在PTMC治疗中的应用仍存在一些争议性的问题。例如,有些患者术后较长时间内肿瘤消融灶未消失,而如何准确评估PTMC患者RFA术后消融灶的转归目前还鲜见报道。本研究旨在联合患者临床特点及RFA相关参数,构建预测PTMC患者RFA术后短期(1年)消融灶转归的量化模型,为临床准确评估RFA短期疗效及对患者进行术后恢复情况予以解释提供依据。
资料和方法
资料来源2018年1月1日至12月31日间在中国人民解放军总医院第一医学中心确诊为PTMC并于超声科行RFA治疗的159例患者的临床资料。纳入标准:(1)超声引导下粗针穿刺活检(core needle biopsy,CNB)为经典型PTC;(2)肿瘤最大径≤1 cm;(3)影像学示无甲状腺被膜及腺外侵犯;(4)影像学无淋巴结及远处转移;(5)术前未接受其他治疗;(6)年龄>18岁;(7)拒绝外科手术,自愿签署RFA术前知情同意书。排除标准:(1)凝血功能异常;(2)活检结果证实为PTC侵袭性亚型(高细胞亚型、柱状细胞亚型、低分化型等);(3)治疗依从性差无法配合;(4)随访时间小于12个月。本研究经中国人民解放军总医院医学伦理委员会批准(S2020-237-01),患者及家属RFA术前均签署穿刺和消融知情同意书。
RFA术前评估所有患者RFA术前均进行了常规超声及超声造影(contrast-enhanced ultrasonography,CEUS)检查,血常规、凝血等实验室检验及CNB。使用的超声仪器为西门子512(7 MHz)(德国)、西门子S2000(8 MHz)(德国)、飞利浦IU22(7-12 MHz)(荷兰)。收集患者的临床资料,包括性别、年龄和超声征象[主要有肿瘤大小(3个维度的径长)、位置分布(左叶、右叶和峡部)、纵横比、肿瘤成分(囊实性)、钙化大小(最大径)和血流分级(采用Alder分级标准)]。
RFA治疗过程由同一位经验丰富(甲状腺诊断和治疗临床工作经验>20年)的超声医师对所有患者行RFA手术,以排除不同操作者引起的偏倚。采用的超声仪器为西门子512(7 MHz),射频仪为Celon AG(德国Olympus),射频针为双极100-T5。患者取仰卧位,肩下垫一靠枕以便充分暴露颈部手术区域。RFA前首先再次评估血管分布,喉返神经、气管、食道和肿瘤之间的关系,以确定最佳进针路线。用1%盐酸利多卡因进行皮下及甲状腺前囊局部麻醉。若消融目标与上述重要组织和器官间距离较小(<5 mm),可用生理盐水进行适当“水隔离”形成安全隔离带。采用“移动消融术”技术从肿瘤最深处开始消融治疗,输出功率3~6 W,超声实时监测消融区域高回声带产生情况,确保肿瘤区域的完全消融。当强回声完全覆盖并超出肿瘤边界3 mm方可停止消融,并立即行CEUS检查以再次确认肿瘤区域无肿瘤残留。
随访消融后1~2 h内密切观察患者的生命体征及有无并发症发生。术后1、3、6、12个月通过随访对患者的临床治疗效果进行评估。主要通过超声检查患者消融灶的变化情况,用肿瘤缩小率(volume reduction rate,VRR)=[(肿瘤术前体积-随访体积)/术前体积]×100% 进行定量评估[7-8]。
统计学处理采用SPSS 22.0和R统计软件,符合正态分布的计量资料以均数±标准差比较,组间比较采用t检验;定性资料的组间比较采用卡方检验。将各因素赋值后先通过单因素分析筛选出有差异的因素,P<0.2认为差异有统计意义;再将有差异的因素进行多因素Logistic回归模型进行多因素分析,构建Logistic回归模型。将筛选出来的各独立因素引入R软件,用rms包lrm函数构建二元Logistic回归,建立Nomogram图预测模型,采用受试者工作特征曲线(receiver operating characteristic curve,ROC)pROC包绘制对该模型进行验证,P<0.05为差异有统计学意义。
结 果
一般情况159例患者中,男35例,女124例,平均年龄(43.8±10.2)岁(22~68岁);111例在RFA术后12个月内肿瘤完全消失,48例未完全消失,两组患者仅在性别(χ2=5.37,P=0.02)方面差异有统计学意义(表1)。

表1 临床基本特征Table 1 Clinical Characteristics
多因素分析结果RFA术后12个月肿瘤完全消失组和未消失组在性别(OR=3.751,95%CI:1.363~12.485,P=0.017)、年龄(OR=1.038,95%CI:1.001~1.078,P=0.047)和钙化灶大小(OR=1.700,95%CI:1.006~2.929,P=0.049)方面差异有统计学意义;在肿瘤大小(OR=4.767,95%CI:0.368~62.192,P=0.229)和RFA能量(OR=1.748,95%CI:0.501~6.761,P=0.397)方面差异无统计学意义。老年女性患者在RFA术后12个月内肿瘤未完全消失的风险相对较大。
Nomogram图预测模型的建立及验证结果将训练集PTMC患者所有资料均纳入Logistic回归分析,筛选最优模型,最终纳入性别、年龄、肿瘤最大径、钙化灶大小及RFA能量建立预测PTMC患者RFA术后12个月内消融灶存在状态的Nomogram图模型。各影响因素在Nomogram图对应的评分依次相加,对应的总分即影响患者RFA术后12个月肿瘤状态的风险(图1)。Nomogram图模型预测PTMC患者RFA术后12个月肿瘤未完全消失风险的曲线下面积(area under the curve,AUC)为0.762,其最佳阈值点是0.223,具有较好的区分度,预示该预测模型准确可靠(图2)。将验证集48例患者参数代入模型,计算RFA术后12个月肿瘤未完全消失风险的AUC为0.740,其最佳阈值点是0.247(图3)。
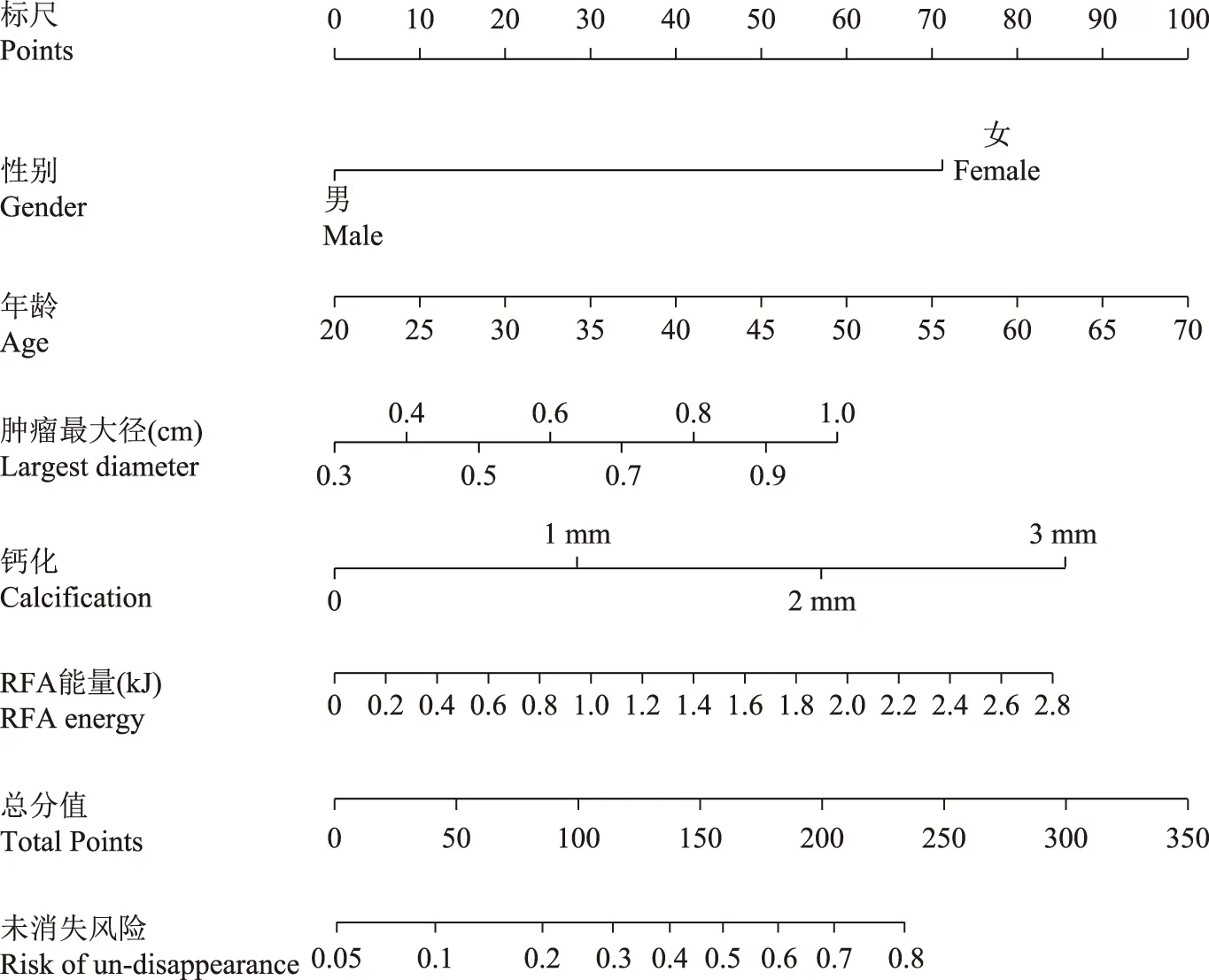
RFA:射频消融;PTMC:甲状腺微小乳头状癌;每个变量对应列线图上相应的变量轴,每个轴点对应该变量在标尺上的评分,各评分之和对应的风险值评分为该患者在RFA术后12个月内肿瘤未消失的发生风险RFA:radiofrequency ablation;PTMC:papillary thyroid microcarcinoma;each variable corresponds to the corresponding variable axis on the nomogram;each axis point corresponds to the points on the scale;the total points of each score correspond to the risk points of the tumor un-disappeared 12 months after RFA图1 预测PTMC患者RFA术后12个月肿瘤状态的Nomogram图模型Fig 1 Nomogram predicts tumor status in PTMC patients 12 months after RFA

TP:真阳性;FP:假阳性;ROC:受试者工作特征曲线;横坐标代表预测PTMC患者RFA术后12个月肿瘤消失的概率,纵坐标表示实际概率TP:true positive;FP:false positive;ROC:receiver operating characteristic curve;abscissa is the predicted probability of tumor status in PTC patients 12 months after RFA,and the ordinate is the actual probability图2 训练集Nomogram图模型预测PTMC患者RFA术后12个月肿瘤状态的ROC曲线Fig 2 ROC plot of nomogram in the training cohort for predicting tumor status in PTMC patients 12 months after RFA
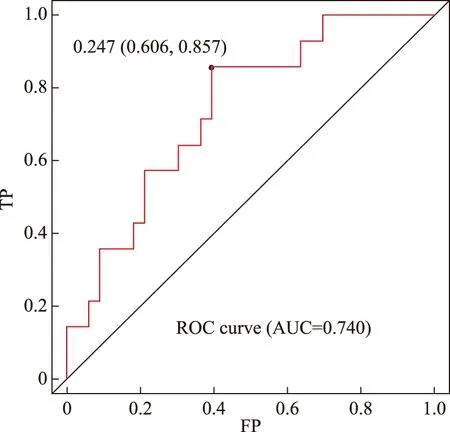
图3 验证集Nomogram图模型预测PTMC患者RFA术后12个月肿瘤状态的ROC曲线Fig 3 ROC plot of nomogram in the validation cohort for predicting tumor status in PTMC patients 12 months after RFA
讨 论
随着近年来全球范围内分化型甲状腺癌(differentiated thyroid carcinoma,DTC)患病率和检出率的提高,甲状腺癌的治疗也越来越精准和倍受关注。目前为止,外科手术切除仍然是PTC患者的首选治疗方法。但是,由于PTC生长缓慢,过度诊断和治疗的现象日益增加[9-11]。美国甲状腺协会2015 指南中提出可对低复发风险的PTMC者进行动态积极监测。然而,积极监测的适应证和禁忌证目前还尚未明确[12]。此外,在对接受积极监测PTMC患者的随访中有研究者发现,几乎近一半的患者经常出现焦虑担心肿瘤发生进展[13]。
热消融作为一种同外科手术几乎具有相同治疗效果的新方法,已成为PTMC患者的替代治疗选择,尤其针对不愿或不允许行外科手术的患者[14]。RFA技术通过射频波使离子和大分子物质发生剧烈的碰撞产生热能,局部组织温度升高,进而使肿瘤组织发生凝固性坏死[15],具有微创、安全、有效等优势[7]。PTMC患者RFA术后有效性评价指标为VRR。Choi等[7]对728个PTMC的热消融治疗疗效研究的分析结果显示,VRR最终能够达到99.2%,有415(57%)个肿瘤完全消失,而近乎一半的患者在术后一定的随访期内呈现一个带“瘤”状态。但是目前还鲜有文章探讨影响RFA术后肿瘤存在状态的相关因素。
本研究将接受RFA的PTMC患者按照术后12个月消融灶存在与否分为两组,结果发现性别、年龄、肿瘤最大径、钙化灶的大小和RFA能量是影响12个月内肿瘤消失与否的重要因素。老年女性、肿瘤越大、内含钙化灶越大、RFA消耗能量越多的患者,消融灶在术后12个月内消失的几率就越低。其中能量因素在Trimboli等[16]研究中得到证实,其研究结果显示,在RFA所消耗的参数中仅能量与消融灶VRR具有显著相关性,并且这种相关性仅在小于10 ml的结节中存在。该现象可能与两种因素相关:(1)能量越大,肿瘤消融后的消融灶体积越大,扩大消融效果更为明显,但延长了消融灶的完全吸收过程;(2)能量越大导致组织热坏死的更彻底,形成的坏死灶也越容易发生碳化,从而不利于机体的吸收。Ito等[17]在其研究中讨论了PTC患者的年龄与肿瘤恶性行为及预后之间的关系,但是未从治疗受益方面进行进一步探索。Weiskopf等[18]研究表明,年龄与机体免疫之间具有相关性,免疫力随着年龄的增长逐渐出现下降,而热消融后消融灶的吸收其本质上是引起机体的抗炎症和坏死细胞吸收吞噬的过程,与机体的免疫状态息息相关,因此我们推测,老年患者消融灶吸收较慢可能与机体的免疫力普遍下降有关,但是目前还没有相关研究证实。刘洋等[19]在对乳腺癌RFA术后的影响因素研究中发现,结节大者消融灶吸收较快,但是未讨论结节大小与肿瘤完全消失的关系,而目前PTMC缺乏相关研究。本研究实现了针对PTMC患者RFA术后12个月内消融灶恢复的个体化预测,根据Nomogram评分可以计算出12个月内肿瘤未消失的风险概率,并经过内部验证确定了预测模型的准确性,通过ROC证实此模型可高效预测PTMC术后12个月肿瘤存在状态,具有较高的临床应用价值。
本研究存在以下不足:(1)构建模型仅通过内部验证其有效性,缺乏外部验证,需进一步扩大病例资料进行外部验证;(2)仅观察RFA术后的PTMC患者1年内肿瘤状态的影响因素,未对远期肿瘤状态进行评估。
综上,本研究基于性别、年龄、肿瘤最大径、钙化灶的大小及RFA能量这5个独立危险因素构建的预测PTMC患者RFA术后短期内肿瘤转归的Nomogram图模型,具有较高的区分度和一致性,对临床医师甄别RFA术后12个月内消融灶吸收不良的PTMC患者,并对患者进行术后恢复情况予以解释提供临床依据。
