尼可地尔对野百合碱诱导PAH大鼠肺动脉内皮细胞氧化损伤及肺动脉平滑肌细胞增殖的影响
2021-07-06杨海燕毛亚飞占焕平魏宇峰
陈 静,杨海燕,毛亚飞,占焕平,魏宇峰
0 引言
肺动脉高压(Pulmonary arterial hypertension,PAH)是指肺动脉压力过高的一种病理生理状态,常导致右心衰竭,既可是独立的疾病或综合征,也可是由其他疾病引起的并发症[1-2]。平均肺动脉压(Mean pulmonary arterial pressure,mPAP)和右心室肥厚指数是反映PAH严重程度的重要指标[3-4]。PAH的发病与肺动脉内皮细胞(Pulmonary arterial endothelial cells,PAECs)功能失调以及肺动脉平滑肌细胞(Pulmonary arterial smooth muscle cells,PASMCs)增生有关,其细胞活动与离子通道紧密相关。尼可地尔是首个应用于临床的钾离子通道开放剂,其机制与钾离子通道激活后,钾离子流出后所引起的钙离子内流减少,导致血管平滑肌松弛和血管舒张有关[5-6]。研究发现,尼可地尔对野百合碱(Monocrotaline,MCT)诱导的PAH小鼠的心肌细胞具有保护作用[7]。本研究通过比较钾离子通道开放剂尼可地尔以及钾离子通道封闭剂5-羟基葵酸(5-hydroxydecanoate,5-HD),探究尼可地尔对MCT诱导PAH大鼠PAECs氧化损伤及PASMCs增殖的影响。
1 材料与方法
1.1 PAH大鼠造模与给药 40只10周龄SPF级雄性SD大鼠,体重(280±20)g,购自上海实验动物研究中心(上海西普尔-必凯实验动物有限公司),动物许可证号SCXK(沪)2008-0016,分笼饲养,适应性饲养1周,自由进食饮水。适应性饲养1周后,采用随机数字表将40只SD大鼠分为4组,每组10只:对照组、MCT组、尼可地尔组、5-HD组。除对照组外,三组均接受MCT诱导造模,造模根据江晓丹等[8]的MCT诱导PAH大鼠方法加以改良,MCT组、尼可地尔组和5-HD组大鼠均一次性腹腔注射MCT溶液(60 mg/kg),对照组注射等量生理盐水。对照组和MCT组每日灌胃给予5 ml/kg生理盐水;尼可地尔组每日灌胃给予7.5 mg/kg尼可地尔;5-HD组每日先灌胃给予5 mg/kg 5-HD,30 min后再灌胃给予7.5 mg/kg尼可地尔。给药过程共3周,自由进食饮水。
1.2 PAH大鼠体重、血流动力学和右心室肥厚指数检测 给药3周后,各组大鼠称重并记录体重。1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,仰卧固定,将大鼠右侧颈部皮肤切开,暴露出右侧颈外静脉。用丝线结扎颈外静脉远端血管后,将充满0.1%肝素、外径0.9 mm的PE-50管插入并缓慢推进,从颈外静脉右心房、右心室至肺动脉。导管连接至PT-200T压力换能器(Nihon Kohden公司,日本),观察示波器波形判断导管是否到达肺动脉。经载波放大器后,生理记录仪计算mPAP,作为血流动力学指标。
血流动力学测定后,颈椎脱臼处死大鼠。取出大鼠心肺组织,生理盐水冲洗后,剪去心房组织,用滤纸吸干后分别称量右心室(RV)和左心室+室间隔(LV+S)的重量,计算右心室肥厚指数=RV/(LV+S)以反映右心室重量的变化。
1.3 PAH大鼠PAECs和PASMCs分离与培养 PAH大鼠PAECs和PASMCs均分离自PAH大鼠远端肺动脉组织。PAECs采用Dynabeads CD31 Positive Selection试剂盒(Invitrogen,美国)分离,并根据Endothelial Cells Growth Media试剂盒(Lonza,美国)指导条件下培养于EGM培养基中,置于37 ℃、5% CO2的恒温培养箱中。PASMCs根据Smooth Muscle Cells Growth Media试剂盒(Sciencell,美国)指导下培养于平滑肌细胞(SMCM)培养基中,置于37 ℃、5% CO2的恒温培养箱中。实验操作均严格按照说明书进行。PAECs细胞鉴定采用显微镜形态学观察和Ⅷ因子免疫荧光染色检测,PASMCs细胞鉴定采用显微镜形态学观察和α-平滑肌动蛋白(α-SMA)免疫荧光染色进行鉴定。
显微镜观察下PAECs细胞均呈鹅卵石样排列,而PASMCs细胞呈长梭形放射状生长,有重叠生长现象,形成“峰-谷”状。Ⅷ因子免疫荧光检测PAECs细胞胞浆中大量颗粒呈红色荧光;α-SMA免疫荧光检测PASMCs细胞胞浆内大量平行丝状红色荧光。
1.4 PAH大鼠PAECs内活性氧簇(ROS)和一氧化氮(NO)检测 2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)荧光检测PAECs中ROS水平。PAECs(1×106/孔)接种于6孔板中,加入500 μl 10 μmol/L ROS荧光探针DCFH-DA。避光条件下37 ℃孵育30 min,孵育期间每隔3~5 min混匀1次。之后流式细胞仪检测荧光强度,激发光488 nm,发射光525 nm。实验重复3次,取平均值。
Greiss法检测NO水平。PAECs(1×106/孔)接种于含10%胎牛血清的RPMI-1640培养基的6孔板中,待细胞融合至80%,裂解细胞,采用NO检测试剂盒(碧云天,中国)检测NO水平,NaNO2绘制标准曲线,实验操作均严格按照说明书进行。实验重复3次,取平均值。
1.5 PAH大鼠PAECs内蛋白激酶C-ε(PKCε)、内皮型一氧化氮合成酶(eNOS)和NADPH氧化酶(NOX)检测 Western blot法检测PAECs内PKCε和eNOS水平。PAECs接种含10%胎牛血清的RPMI-1640培养基的培养皿中,待细胞融合至80%,RIPA试剂(Boster,美国)裂解细胞。经1 500转/min离心5 min后,弃去上清,超声波破碎。1 500转/min离心5 min后,取10 μl样品与上样缓冲液按4∶1比例混匀,100 ℃加热10 min。行12%聚丙烯酰胺凝胶电泳(SDS-PAGE)后,转膜至聚偏二氟乙烯(PVDF)膜。经TBST溶液封闭90 min后,加入一抗PKCε和eNOS抗体(1∶500稀释),4 ℃下过夜孵育。第2天加入辣根过氧化物酶(HRP)标记的羊抗鼠二抗(1∶1 000稀释),室温下孵育1 h,利用ECL显色。以GAPDH为内参,Quantity One软件分析条带灰度值,PKCε和eNOS与GAPDH灰度值比值作为PKCε和eNOS相对表达量。实验重复3次,取平均值。
1.6 硝基四氮唑蓝(NBT)还原实验检测PAECs内NOX活性 PAECs(5×104/孔)接种于96孔板中,每孔加入20 μl 0.1% NBT,于37 ℃,5% CO2恒温培养箱中培养1 h,1 500转/min离心。每孔加入200 μl DMSO后,室温震荡20 min,测570 nm处吸光度。实验重复3次,取平均值。
1.7 MTT实验检测PAMSCs增殖能力 PAMSCs接种于96孔板,细胞浓度5×103个/孔,置于37 ℃、5%CO2恒温培养箱中培养72 h,于0 h、12 h、24 h、48 h、72 h检测,每次加入20 μl MTT溶液,继续培养4 h,490 nm处测定吸光值(OD)。实验重复3次,取平均值。
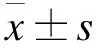
2 结果
2.1 各组大鼠给药后体重、血流动力学和右心室肥厚指数比较 MCT组和5-HD组体重均低于对照组,mPAP和RV/(LV+S)均高于对照组,而尼可地尔组体重均高于MCT组和5-HD组,mPAP和RV/(LV+S)均低于MCT组和5-HD组,差异均有统计学意义(P<0.05)。见表1。

表1 各组大鼠体重、血流动力学和RV/(LV+S)
2.2 各组大鼠给药后PAECs内ROS和NO比较 MCT组和5-HD组PAECs内ROS水平均高于对照组,NO水平低于对照组,差异均有统计学意义(P<0.05);尼可地尔组PAECs内ROS水平高于对照组,差异有统计学意义(P<0.05);尼可地尔组PAECs内ROS水平均低于MCT组和5-HD组,NO水平均高于MCT组和5-HD组,差异均有统计学意义(P<0.05)。见图1。
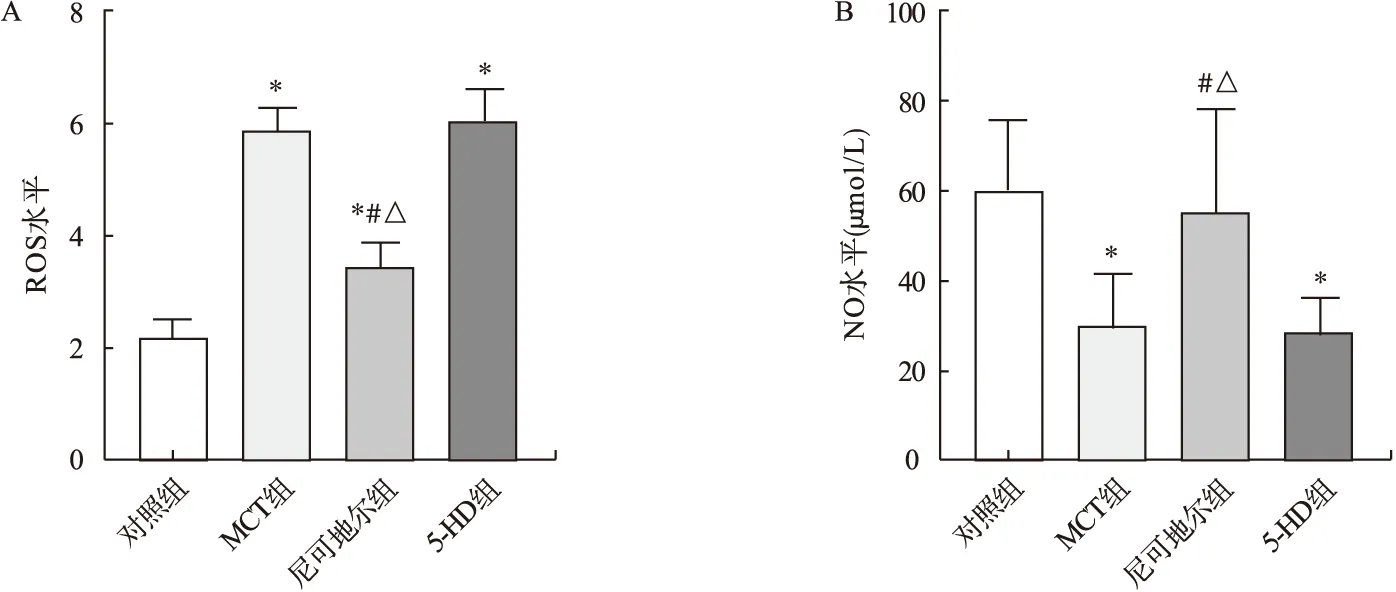
图1 各组大鼠PAECs内ROS和NO水平
2.3 各组大鼠给药后PAECs内PKCε、eNOS和NOX比较 MCT组和5-HD组PAECs内PKCε相对表达水平和NOX活性均高于对照组,尼可地尔组PAECs内PKCε相对表达水平高于对照组,但尼可地尔组PAECs内PKCε相对表达水平和NOX活性均低于MCT组和5-HD组,差异均有统计学意义(P<0.05)。见图2、图3。

图3 各组大鼠PAECs内NOX活性
MCT组、尼可地尔组和5-HD组PAECs内eNOS相对表达水平均低于对照组,但尼可地尔组PAECs内eNOS相对表达水平高于MCT组和5-HD组,差异均有统计学意义(P<0.05)。见图2。
图2 各组大鼠PAECs内PKCε、eNOS相对表达水平
2.4 各组大鼠给药后PASMCs增殖能力比较 培养48~72 h,MCT组和5-HD组PASMCs增殖能力均高于对照组和尼可地尔组,而72 h时,尼可地尔组PASMCs增殖能力高于对照组,差异均有统计学意义(P<0.05)。见图4。

图4 各组大鼠PASMCs细胞增殖能力比较
3 讨论
PAH作为常见的心血管疾病,临床表现为进展性的肺动脉血压升高,常用钙离子通道阻断剂、类前列腺素药物、内皮素阻断剂和5型磷酸二酯酶抑制剂治疗[9-11]。然而近年来,有研究报道,钾离子通道也与PAH的发生发展有关[12]。
本研究拟通过尼可地尔治疗MCT诱导的PAH大鼠,检测PAH大鼠PAECs和PASMCs相关指标,验证尼可地尔的治疗功效并为尼可地尔治疗PAH提供理论基础。
PAH与体重、mPAP以及[RV/(LV+S)]等多种指标的异常变化有关,其中mPAP是PAH的主要指标,[RV/(LV+S)]则反映了PAH的进展情况。通过对比体重、mPAP以及[RV/(LV+S)]可知,相比空白对照,MCT诱导的各组大鼠体重增量更少,而mPAP和[RV/(LV+S)]增加,说明MCT诱导PAH成功。
ROS是细胞氧化损伤的主要指标,过多的ROS产生会引起心血管损伤[13]。NO合成是内皮细胞调控平滑肌细胞从而引起血管扩张的主要方式,NO合成不足会引起内皮细胞的功能性障碍,从而引起PAH等一些系列心血管疾病[14-15]。与空白对照相比,MCT诱导的PAH大鼠PAECs具有更高的ROS水平和更低的NO水平,表明PAH的发生发展与ROS增加和NO减少有关。再根据尼可地尔和5-HD处理后大鼠PAECs的ROS和NO水平比较可知,尼可地尔通过钾离子通道开放效应对MCT诱导的PAH大鼠PAECs的ROS水平有抑制作用,对NO水平有促进效果。为了验证ROS和NO水平变化的机制,本研究检测了ROS生成有关的酶PKCε的表达和NOX的活性以及与NO合成有关的酶eNOS的表达[16-18]。检测结果表明,MCT诱导的PAH大鼠PAECs的ROS水平及PKCε表达增加与NOX的活性升高有关,而NO水平的下降与eNOS表达下降有关。结果表明,尼可地尔治疗引起PKCε的表达减少和NOX的活性降低,而eNOS表达增加,导致了ROS水平降低且NO水平升高。5-HD抑制了钾离子通道开放后,PKCε、eNOS表达和NOX活性结果说明钾离子通道开放效应参与了PAECs内PKCε、eNOS表达和NOX活性的调控。因此,尼可地尔通过钾离子通道开放作用对MCT诱导的PAH大鼠PAECs氧化损伤具有保护作用。
PASMCs的收缩和增殖与PAH的发生发展有关,其过度收缩、增殖和凋亡比率失调均会影响到肺血管的重塑[19]。PASMCs的增殖速度越快,说明PAH的进展程度越高[20]。MTT结果表明,空白对照和尼可地尔治疗后的大鼠PASMCs的增殖能力低于只经MCT诱导PAH大鼠PASMCs,说明尼可地尔可以抑制MCT诱导的PAH大鼠PASMCs增殖能力,而与5-HD处理后的PAH大鼠PASMCs增殖能力高于尼可地尔治疗后,表明钾离子通道的开放与否能够影响MCT诱导PAH大鼠PASMCs增殖能力。
综上所述,尼可地尔对MCT诱导的PAH大鼠PAECs氧化损伤具有保护作用,可抑制PASMCs增殖,钾离子通道开放可能是其作用机制。
