电针深刺对三叉神经痛大鼠ERK蛋白表达及Kv3.4、Kv4.3基因表达的影响
2021-07-06何明伟庞金磊王成彬刘亚光吴宪宏孙海燕
何明伟,庞金磊,王成彬,刘亚光,吴宪宏,孙海燕
三叉神经痛(trigeminal neuralgia,TN)是一种反复发作于面部三叉神经分布区的阵发性剧烈疼痛性疾病[1-2]。TN发作次数频繁、剧烈疼痛严重影响患者身心健康。卡马西平、苯妥英钠等药物长期使用疗效下降,且不良反应增加[3];外科手术,如显微血管减压术和射频微控热凝术,部分患者可能出现同侧小脑共济失调和面部麻木等并发症。大量临床研究报道[4-6],电针在缓解TN患者疼痛程度、减少TN发作次数上具有显著疗效,且其安全性高,但其作用机制不明。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、钾离子通道被证实参与了TN的发生[7]。ERK可将细胞外刺激传到细胞内并引发转录、翻译、蛋白质合成等一系列反应,最终影响中枢神经元致敏性和神经突触的可塑性,ERK是神经性疼痛产生、痛觉信号传递等过程中的关键性因子。邢勇盛等[8]发现,电针深刺可调节TN大鼠ERK信号通路。此外,三叉神经节中钾离子通道和受体的异常表达和堆积可能参与三叉神经痛的发生,其中电压门控性钾通道家族Kv3.4、Kv4.3开放可诱导瞬时外向钾电流(transient outward potassium current,IA),而IA是与面部疼痛形成最具关联性的电流[9]。李崖雪等[10]发现电针深刺可影响TN大鼠神经节Kv3.4表达。
基于TN发病机制的复杂性及电针深刺对TN治疗机制尚不明确,本研究拟建立大鼠TN模型,深入观察电针深刺对TN大鼠痛阈的影响,综合分析电针对ERK信号通路、电压门控性钾通道相关因子的影响,以期探索TN的发病机制及电针治疗TN的机制,报道如下。
1 材料与方法
1.1 材料 (1)动物:雄性SD大鼠48只[购自德清奥丽芙生物科技有限公司,许可证号SYXK(浙)2018-0019],2月龄,体质量253~262 g。实验前3 d适应实验环境饲养,光照(7:00—19:00)、黑暗(19:00—7:00),温度22~25℃,湿度50%~55%,大鼠自由获取水和饲料。(2)试剂与药物:2%戊巴比妥钠、10%水合氯醛、PBS缓冲液、4%多聚甲醛缓冲液、山羊抗兔IgG、兔抗山羊IgG(武汉菲恩生物科技有限公司)、兔抗ERK1/2(UPstate,美国)、invitrogen Trizol试剂盒(AMEKO,中国) 、引物(Genecopoeia,美国)。(3)仪器:显微镜(Olympus,日本)、铬肠线(5-0,山东海迪科生物技术有限公司)、BME-403型细丝法检测仪(中国医学科学院生物医学研究所)、激光共聚焦扫描显微镜(Leica,德国)、荧光显微镜(尼康,日本)。
1.2 实验方法 2019年1月—2020年1月在首都医科大学实验中心进行实验。雄性SD大鼠48只按简单随机数字表法分成3组(n=16):假手术组、模型组、电针组。适应性饲养3 d后,右侧面部去毛,消毒,腹腔注射2%戊巴比妥钠(40 mg/kg)麻醉,固定头部及四肢,显微镜下以右侧眉弓上方做切口,露出额骨、眼眶和鼻骨,拔离眶内结构暴露眶下神经,分离神经后,模型组、电针组使用2根铬肠线结扎(线距1.8 mm),镜下检查可见眶下神经直径变细但保持神经外膜血液通畅;假手术组仅切开皮肤暴露神经,不做神经结扎后逐层缝合。在大鼠手术清醒后继续饲养14 d,取无菌刺激物刺激大鼠右侧颜面,若大鼠出现躲避刺激或蜷缩身体、快速抓啮的攻击行为及非对称性面部搔抓3次及以上者,则为造模成功。电针组在模型成立后右侧下关穴(深5 mm)、百会穴(深3 mm)刺入不锈钢毫针。电针治疗仪参数:80 Hz/s连续波、20 min,间隔6 h,每天2次,连续深刺14 d。
1.3 观察指标与方法 所有大鼠在造模后28 d均腹腔注射10%水合氯醛(8 ml/kg)处死,快速暴露心脏并经左心室插管至主动脉,0.01 mol/L PBS缓冲液冲洗并在右心耳做切口,至液体无混浊后左心室灌注4%多聚甲醛缓冲液500 ml,30 min,缓冲液固定2 h后,放置于30%蔗糖PBS缓冲液过夜,取三叉神经节做切片,待测。
1.3.1 痛阈测定: 造模前1d,造模后7 d、14 d,治疗后7 d、14 d均进行大鼠患侧面部痛阈监测。BME-403型细丝法检测仪从低到高逐渐增加折力(折力:0.13 g、0.20 g、0.33 g、0.60 g、1.30 g、3.60 g、5.00 g、7.30 g、9.90 g、20.10 g),每阶段折力细丝刺激6次、每次2 s、间隔60 s,大鼠出现疼痛刺激(即躲避、攻击或面部搔抓)的最小值即为痛阈(若20.10 g仍未出现疼痛刺激,则阈值定为20.10 g)。
1.3.2 ERK蛋白表达测定:取切片,加羊抗磷酸化ERK(p-ERK),孵育过夜(4℃),加标记山羊抗兔IgG、兔抗山羊IgG,避光反应40 min(37℃),加兔抗ERK1/2缓冲甘油封片,阴性对照组以PBS缓冲液代替羊抗p-ERK,余操作同上,封片后激光共聚焦扫描显微镜拍照,采用Image J分析免疫组化图片,强度值越高表示抗原物质量越多。
1.3.3 Kv3.4、Kv4.3 mRNA表达测定:采用实时荧光定量PCR(qPCR)法测定。制胶与凝胶电泳,0.4 g琼脂粉加入40 mlTEA溶液中并加热溶解至透明,冷却后加入3 μL Gelstain,导入制胶板中,凝固后行电泳,电压110V、电流80A、时间45 min。取切片,提取总RNA,按照invitrogen Trizol试剂盒说明书操作,测定RNA浓度、纯度,逆转录cDNA,并保存于-20℃下待测;加引物(引物序列见表1),qPCR反应体系条件:95℃预变性5 min,95℃ 10 s、60℃ 30 s,30个循环,后延伸(72℃ 7 min);以β-actin为内参,在荧光显微镜下采用相对定量法获取 Kv3.4、Kv4.3 mRNA△CT值。

表1 qPCR所用引物序列
2 结 果
2.1 3组大鼠痛阈值变化情况比较 假手术组各时点痛阈值比较差异无统计学意义(P>0.05);模型组、电针组大鼠造模后7 d痛阈值均显著高于造模前1 d(P<0.05),造模后14 d痛阈值显著下降(P<0.05);电针组治疗后7 d和14 d痛阈值上升(P<0.05),且电针组治疗后7 d和14 d痛阈值均显著高于模型组(P<0.05),见表2。
表2 3组大鼠痛阈值变化情况比较
2.2 3组大鼠治疗后14 d p-ERK、ERK免疫荧光强度值比较 模型组大鼠治疗后14 d p-ERK、ERK免疫荧光强度值显著高于假手术组(P<0.01);电针组p-ERK、ERK免疫荧光强度值均显著低于模型组(P<0.05),见图1、2。

注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05
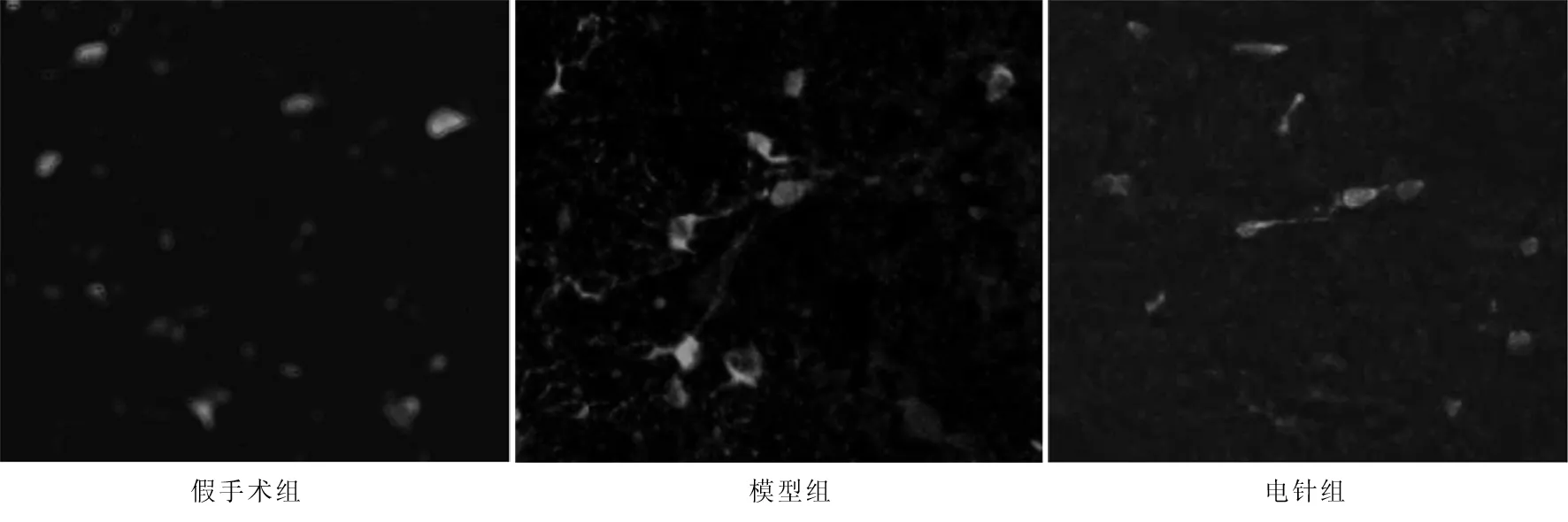
图2 3组大鼠治疗后14 d p-ERK荧光染色图(×400)
2.3 3组大鼠治疗后14 d Kv3.4、Kv4.3 mRNA表达比较 模型组大鼠治疗后14 d Kv3.4、Kv4.3 mRNA表达水平显著低于假手术组(P<0.05);电针组Kv3.4、Kv4.3 mRNA表达水平均显著高于模型组(P<0.05),见图3、4 。

图3 3组大鼠治疗后14d Kv3.4、Kv4.3mRNA电泳图
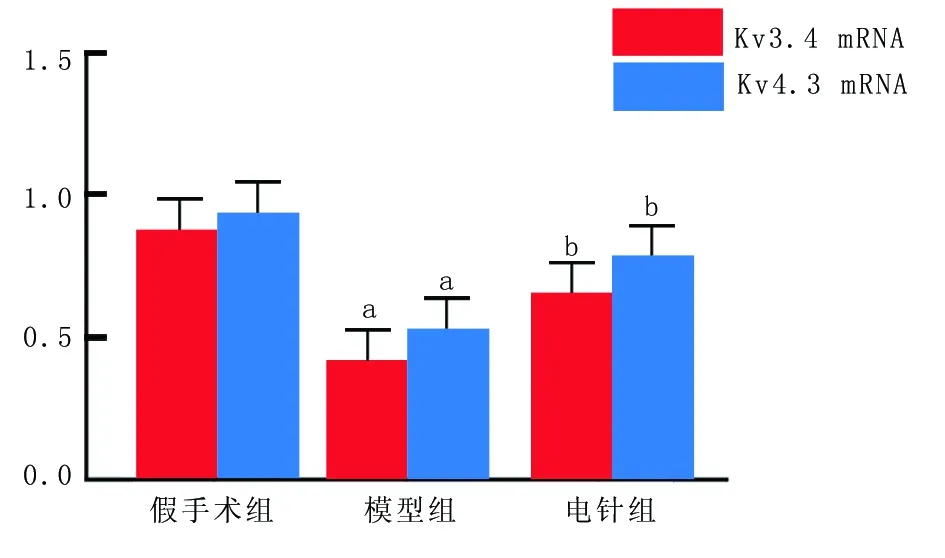
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05
3 讨 论
三叉神经痛是常见神经病理性疼痛之一,其发病机制不明,因此治疗上以对症治疗或神经毁损治疗为主。多数学者认为三叉神经感觉纤维脱髓鞘病变是TN的病理生理机制,并提出TN病因的两大主流学说:中枢病因和周围病因。前者认为TN为三叉神经脊束核内癫痫样改变,后者认为三叉神经周围支节段性脱髓鞘改变,但均不能解释临床所有案例,对于TN的病理机制仍需要不断研究[11-13]。本研究发现,TN大鼠三叉神经节中p-ERK蛋白表达增多,同时Kv 3.4、Kv 4.3 mRNA表达减少,提示TN的发病机制可能与二者相关。电针治疗后,在疼痛减轻的同时二者的表达相应产生变化,提示电针治疗作用亦与二者密切相关。
大鼠眶下神经慢性缩窄环术是建立TN动物模型最常用的方式之一,可用于观察大鼠不同时间的行为,且可反映三叉神经受压迫后迟钝反应期、超敏反应期及恢复期三叉神经节束核、髓鞘及丘脑、感觉皮质变化情况。本研究显示,接受结扎神经术的模型组、电针组在造模后7 d的痛阈值呈增高趋势,为神经结扎阻碍了神经信号传入从而出现的短暂迟钝反应,至造模后14 d电针组、模型组均处于超敏反应期,提示模型组、电针组TN造模成功。模型组此后至治疗后14 d均处于低痛阈值,但电针组在接受电针深刺治疗7 d和14 d后痛阈值提高,且在治疗后14 d痛阈值与假手术组相当,提示电针深刺具有镇痛效果。进一步研究显示,模型组造模后28 d p-ERK、ERK免疫荧光强度值显著高于电针组、假手术组,而Kv3.4、Kv4.3 mRNA表达水平显著低于电针组、假手术组,即模型组p-ERK、ERK大量激活、IA被抑制,电针深刺则可抑制ERK、促进IA释放。
痛觉形成机制中,外周信号传导是第一步,该过程包括刺激促进细胞介质释放间接激活传入神经末梢和刺激直接调控感觉神经末梢离子通道[14-17]。ERK直接/间接参与了刺激传入神经末梢中的细胞介质释放过程[7,18]。ERK是一种多功能激酶,可磷酸化多种关键底物改变神经元可塑性,而在神经元可塑性发生改变后,使正常生理条件下终止于脊髓后角深层的Aβ纤维向着背角浅层生芽并与次级神经元建立突触联系。末梢神经离子通道的改变直接引发痛觉异常。当Kv3.4、Kv4.3表达抑制时,它们介导的IA作用减弱,导致神经元兴奋阈电位下降,且动作电位频率增加、间隔缩短,导致三叉神经兴奋性增加,从而导致痛觉敏化。下关穴靠近三叉神经节半月节,配穴百会为调节大脑功能的要穴,既往研究证实[5,19],电针深刺不仅可选择性地阻断Aβ纤维传递信息,且可调节神经突触结构可塑性。结合以上分析,电针深刺可能通过抑制ERK表达,促进Kv3.4、Kv4.3表达而上调IA水平达到临床治疗效果。
本研究尝试分析电针深刺是通过何种/几种信号通路影响TN疼痛,但也存在以下不足:首先,受限于研究该病作用机制标本的特殊性,多为尸检或动物模型,与临床案例仍有一定差距;其次,本研究中采用结扎法模拟TN,虽然操作简单、行为易观察,但结扎松紧度与神经纤维变性程度密切相关,在实际操作过程中不易掌握松紧度,且其为模拟周围神经损伤模型,而眶下神经结扎也不能获得完全符合临床表现的理想动物模型;最后,本研究也未建立ERK抑制组、Kv4.3类似物组进行更为严谨的对比研究。因此,对于电针深刺如何影响TN仍有待于后续更为严谨的研究。
综上所述,电针深刺可抑制大鼠三叉神经节中p-ERK、ERK水平,上调Kv3.4、Kv4.3 mRNA表达,从而达到治疗TN的效果。但电针组p-ERK、ERK免疫荧光强度值及Kv3.4、Kv4.3 mRNA灰度值仍低于假手术组,这提示TN是多种信号通路共同作用的结果,且电针深刺作用的信号通路包括但不仅限于ERK信号通路、钾离子通道,需要在今后的实验中加以研究证实。
利益冲突:所有作者声明无利益冲突
作者贡献声明
何明伟:设计研究方案,实施研究过程,论文撰写;庞金磊、王成彬:实施研究过程,资料搜集整理;刘亚光:实施研究过程,数据统计分析;吴宪宏、孙海燕:设计研究思路,分析试验数据,论文审核
