Cu掺杂对硫化镍精矿制备高效异相类Fenton催化剂(Ni, Mg, Cu)Fe2O4的影响
2021-06-28刘雅贤
刘雅贤,陈 婷,韩 星,张 梅,郭 敏
北京科技大学冶金与生态工程学院,北京 100083
镍是一种重要的金属元素,被广泛应用到机械制造、电池、催化、磁性材料等领域.全球镍产量的2/3源于硫化镍矿,我国的硫化铜镍矿占比高达90%,是镍提取的主要来源[1-2].硫化镍精矿是铜镍硫化矿石经过浮选得到的含多种有价金属元素的矿物,众多研究者对硫化镍精矿的利用均集中在镍钴金属的提取上[3-4],其他金属元素未得到有效利用,造成了资源浪费.如何综合高效地利用硫化镍精矿中的有价金属元素,成为近年来研究的热点.
随着人类生产活动的日益加剧,水污染的问题日益突出,如何处理水中的有机污染物引起人们的广泛关注[5].Fenton氧化技术(Fe2++H2O2反应体系)作为高级氧化技术的一种,可以生成强氧化性的羟基自由基(·OH),其氧化电位高达2.8 V·SHE-1(SHE为标准氢电极),能够将复杂有机物分解成较小的有机物分子或者完全矿化为H2O和CO2分子,达到降解污染物的目的.然而,由于此均相反应存在有效pH值区间窄(2.5~3.5)、容易形成含铁污泥进而额外增加处理成本等缺点,严重限制了其更加广泛的应用.异相类Fenton氧化技术采用铁基固体催化剂代替液相Fe2+,可以在有效减少含铁污泥生成的同时拓宽反应的pH值范围,因此,近些年得到快速发展[6-8].在众多异相类Fenton催化剂中,尖晶石铁氧体(化学式MFe2O4,M为二价金属阳离子或其组合,且二价阳离子一般为Ni、Zn、Mn、Co、Mg等)由于具有活性好、稳定性高、回收便捷和可重复利用性好等优点备受研究者关注.Wang等[9]通过超声化学技术合成了纳米尖晶石铁氧体Fe3O4颗粒,60 min内对罗丹明B(RhB)溶液的降解率可以达到90%.Roonasi与Nezhad[10]采用共沉淀法制备出尖晶石 Fe3O4、ZnFe2O4、MnFe2O4和CuFe2O4纳米颗粒,并对比研究了它们降解苯酚催化活性的效率,发现CuFe2O4纳米颗粒降解效率最高,反应175 min对苯酚的降解效率达到78%.Wang等[11]采用溶胶-凝胶法制备了MnFe2O4纳米颗粒用于降解诺氟沙星,180 min后对诺氟沙星的降解效率接近90.6%.
相比于均相Fenton过程,异相类Fenton反应发生在液固界面,较为缓慢的传质过程抑制了Fe3+向Fe2+的转化,进而在一定程度上降低催化活性.如何加速反应过程中铁离子电对Fe3+/Fe2+的氧化还原循环,提高降解效率是异相类Fenton反应需要解决的核心问题,外场辅助尤其是可见光辅助、金属离子掺杂等均被证明为有效的手段.Zhong 等[12]制备了过渡金属(Ti,Cr,Mn,Co 和 Ni)掺杂Fe3O4,并探讨了其对四溴双酚A降解的影响.结果表明,掺杂过渡金属可改善Fe3O4催化活性.Sharma等[13]采用溶胶-凝胶法合成出不同种类双金属尖晶石铁氧体(MFe2O4;M=Cu,Zn,Ni和 Co)用于降解亚甲基蓝,发现CuFe2O4表现出最高的降解活性.Huang等[14]制备的Cu2+掺杂Fe2.88Cu0.12O4异相类Fenton催化剂提高了罗丹明B的降解效率.研究表明,在众多过渡金属离子中,Cu2+能够促进H2O2分解生成·OH,并且Cu+能够促进Fe3+向Fe2+的转化(Cu2+/Cu+电对的标准电极电位值Eϴ(Cu2+/Cu+)=0.166 V,Fe3+/Fe2+电对的标准电极电位值Eϴ(Fe3+/Fe2+)=0.770 V),促进 Fe2+的再生,进而提高催化剂活性.另外,过渡金属离子掺杂还能够改变尖晶石铁氧体中金属离子的占位.Jacobs等[15]的研究表明,八面体位的阳离子更容易裸露在尖晶石型铁氧体的表面,在此位置的金属离子才能够参与异相类Fenton反应,产生强氧化性的·OH,从而有效地降解有机污染物.CuFe2O4是一种反尖晶石型铁氧体,Cu2+将全部占据八面体位,更容易裸露在铁氧体表面参与反应,有利于提高催化性能.
基于尖晶石铁氧体的化学式可知,硫化镍精矿中含有的 Ni、Mg、Cu、Co、Fe等金属元素,均是合成尖晶石铁氧体的主要化学成分[16];同时,尖晶石结构中存在的大量间隙空置和晶格缺陷为多种金属阳离子的掺杂和离子扩散提供了便利条件,意味着采用合适的工艺方法从硫化镍精矿制备共掺杂铁氧体是可行的.Sun等[17]通过共沉淀-煅烧法以低冰镍为原料合成了(Ni,Cu,Co)Fe2O4尖晶石铁氧体.韩星等[18]以腐泥土型红土镍矿为原料成功制备出磁性多金属共掺杂型MgFe2O4.然而到目前为止,利用硫化镍精矿中的有价金属元素合成尖晶石铁氧体,并作为异相光助类Fenton催化剂降解染料废水的研究鲜有报道.
本论文选取硫化镍精矿作为研究对象,采用湿法工艺浸取有价金属元素,利用浸出液制备金属共掺杂铁酸镍镁铜((Ni,Mg,Cu)Fe2O4)异相类Fenton催化剂,系统研究Cu掺杂对合成铁氧体的形貌、结构和催化性能的影响.为从自然矿物中合成尖晶石铁氧体作为催化剂降解废水中有机污染物提供了新的途径.
1 实验部分
1.1 实验原料及试剂
本文实验原料为吉林省某镍冶炼厂的硫化镍精矿.硫化镍精矿使用前要经过预处理过程,即将硫化镍精矿放入干燥箱中90 ℃干燥24 h,然后利用破碎机粉碎,使粒度达到200 目(75 μm)以下留作备用.通过 X射线荧光光谱仪(X-ray Fluorescence,XRF)和 X射线衍射仪(X-ray diffraction,XRD)对硫化镍精矿的化学成分及矿物组成进行测定,其成分含量及XRD图谱分别如表1和图1所示.硫化镍精矿主要成分为 Fe、Si、S、Ni、Cu、Mg、Al和 O,还有少量其他元素.根据物相分析可知,硫化镍精矿中主要包含镍黄铁矿((Fe,Ni)9S8)、黄铁矿(FeS2)、黄铜矿(CuFeS2)、石英(SiO2)以及硅酸盐脉石等矿物.

表 1 X射线荧光光谱分析测定硫化镍精矿主要化学成分Table 1 Chemical compositions of nickel sulfide concentrateanalyzed by XRF %

图 1 硫化镍精矿的XRD图谱Fig.1 XRD pattern of nickel sulfide concentrate
实验所用试剂为六水合氯化铁(FeCl3·6H2O)、氢氧化钠(NaOH)、过氧化氢(H2O2)、浓盐酸溶液(HCl)、二水合氯化铜(CuCl2·2H2O)和罗丹明B(C28HClN2O3),以上试剂纯度均为分析纯级,产自国药集团化学有限公司.
1.2 实验流程
1.2.1 硫化镍精矿酸浸过程
本文采用FeCl3-HCl溶液体系处理硫化镍精矿,得到富含金属元素Fe、Ni、Mg、Cu的高效浸出溶液.基于我们前期的工作[19],获得了最佳浸出实验条件:FeCl3溶液浓度为 0.8 mol·L-1,HCl溶液浓度为 0.75 mol·L-1,液固比为 (20∶1) mL·g-1,浸出温度为90 ℃,浸出时间为7 h.首先,将12.5 g预处理后的硫化镍精矿置于500 mL的三口烧瓶中,烧瓶口分别连接冷凝管和机械电动搅拌器,烧瓶置于90 ℃水浴加热锅中.然后将250 mL一定浓度的FeCl3和HCl混合溶液倒入三口烧瓶中,并用瓶塞塞住三口烧瓶的瓶口,调节搅拌速度至700 r·min-1,同时反应开始计时.待反应达到7 h后,利用真空泵实现固液分离,最终得到的硫化镍精矿浸出液中 Fe(Fe2+/Fe3+)、Ni2+、Mg2+、Cu2+等离子的含量通过电感耦合等离子原子发射光谱仪(Inductively coupled plasma atomic emission spectrometer,ICPAES)测定,结果如表2所示.硫化镍精矿浸出液中主要元素是Fe、Ni、Mg和Cu,这些都是合成(Ni,Mg,Cu)Fe2O4的主要元素,其他杂质元素的含量很低,几乎不会影响合成的铁酸镍镁铜(Ni,Mg,Cu)Fe2O4尖晶石铁氧体的纯度.
1.2.2 (Ni,Mg,Cu)Fe2O4制备过程
由尖晶石铁氧体(MFe2O4)化学式可知,铁氧体中Fe3+与二价金属离子的摩尔比为2,即Fe与(Ni+Cu+Mg)的摩尔比为2时理论上才能合成纯相的铁氧体.而实际浸出液中Fe与(Ni+Cu+Mg)摩尔比为6.76(表2),远远大于制备铁氧体所需的Fe含量,因此,首先要调整浸出液pH值至一定值,使多余Fe3+生成部分Fe(OH)3沉淀除去,使得溶液中Fe与(Ni+Cu+Co)的摩尔比接近2.在本论文中通过向溶液中添加不同量的CuCl2·2H2O来研究Cu掺杂对合成铁氧体的形貌、结构及催化性能的影响,分别选取了Ni与Cu的摩尔比为1∶0.6(记为MNi∶Cu=1∶0.6),和MNi∶Cu=1∶1 进行掺杂,同时与未掺杂Cu的铁氧体进行对比.具体制备实验步骤如下:

表 2 ICP-AES测定硫化镍精矿浸出液中主要金属元素含量Table 2 Main metal elements in the leaching solution of nickel sulfide concentrate by ICP-AES analysis
(1)取50 mL硫化镍精矿浸出液置于烧杯中,通过pH计实时检测烧杯内溶液的pH值.
(2)常温常压磁力搅拌下向烧杯中滴加15 mL过氧化氢,目的是使浸出液中的Fe2+完全氧化为Fe3+,然后向烧杯中逐滴慢慢地加入 5 mol·L-1的NaOH溶液,待烧杯中溶液pH值达到2.4时停止滴加NaOH溶液,随后用离心机进行固液分离(转速为 5000 r·min-1、时间为 5 min).
(3)离心得到的溶液置于烧杯中,并向烧杯中分别加入0.180 g和0.353 g CuCl2·2H2O(分别确保MNi∶Cu=1∶0.6,MNi:Cu=1∶1;为了对比,还进行了未添加CuCl2·2H2O的实验),磁力搅拌至固体全部溶解,然后再滴加5 mol·L-1的NaOH溶液,待烧杯中溶液pH值达到12.0时停止滴加NaOH溶液,随后用离心机进行固液分离(转速为5000 r·min-1、时间为 5 min).
(4)将离心后得到的固体氢氧化物沉淀用去离子水清洗3~5次(目的是除去部分杂质元素),然后置于干燥箱中90 ℃下干燥12 h,随后用研钵研磨成粉末状,最后将粉末状固体氢氧化物转移到氧化铝坩埚中,并置于马弗炉中1000 ℃下煅烧2 h,最终得到不同铜含量的铁酸镍镁铜(Ni,Mg,Cu)Fe2O4尖晶石铁氧体催化剂.
1.2.3 催化降解性能测试实验
分别选择上述制备的不同铜含量的(Ni,Mg,Cu)Fe2O4作为异相类Fenton催化剂,用以降解RhB溶液.具体的催化降解实验如下所述:取200 mL浓度为10 mg·L-1的RhB溶液置于容量为250 mL的烧杯中,随后加入0.20 g催化剂,并在黑暗中持续搅拌30 min以达到吸附-解吸平衡.然后加入体积分数为1.0%的H2O2溶液并打开短弧氙灯稳流电源开始光照,此时开始计时,其中光源与液面之间的距离固定为10 cm.实验中每隔30 min从烧杯中取出5 mL溶液,立即与等体积的异丙醇混合(以防止·OH 的产生),然后将溶液在 5000 r·min-1的转速下离心5 min,随后取2 mL上清液利用紫外-可见分光光度计(TU-1901)测量RhB溶液的吸光光谱.通过公式(1)计算RhB溶液的降解效率,进而来评价所制备的异相类Fenton催化剂的催化性能.

其中:η为RhB溶液的降解效率,%;A0,At分别为初始以及反应t时刻时在554 nm处RhB溶液的吸光度值;C0,Ct分别为初始以及反应t时刻时RhB溶液的质量浓度,mg·L-1.
1.3 实验仪器及表征方法
采用电感耦合等离子体原子发射光谱仪(Inductively coupled plasma atomic emission spectrometer,ICP-AES;型号为 OPTIMA 7000DV,美国铂金埃尔默仪器有限公司)测定硫化镍精矿浸出液中主要金属元素的含量;通过X射线衍射仪(X-ray diffraction,XRD;型号为 D/max-2500,日本 Rigaku公司)对合成的催化剂(Ni,Mg,Cu)Fe2O4的晶体结构进行表征;使用场发射扫描电子显微镜(Fieldemission scanning electron microscope,FE-SEM;型号为Supra-55,德国Zeiss公司)分析表征产物的微观形貌,同时样品粒径由Image J软件统计得到;通过X射线荧光光谱仪(X-ray Fluorescence,XRF;型号为 XRF-1800,日本津岛公司)检测(Ni,Mg,Cu)Fe2O4的化学成分,分析元素含量;采用X射线光电子能谱仪(X-ray photoelectron spectroscopy,XPS;型号为 AXIS U1tra DLD,日本 Kratos公司)测定不同Cu掺杂催化剂(Ni,Mg,Cu)Fe2O4中元素组成及相应化学价态;激发源为Al Kα,以C 1s的结合能作为基线进行校正;利用紫外-可见分光光度计(Ultraviolet and visible absorption spectra,UV-Vis;型号为AL-104,北京普析通用有限公司)对RhB溶液进行吸收光谱的测试.利用F-7000FL分光光度计测定2-羟基对苯二甲酸的含量,进而确定羟基自由基的量,分析波长为425 nm,激发波长为315 nm.
2 结果与讨论
2.1 Cu掺杂量对尖晶石铁氧体结构和微观形貌的影响
图2是不同Cu掺杂量合成样品的XRD图谱及(311)晶面最强峰对应2θ角度偏移的放大图.从图2(a)中可以看出,制备得到的不同Cu掺杂量产物的特征衍射峰均与尖晶石铁氧体的标准特征衍射峰((110)、(220)、(311)、(222)、(400)、(422)、(511)和(440))相一致,说明合成的是立方尖晶石铁氧体相;同时从图中未看到其他杂质相的衍射峰出现,说明合成的产物均为单一相铁氧体.另外,由 (311)晶面的局部放大图(图 2(b))可以看出,随着Cu掺杂量的增加,2θ角度向低角度偏移,说明产物的晶胞参数a随着Cu掺杂量增加而增大.为了进一步定量比较尖晶石相晶胞参数的变化趋势,采用如下公式(2)进行了计算[20],所得结果如表3所示.可以看出,随着Cu掺杂量增加,产物的晶胞参数a从0.4285 nm增大至0.4289 nm.晶胞参数的增大是由于掺杂的Cu2+半径与原铁氧体中阳离子(Ni2+、Mg2+)半径不同导致的.当 Cu2+掺杂到铁氧体中时,优先占据的是八面体B位,且Cu2+半径为0.073 nm,而被代替的Ni2+和Mg2+半径分别为0.069 nm和0.072 nm,均小于Cu2+半径,所以造成了晶胞参数的增大.

图 2 样品的XRD图谱.(a)不同Cu掺杂量合成的样品的XRD图谱;(b)(311)晶面最强峰对应2θ角度偏移的放大图Fig.2 XRD patterns of samples: (a) XRD patterns of Cu-doped samples; (b) enlarged views of 2θ angle shift corresponding to the strongest peaks of the(311) crystal planes

表 3 不同Cu含量(Ni,Mg,Cu)Fe2O4的化学式和晶胞参数的计算结果Table 3 Chemical formula and unit cell parameters of (Ni,Mg,Cu)Fe2O4 with different Cu contents

其中,a代表晶胞参数;λ为X射线入射源的波长,0.15056 nm;θ可根据XRD图谱获得,2θ为XRD图中某一晶面所对应的2θ角度,°;(hkl)为XRD图中的晶面指数,在此计算过程中(hkl)为(311).
另外,根据XRF检测结果得到了不同Cu掺杂量的铁氧体的化学式如表3所示,分别为Ni0.63Mg0.30Cu0.07Fe2O4、Ni0.48Mg0.21Cu0.31Fe2O4和 Ni0.24Mg0.15Cu0.61Fe2O4,表明Cu已成功掺入尖晶石铁氧体中,与XRD分析结果相符合.研究发现,在催化反应过程中,尖晶石铁氧体催化性能主要受铁氧体中过渡金属元素种类及含量的影响,并且Cu2+掺杂更有利于催化反应的进行[21].通过对比三种不同Cu含量尖晶石铁氧体的化学式可知,三种铁氧体所含的金属元素种类相同,但Ni0.24Mg0.15Cu0.61Fe2O4铁氧体中Cu含量最大,因此有理由推测Ni0.24Mg0.15Cu0.61Fe2O4铁氧体催化剂的催化性能更好.
一般来说,催化剂颗粒的粒径越小,比表面积越大,越有利于提高其催化性能[22-23].图3给出了不同Cu掺杂量的样品的SEM图和平均粒径分布图.从图3(a~c)可以看出,合成的Cu掺杂量不同的铁氧体形貌和未掺杂Cu的铁氧体差别不大,均呈现为不规则的颗粒状,且具有一定程度的团聚现象.经统计,三种铁氧体的平均粒径依次为(238±75) nm、(271±87) nm 和 (217±47) nm(图 3(d~f)),即当MNi∶Cu=1∶1时制备得到的产物粒径最小,有望展现出最优的催化活性.

图 3 不同 Cu 掺杂量合成样品的 SEM 图及粒径统计分布图.(a)和(d)未掺杂 Cu 的样品;(b)和(e)MNi∶Cu=1∶0.6 的样品;(c)和(f)MNi∶Cu=1∶1 的样品Fig.3 SEM images and particle size distributions of Cu-doped samples: (a) and (d) undoped Cu sample; (b) and (e) MNi∶Cu=1∶0.6 sample; (c) and (f)MNi∶Cu=1∶1 sample
为了进一步验证铜元素是否成功掺杂进铁氧体中,我们对合成的样品进行了XPS表征.图4是不同Cu掺杂量样品的XPS图谱,用来分析铁氧体表面的元素组成和价态,图中的百分数为对应金属离子在八面体位的占比.从图4(a)全谱图中可以看出,不同Cu掺杂量合成的铁氧体中Fe、Ni、Mg、Cu、O 元素共存.图 4(b)为不同 Cu掺杂量合成铁氧体的高分辨Fe 2p曲线,Fe 2p3/2特征峰出现在~710.6和~713.3 eV处,分别对应于八面体位的 Fe3+(FeOct3+)和四面体位的Fe3+(FeTet3+) ; Fe 2p1/2特征峰出现在~725.0 eV处,进一步印证了Fe3+的存在[24].图 4(c)为样品的高分辨 Mg 2p 曲线,Mg 2p的特征峰出现在~48.9和~49.6 eV,分别对应于八面体位的Mg2+(MgOct2+)和四面体位的Mg2+(MgTet2+)[24].图 4(d)为样品的高分辨 Ni 2p曲线,Ni 2p3/2的特征峰出现在~854.8 和~856.5 eV处,分别对应于八面体位Ni2+(NiOct2+)和四面体位Ni2+(NiTet2+),~861.6 eV 处的卫星峰进一步证实了Ni2+的存在[25].图4(e)为样品的高分辨Cu 2p曲线.出现在~934.1 eV和~935.5 eV处的Cu 2p3/2特征峰分别对应于八面体B位Cu2+(CuOct2+)和四面体 A位 Cu2+(CuTet2+);在 Cu 2p3/2出现的卫星峰~941.7 eV进一步印证了Cu2+的存在[26].综上分析表明,XPS分析结果与前面XRD和XRF结果相匹配,并且根据结合能的位置可以判断出各元素的价态分别为 Fe3+、Ni2+、Mg2+和 Cu2+,所有金属元素均位于尖晶石铁氧体的八面体位或四面体位,进一步证实了铜的成功掺杂,均合成了金属共掺杂型(Ni,Mg,Cu)Fe2O4.

图 4 样品的 XPS图谱.(a)不同 Cu掺杂量铁氧体的XPS全谱图;(b)Fe 2p的高分辨图谱;(c)Mg 2p的高分辨图谱;(d)Ni 2p的高分辨图谱;(e)Cu 2p的高分辨图谱Fig.4 XPS spectra of samples: (a) full XPS spectra of copper-doped ferrites; (b) Fe 2p high resolution spectra; (c) Mg 2p high resolution spectra; (d) Ni 2p high resolution spectra; (e) Cu 2p high resolution spectra
2.2 催化反应体系的选择与分析
为了确定合适的催化体系,我们选择未掺杂Cu的样品Ni0.63Mg0.30Cu0.07Fe2O4作为降解RhB溶液的催化剂.图5(a)是不同反应条件下RhB溶液(10 mg·L-1)的降解曲线.可以看出,当反应体系为光催化体系时,即“催化剂+可见光”体系,反应180 min后RhB溶液的降解效率仅为1.7%;当反应体系为异相类Fenton催化体系时,即“催化剂+H2O2”体系,反应180 min后RhB溶液的降解效率也仅为10.7%;表明催化剂在单独光照或H2O2条件下均不能有效提高降解效率.然而,将上述两个体系结合在一起,即在0.20 g催化剂和体积分数为1.0 % H2O2以及光照共同作用下(光助异相类Fenton体系“催化剂/H2O2/可见光”),RhB 溶液的降解效率大幅提高到73.1%,说明光催化氧化和类Fenton氧化协同作用提升了RhB溶液的降解效率.因此,本文RhB溶液降解实验中采用的最优催化体系为“(Ni,Mg,Cu)Fe2O4催化剂/H2O2/可见光”体系.
为了验证上述催化体系中降解RhB溶液的氧化剂是否为羟基自由基(·OH),选择对苯二甲酸作为·OH的捕获剂.由于·OH与对苯二甲酸在催化过程中生成的2-羟基对苯二甲酸具有极强的荧光活性,因此,通过荧光光谱就可以确定·OH生成量的变化趋势.图5(b)是2-羟基对苯二甲酸随反应时间的荧光光谱变化,可以看出,随着反应时间从0增加到120 min,荧光发射光谱最大强度(PL intensity)越来越高,说明催化体系中生成的·OH的浓度越来越大,进一步证实了在此异相光助类Fenton体系“(Ni,Mg,Cu)Fe2O4催化剂/H2O2/可见光”中催化剂表面产生的·OH是降解RhB溶液的主要原因.
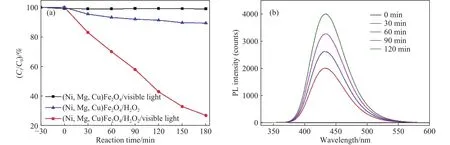
图 5 降解曲线及荧光光谱图.(a)不同催化反应体系中RhB溶液的降解曲线;(b)Ni0.63Mg0.30Cu0.07Fe2O4/H2O2/可见光催化体系捕获·OH产生2-羟基对苯二甲酸荧光光谱图Fig.5 Degradation curves and fluorescence spectra: (a) the degradation curves of RhB solutions in different catalytic reaction systems; (b) fluorescence spectra of 2-hydroxyterephthalic acid produced by the catalytic system of Ni0.63Mg0.30Cu0.07Fe2O4/H2O2/vis capturing ·OH radicals
2.3 不同Cu掺杂量对制备所得催化剂降解RhB溶液的影响
我们选择不同Cu掺杂量制备得到的铁氧体分别作为异相光助类Fenton催化剂降解RhB溶液.具体的催化实验条件如下:催化剂用量为0.20 g,H2O2体积分数为1.0%,pH值为6.0,RhB溶液质量浓度为10 mg·L-1.Cu掺杂量不同的催化剂降解RhB溶液的吸光度曲线如图6所示.可以发现,当Cu掺杂量最大时(即MNi∶Cu= 1∶1),合成的催化剂降解RhB溶液的吸光度在30~180 min内的各个阶段均低于未掺杂和MNi∶Cu= 1∶0.6的产物的吸光度,说明Cu掺杂量越大,相应铁氧体的催化降解效果在各个阶段均要好于其他两者,究其原因可能是相应体系中产生了较多强氧化性的·OH的缘故.

图 6 Cu 掺杂量不同的催化剂降解 RhB 溶液的吸光度曲线.(a)未掺杂;(b)MNi∶Cu=1∶0.6;(c)MNi∶Cu=1∶1Fig.6 Absorbance curves of RhB solution degraded by catalysts with different Cu doping: (a) undoped; (b) MNi∶Cu = 1∶0.6; (c) MNi∶Cu = 1∶1
基于图6(a~c)中不同反应时间RhB溶液的吸光度数据,按照公式(1)计算了催化剂对RhB溶液的降解效率η,计算结果如图7(a)所示.随着Cu掺杂量的增加,RhB降解效果增强.180 min后,未掺杂Cu的铁氧体对RhB溶液的降解效率为73.1%;当Cu掺杂量增加至MNi∶Cu=1∶06和1∶1时,所得催化剂对RhB溶液降解效率提高至88.8%和94.5%,说明Cu的掺杂可以增强铁氧体催化活性,对提高RhB溶液的降解率是有效的.此外,基于RhB溶液的降解反应可以近似认为是一级反应,根据公式(3)[21]计算得到了上述各个反应体系的表观速率常数(kapp,min-1),如图 7(b)所示.当 Cu掺杂量控制在MNi∶Cu=1∶1时,获得的铁氧体降解RhB溶液的kapp值最大,约为0.01424 min-1,是未掺杂铁氧体催化剂的两倍多,这一结果与图7(a)的降解结果相吻合.

图 7 降解曲线和动力学曲线.(a)不同Cu掺杂量的催化剂降解RhB溶液的曲线;(b)不同Cu掺杂量的催化剂降解RhB溶液的动力学特征曲线Fig.7 Degradation curves and kinetic curves: (a) RhB degradation by samples with different Cu doping amounts; (b) kinetic characteristics curves of RhB degradation by samples with different Cu doping amounts

其中,C0是 RhB 溶液的初始质量浓度,mg·L-1;Ct是在反应t时刻的RhB溶液质量浓度,mg·L-1;kapp是降解反应的表观速率常数,min-1.
2.4 Cu掺杂提高铁氧体(Ni,Mg,Cu)Fe2O4催化活性的原因探析
针对异相类Fenton催化体系“(Ni,Mg,Cu)Fe2O4催化剂/H2O2”而言,在降解RhB溶液的过程中主要发生下列反应过程,如反应式(4)~(6)所示[27-29].

基于前面XPS表征可知(图4),制备得到的铁氧体中铁以Fe3+形式存在.因此,催化剂表面的Fe3+(记为≡Fe3+)首先与溶液中的 H2O2反应生成Fe2+(记为≡Fe2+)和·OOH 自由基(反应式(4)),得到的≡Fe2+与 H2O2反应生成·OH 自由基(反应式(5)),最终·OH将溶液中的 RhB分子分解成CO2、H2O和小分子有机物(反应式(6)).由于类Fenton反应发生在液固界面,并且反应(4)的速率常数远小于反应(5),所以催化剂表面的≡Fe3+与H2O2反应生成≡Fe2+的过程是产生大量强氧化剂·OH的关键,也是催化降解的限制性环节.液固界面间缓慢的传质过程进一步减缓了≡Fe3+/≡Fe2+的转化,使得RhB溶液的降解效率仅为10.7%(图5).如何加速固体催化剂表面≡Fe3+向≡Fe2+的转化、促进H2O2分解生成大量·OH,成为提高异相类Fenton体系降解效率的关键.可见光辅助以及铜离子掺杂均被证明为提高降解率的有效手段.
当向上述体系中引入可见光照射时,异相类Fenton催化体系改进为光助类Fenton催化体系“(Ni,Mg,Cu)Fe2O4催化剂/H2O2/可见光”.由于合成的铁氧体禁带宽度较窄(约为1.27 eV),铁氧体吸收可见光产生光生电子(记为(Ni,Mg,Cu)Fe2O4(eCB-))和空穴(记为 (Ni,Mg,Cu)Fe2O4(hVB+))(反应式(7)).生成的eCB-可以还原催化剂表面的Fe3+成为≡Fe2+(反应式(8)),≡Cu2+成为≡Cu+(反应式(9)),且产生的≡Cu+能够还原≡Fe3+生成≡Fe2+(反应式(10))[30-32].上述三个反应的发生大大加速了固体催化剂表面上≡Fe3+向≡Fe2+的转化,使得Fenton过程持续进行,促进H2O2分解生成大量·OH,同时新产生的≡Cu+与 H2O2反应生成·OH(反应式(11)),从而有效降解RhB溶液.另外,生成的eCB-也有可能会与吸附在催化剂表面的H2O2反应产生·OH(反应式(12)),同时 hVB+与 H2O 反应也会产生·OH(反应式(13)),对于RhB溶液起到一定的降解作用.因此,基于上述分析,我们推测“(Ni,Mg,Cu)Fe2O4催化剂/H2O2/可见光”催化体系的反应机理如图8所示.


图 8 催化体系“(Ni,Mg,Cu)Fe2O4催化剂/H2O2/可见光”的反应机理图Fig.8 Reaction mechanism diagram of catalytic system “(Ni,Mg,Cu)Fe2O4 catalyst/H2O2/visible light”
为了进一步阐明随着Cu掺杂量的提高催化剂活性增强的原因,对合成的三种样品进行了XPS分析,定量表征Cu掺杂对铁氧体中不同阳离子占位的影响,如图4所示.研究表明[15],八面体位的金属离子几乎完全裸露在尖晶石铁氧体的表面,且只有这些位点参与反应.即尖晶石型铁氧体仅八面体位的可变价离子才能参与催化反应,故尖晶石型铁氧体的催化性能主要取决于其结构中的八面体位的阳离子数量,并且占据八面体位的可变价过渡金属阳离子数量越多,其催化活性越强.因此,对于我们制备的三种不同铜含量的催化剂而言,占据八面体位的铁离子和铜离子越多,越易与H2O2反应生成大量强氧化性的·OH,有利于RhB溶液降解率的提高.
图4(b~e)为不同Cu掺杂量合成铁氧体的Fe 2p、Mg 2p、Ni 2p以及 Cu 2p高分辨 XPS曲线,根据各元素的分峰拟合结果可以发现,随着Cu掺杂量的增加,FeOct3+的相对含量从72.4%增加到84.6%,CuOct2+的相对含量从32%提高至65.5%;但是相应的,MgOct2+的相对含量从53.6%降低到48.0%,NiOct2+的相对含量从77.1%降低到67.3%,表明随着Cu掺杂量的增大,Mg2+和Ni2+从八面体位向四面体位迁移,也就是说Cu2+的引入主要占据了原八面体位的Ni2+和Mg2+的位置.具体结果如图9所示.
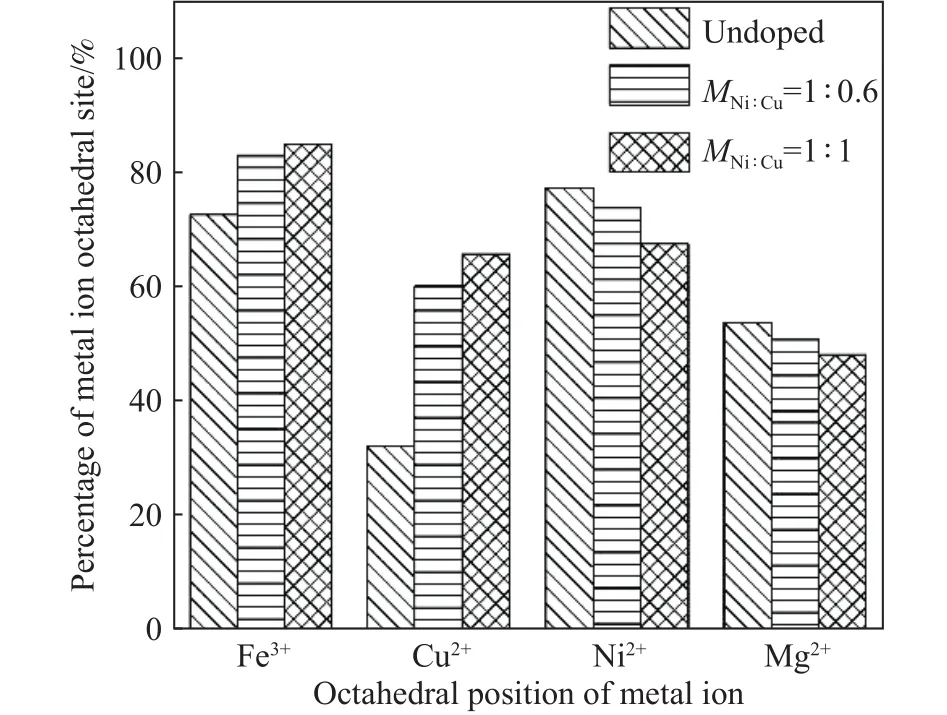
图 9 不同Cu掺杂量铁氧体中金属离子八面体位占比图Fig.9 Percentages of metal ion octahedral positions in ferrites with different copper doping amounts
综合XPS结果及催化体系“(Ni,Mg,Cu)Fe2O4催化剂/H2O2/可见光”的反应机理可知:随着Cu掺杂量的增多,裸露在(Ni,Mg,Cu)Fe2O4铁氧体表面八面体位的Fe3+和Cu2+的数量增多,使得类Fenton反应过程中产生·OH的反应更易于发生;同时由于Cu2+/Cu+电对的标准电极电位值(Eϴ(Cu2+/Cu+)=0.166 V)小于 Fe3+/Fe2+的电极电位值(Eϴ(Fe3+/Fe2+)=0.770 V),说明≡Cu2+在类Fenton反应过程中生成的≡Cu+能够加快≡Fe3+向≡Fe2+的转化.总之,占据尖晶石铁氧体八面体位的Cu2+与八面体位的Fe3+协同作用促进了·OH的快速生成,最终提高了尖晶石铁氧体的催化活性(RhB溶液的降解效率从73.1% 增加到94.5%(图 7)).
3 结论
(1)采用共沉淀-煅烧法,通过向经过除铁预处理的硫化镍精矿浸出液中添加CuCl2·2H2O,制备得到了纯相尖晶石铁氧体(Ni,Mg,Cu)Fe2O4异相类Fento n催化剂.不同Cu掺杂量尖晶石铁氧体的化学式分别为Ni0.63Mg0.30Cu0.07Fe2O4、Ni0.48Mg0.21Cu0.31Fe2O4和 Ni0.24Mg0.15Cu0.61Fe2O4,其粒径约为200~300 nm.
(2)确定了最佳催化体系为“(Ni,Mg,Cu)Fe2O4/H2O2/可见光”,阐明了该体系降解RhB溶液的反应机理.在 25 ℃、催化剂用量为 1.00 g·L-1、H2O2体积分数为1.0 %和光照强度为180 mW·cm-2的条件下,MNi∶Cu=1∶1铁氧体对 10 mg·L-1RhB 溶液的降解效率最佳,达到94.5%.
(3)研究表明,随着Cu掺杂量的增加,铁氧体中CuOct2+和FeOct3+的相对含量增多,MgOct2+和NiOct2+的相对含量减少,占据尖晶石铁氧体八面体位的Cu2+与八面体位的Fe3+协同作用促进了反应体系((Ni,Mg,Cu)Fe2O4催化剂/H2O2/可见光)中·OH 的快速生成,最终提高了Cu掺杂铁氧体的催化活性.
