溶藻弧菌PEPCK蛋白原核表达及其乙酰化、琥珀酰化修饰的鉴定
2021-06-23曾福源苏泽辉周诗慧谢妙庞欢瑛
曾福源 苏泽辉 周诗慧 谢妙 庞欢瑛
(1.广东海洋大学深圳研究院,深圳 510000;2.广东海洋大学水产学院 广东省水产经济动物病原生物学及流行病学重点实验室广东省教育厅水产经济动物病害控制重点实验室,湛江 524088)
磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)作为糖异生过程中的一个关键代谢酶,催化草酰乙酸转变为磷酸烯醇式丙酮酸和二氧化碳,是几乎所有生物体糖异生中所必须的[1-2]。根据草酰乙酸无机磷酸盐供体的来源,PEPCK可分成ATP依赖性、GTP依赖性和PPi(inorganic pyrophosphate,PPi)依赖性 3 种类型[3-5]。该酶参与的代谢过程,在生物体血糖水平[6]、毒力调控[7]、抗病毒[8]。等方面均具有十分重要的作用,在不同生物的碳代谢中也具有不同的生理作用[9]。此外,还能刺激机体产生免疫反应,是一种很好的疫苗候选分子[10-11]。
蛋白质乙酰化是一种常见的翻译后修饰方式,参与转录、新陈代谢、趋化作用、细胞信号转导等多个生物学过程,并发挥着关键的调控作用[12]。乙酰化通过多种机制调节代谢酶活力,对代谢具有广泛的调控功能[13]。乙酰化修饰代谢酶可对糖酵解和糖异生代谢方向进行调控,如增加GapA(磷酸脱氢酶)的乙酰化程度可以增强菌体糖酵解活性,同时降低葡萄糖新生的能力[14]。在鼠伤寒沙门菌中,蛋白质乙酰化修饰参与了细菌毒力的调控及其体外诱导株耐药性的产生[15-16]。
蛋白质赖氨酸琥珀酰化是琥珀酰基供体通过酶学或非酶学的方式将琥珀酰基团共价结合到赖氨酸残基的过程[17],是近年来颇受关注的一种翻译后修饰。琥珀酰化和乙酰化通常具有较多的重叠位点,与乙酰化修饰相比,琥珀酰化修饰更能促进蛋白质的结构和功能发生变化[18]。琥珀酰化修饰广泛存在于细胞核及细胞质中[19-20],参与糖酵解、三羧酸循环、电子传递链等多种细胞代谢过程中关键酶活性的调控[21]。在结核分枝杆菌琥珀酰化修饰组学图谱中,许多代谢酶及抗生素耐药相关蛋白发生了琥珀酰化修饰[22]。
溶藻弧菌(Vibrio alginolyticus)是隶属于弧菌科弧菌属的嗜盐嗜温性革兰氏阴性杆菌,广泛分布于海洋、河口、海水养殖池等水体环境中[23],是鱼、虾、贝类的主要病原菌,给海水养殖业带来了巨大的经济损失[24-26]。免疫蛋白质组学发现PEPCK蛋白具有免疫原性,为溶藻弧菌、哈维氏弧菌及副溶血性弧菌的交叉免疫原蛋白,是亚单位疫苗的候选抗原[27]。此外,PEPCK与溶藻弧菌的耐药性密切相关[28]。最近报道的弧菌乙酰化、琥珀酰化修饰组学图谱中也发现了PEPCK,但其修饰特性尚未得到验证[29-30]。本研究通过构建溶藻弧菌PEPCK蛋白的原核表达载体,优化其表达条件,并对其乙酰化及琥珀酰化修饰进行鉴定,旨为进一步探究PEPCK的乙酰化和琥珀酰化修饰对溶藻弧菌的毒力及耐药性的影响奠定基础。
1 材料与方法
1.1 材料
溶藻弧菌HY9901、大肠杆菌DH5α、BL21(DE3)和表达载体pET-28a均由本实验室保存。T4 DNA连接酶、EcoR I和Xho I限制性核酸内切酶购自TaKaRa公司;细菌基因组抽提试剂盒、核酸切胶回收试剂盒购自全式金生物技术有限公司;异丙基 -β-D-硫代半乳糖苷(isopropyl β-D-thiogalactopyranoside,IPTG)购自上海生物工程技术服务有限公司;鼠抗乙酰化赖氨酸抗体(antiacetyllysine mouse mAb(clone Kac-01),#PTM-101)、鼠抗琥珀酰化赖氨酸抗体(anti-succinyllysine mouse mAb(clone 3D3),PTM-419)购自杭州景杰生物科技有限公司;辣根过氧化物酶标记山羊抗小鼠 IgG(H+L,#A0216)和His标签蛋白纯化介质BeyoGold His-tag Purification Resin(耐变性剂型)购自上海碧云天生物技术有限公司;ECL显色液(ClarityTMWestern ECL Substrate)购自Bio-Rad公司。
1.2 方法
1.2.1 pepck基因的克隆 将HY9901菌株加入100 mL TSB培养基中,当OD600nm达0.8时,使用细菌基因提取试剂盒,按说明书提溶藻弧菌HY9901的DNA。根据GenBank上溶藻弧菌pepck基因序列(No:MT683849)设计分别含EcoR I和Xho I酶切位点的正反链引物,正链引物F:CCGGAATTCATGACCGTTATGGAACAT(下划线为EcoRI酶切位点),反链引物R:CCGCTCGAGATCAATCTGAGGACCAGC(下划线为XhoI酶切位点)。以溶藻弧菌HY9901的DNA为模板链扩增pepck基因,PCR反应程序:95℃预变性 5 min;95℃变性 30 s,62℃退火 30 s,72℃延伸 1.5 min,33个循环;72℃延伸 10 min。PCR产物经1%琼脂糖凝胶电泳,按照DNA凝胶回收试剂盒的说明进行纯化。
1.2.2 pET-28a-pepck表达载体的构建 根据质粒提取试剂盒说明提取pET-28a质粒,经EcoRI和XhoI酶切,用T4DNA连接酶将切胶回收的产物与酶切后的pET-28a置于4℃冰箱中连接过夜。连接成功后转入大肠杆菌BL21(DE3),经无抗性的LB培养基培养1 h后涂布于LB平板(含Kana 100 μg/mL),挑取单菌落,接种于 800 μL LB(含 Kana 100 μg/mL)培养基中,于37℃条件下振荡培养过夜,进行菌液PCR鉴定。鉴定引物序列为F:TGCTAGTTATTGCTCAGCGG,R:TAATACGACTCACTATAGGG。挑取阳性菌液送至生工测序。
1.2.3 PEPCK蛋白的诱导表达 按体积比1∶100的比例,将含pET-28a-pepck重组质粒的大肠杆菌BL21(DE3)接种于 LB(含 Kana 100 μg/mL)培养液中,于37℃条件下200 r/min振荡培养至OD600nm为0.4-0.6时,加入IPTG至终浓度为1 mmol/L,于37℃条件下200 r/min继续振荡培养12 h。取1 mL培养物,12 000×g室温离心2 min,弃上清,用1 mL PBS洗涤两遍。加入 50 μL PBS和 10 μL 6× 蛋白上样缓冲液重悬菌体,水煮法提取细菌蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳分析。对照组为IPTG的pET-28a、不含IPTG的pET-28a、pET-28a-pepck,处理方法与实验组一致。
1.2.4 PEPCK蛋白表达条件优化 采用控制变量法,对不同温度、IPTG浓度和时间条件下重组菌株的PEPCK蛋白表达效果进行比较。当OD600nm达0.4-0.6时开始诱导。
温度:设置28℃和37℃两个温度,在IPTG浓度为0.2 mmol/L条件下振荡培养10 h,收集10 mL菌液,4℃ 6 000 r/min离心30 min,弃上清,用6 mL的PBS吹匀、洗涤两遍后悬浮菌体。置于冰水混合物中超声波破碎重组细菌,破碎程序设置为:功率300 W,超声开时间5 s,超声关时间8 s,超声破碎10 min至菌液清澈透亮即可。离心、分装上清和沉淀,沉淀用8 mol/L尿素在4℃条件下浸泡过夜,各取50 μL并分别加入10 μL 6× 蛋白质上样缓冲液,充分混匀后以10 μL/孔的上样量进行SDS-PAGE电泳,经考马斯亮蓝R250染色、脱色液(40%乙醇,10%冰醋酸,50%双蒸水)脱色,最后使用Gel-pro Analyzer分析结果。
IPTG浓度:在28℃,诱导时间为10 h的条件下,IPTG浓度设置为0、0.2、0.4、0.6、0.8、1.0 mmol/L。菌液收集、处理及分析如1.2.3的步骤。
时间:在28℃,IPTG浓度为0.2 mmol/L的条件下,诱导时间设置为0 h、2 h、4 h、6 h、8 h、和10 h。菌液收集、处理及分析如1.2.3的步骤。
1.2.5 His-PEPCK蛋白的纯化 经最优诱导条件诱导后,收集菌液、提取蛋白,采用His标签蛋白纯化介质过柱纯化。将蛋白与填料在4℃条件下孵育过夜,随后加入纯化柱中,按碧云天公司的His标签蛋白纯化介质使用说明书操作。
1.2.6 Western blot验证PEPCK蛋白的乙酰化及琥珀酰化 取纯化后的PEPCK蛋白,加入Loadind Buffer混匀,取10 μL进行SDS-PAGE,电泳条件:5%浓缩胶,80 V 30 min;10%分离胶,120 V 90 min。使用转印仪将PEPCK蛋白转印至PVDF膜,条件为:200 mA,90 min。加入含5%脱脂奶粉的TBST溶液,置于4℃冰箱封闭过夜,TBST漂洗4次,每次10 min。分别加入2 μL景杰生物科技有限公司的鼠抗乙酰化赖氨酸抗体和鼠抗琥珀酰化赖氨酸抗体(1∶5 000),37℃孵育2 h,TBST漂洗4次,每次10 min。加入1 μL碧云天生物技术有限公司的辣根过氧化物酶标记的山羊抗小鼠IgG(1∶10 000),37℃孵育2 h,TBST漂洗4次,每次10 min。经ECL显色液显色后,使用全自动化学发光图像分析系统(TAN 5200)拍照、记录实验结果。
2 结果
2.1 pepck基因的克隆
挑取单克隆进行菌落PCR扩增得到目的片段,经凝胶电泳检测条带大小约1 629 bp(图1),与pepck ORF大小一致,表明pepck基因克隆成功。
2.2 重组质粒pET-28a-pepck的构建
pepck基因片段与pET-28a质粒成功重组后,转入大肠杆菌BL21(DE3),挑取单克隆进行菌落PCR鉴定,结果获得1 989 bp的特异性条带,与预期结果一致(图2)。经测序未发现pepck有错配或突变,证明原核表达载体pET-28a-pepck构建成功。
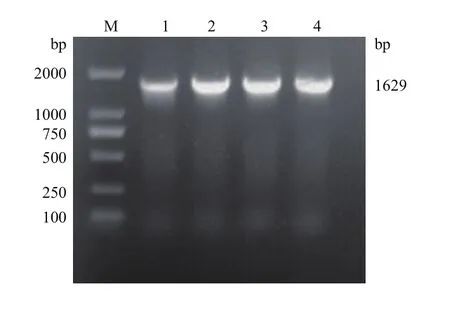
图1 pepck基因的克隆Fig.1 Cloning of pepck gene
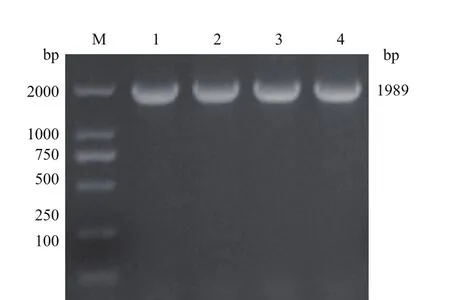
图2 构建pET-28a-pepck载体Fig.2 Construction of pET-28a-pepck vector
2.3 诱导PEPCK蛋白表达
成功构建的重组菌株经IPTG诱导可表达相对分子质量约60.9 kD的PEPCK融合蛋白(图3),其中PEPCK的预计分子量60.1 kD,pET-28a表达的融合标签为0.8 kD。对照组均未表达PEPCK蛋白。
2.4 PEPCK蛋白表达条件优化
2.4.1 温度对重组蛋白表达的影响 当诱导温度为28℃时,PEPCK的融合蛋白、可溶性蛋白及包涵体蛋白均有表达(图4);当诱导温度为37℃时,PEPCK融合蛋白、包涵体蛋白表达量较28℃时高,但在可溶性蛋白中几乎为零。
2.4.2 IPTG浓度对重组蛋白的影响 结果显示,PEPCK蛋白在浓度为0.2 mmol/L-1.0 mmol/L的IPTG诱导下表达量无显著差异,表明IPTG浓度变化对PEPCK表达量无明显影响(图5)。
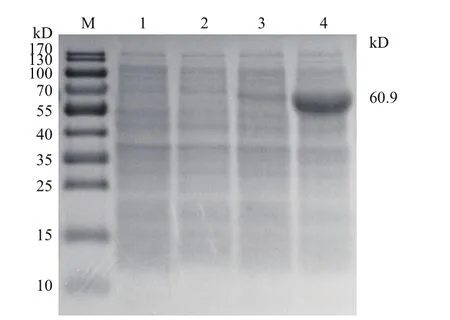
图3 PEPCK蛋白SDS-PAGE电泳分析Fig.3 SDS-PAGE analysis of PEPCK protein
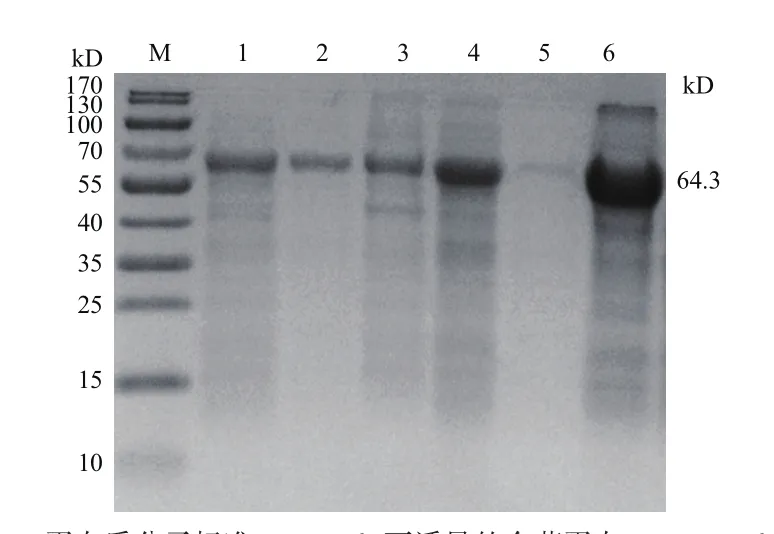
图4 温度对PEPCK蛋白表达的影响Fig.4 Influence of temperature on the expression of PEPCK protein
2.4.3 诱导时间对重组蛋白的影响 PEPCK蛋白表达量随诱导时间增长呈现出先增加后稳定的趋势,在8 h表达量达到最大(图6)。综上,PEPCK蛋白最佳表达条件为28℃、0.2 mmol/L的IPTG诱导8 h。
2.5 His-PEPCK蛋白的纯化
融合蛋白经his亲和层析柱纯化后,经SDSPAGE进行检验。结果显示,在洗脱液浓度为250 mmol/L时可获得大量纯化蛋白(图7)。
2.6 PEPCK蛋白的乙酰化及琥珀酰化修饰的鉴定
分别使用抗乙酰赖氨酸抗体和抗琥珀酰赖氨酸抗体进行Western-blot分析,鉴定PEPCK的乙酰化、琥珀酰化修饰。结果显示,PEPCK蛋白具有乙酰化(图8-A)和琥珀酰化修饰(图8-B)。
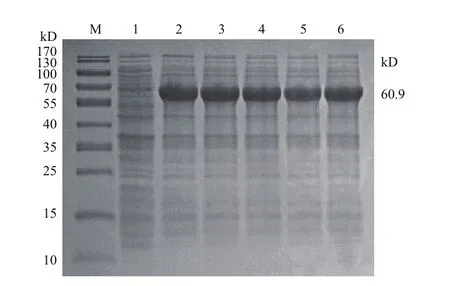
图5 IPTG浓度对PEPCK蛋白表达的影响Fig.5 Influence of IPTG concentration on the expression of PEPCK protein

图6 诱导时间对PEPCK蛋白表达的影响Fig.6 Influence of induction time on the expression of PEPCK protein
3 讨论
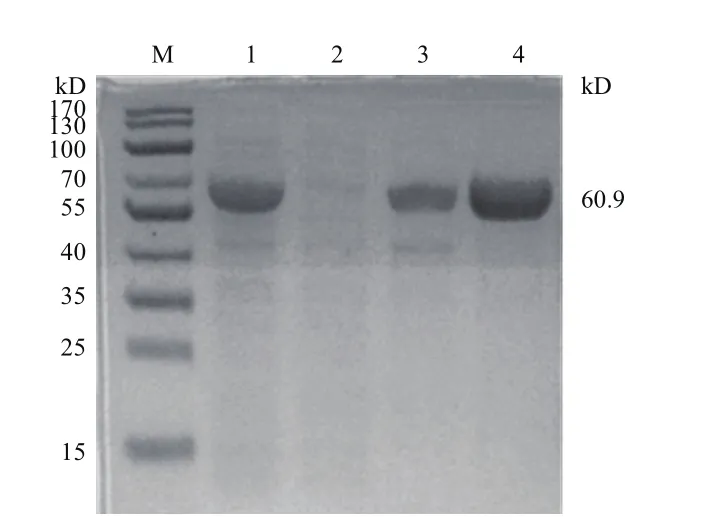
图7 PEPCK蛋白的纯化Fig.7 Purification of PEPCK protein

图8 PEPCK蛋白的乙酰化(A)及琥珀酰化(B)鉴定Fig.8 Acetylation and succinylation identification of PEPCK protein
随着基因表达技术的不断进步和发展,人们不仅关注蛋白的表达量,更注重正确的翻译后折叠、修饰,使表达蛋白的活性和稳定性更高[31]。温度是大肠杆菌生长代谢的重要影响因子,低温条件下蛋白质的合成速率降低,疏水作用降低,多肽折叠的动力学改变可以增加正确折叠的蛋白含量[32],并及时将产生的前蛋白运输到周质腔或培养基,降低了形成包涵体、阻碍蛋白分泌的几率[33]。在37℃时大肠杆菌生长最快,细胞膜流动性和蛋白合成速率增加,但胞内前蛋白堆积过多会导致包涵体的形成增加[34]。本研究设置28和37℃两个温度,相比之下诱导温度为28℃时PEPCK蛋白表达效果更佳。采用不同IPTG浓度进行诱导,在0.2 mmol/L-1.0 mmol/L范围内蛋白表达量无明显变化,这与彭传林等[35]发现IPTG浓度对家蝇抗真菌肽(MAF-1)目的蛋白的表达无显著影响相符,因此实验过程中使用0.2 mmol/L的IPTG即可。溶藻弧菌PEPCK蛋白的表达量随诱导时间的增长,呈先增加后稳定的趋势,诱导8 h时达到峰值,而陈立明等[36]发现DTD蛋白诱导5 h表达量最高,可能是因为不同蛋白之间存在差异,导致所需的诱导时间不一致。
蛋白质组学的突起,尤其是质谱仪灵敏度、速递和自动化的大幅提升,使蛋白质翻译后修饰大规模化研究成为可能[37]。赖氨酸乙酰化是一种普遍存在的蛋白调控方式,能对细胞中的蛋白质,特别是对代谢酶进行精确调控[38-39]。细胞中这种精确调控的实现,得益于赖氨酸乙酰化酶和去乙酰化酶的相互作用[40]。在霍乱弧菌中,醋酸的代谢受去乙酰化酶的调节,该酶的缺失会导致其对黑腹果蝇的毒力降低[41]。此外,乙酰化修饰转录因子如CRP、PhoB可直接参与霍乱弧菌毒力的调节[42]。随着各种翻译后修饰的发现,越来越多的研究表明赖氨酸乙酰化修饰与琥珀酰化修饰具有高度重合的现象,共同影响代谢途径中蛋白质的结构和功能[43]。已知PEPCK与副溶血弧菌的耐药性及毒力相关,且具有乙酰化和琥珀酰化修饰[30,44]。PEPCK作为溶藻弧菌糖代谢中的关键酶,在辅助因子乙酰辅酶A的作用下,乙酰转移酶催化其赖氨酸残基发生乙酰化修饰[45]。而发生在赖氨酸残基上的琥珀酰化可促进更多蛋白质化学性质发生改变,在生理pH下电荷从+1到-1,进而促进蛋白质结构和功能的调整[46]。大肠杆菌也含有赖氨酸乙酰化转移酶和琥珀酰基供体,利用大肠杆菌重组表达PEPCK蛋白时可在其赖氨酸残基上进行乙酰化和琥珀酰化修饰[47]。此外,通过比较大肠杆菌中已发现的乙酰化位点及琥珀酰化位点,有66%是重叠的,表明两种修饰可以发生在同一位点上[48],因此实验结果中PEPCK蛋白同时具有乙酰化修饰和琥珀酰化修饰是合理的。
总的来说,本研究使用鼠抗乙酰化赖氨酸抗体、鼠抗琥珀酰化赖氨酸抗体作为一抗,验证了溶藻弧菌PEPCK既有乙酰化修饰,又有琥珀酰化修饰,为进一步探究PEPCK的乙酰化和琥珀酰化修饰对溶藻弧菌的毒力及耐药性的影响奠定了基础。
4 结论
成功构建溶藻弧菌PEPCK重组表达菌株,其最优诱导表达条件为0.2 mmol/L IPTG,28℃诱导8 h;经鉴定PEPCK蛋白具有乙酰化修饰和琥珀酰化修饰。