微生物电合成生产中链脂肪酸的基本原理及研究进展
2021-06-23褚娜蒋永曾建雄
褚娜 蒋永 曾建雄
(福建农林大学,福州 350002)
化石燃料的开采使用带来经济的高速发展,但是化石燃料储量有限,并造成人为CO2排放等环境问题[1]。利用清洁能源驱动CO2催化转化为有机化合物可实现清洁能源的有效开发和储存,并降低CO2排放。微生物电合成(microbial electrosynthesis,MES)能够利用电极提供还原力驱动微生物将CO2还原为多碳、胞外有机化合物[2]。MES技术发明于2009-2010年,国内MES技术研究发展基本与国际同步。2009年,黄霞课题组报道在光照下,生物阴极能够固定CO2产生生物质[3];同年,成少安教授报道基于混菌的生物阴极能够还原CO2产生甲烷[4]。2010年,Lovley课题组研究表明产乙酸菌Sporomusa ovata能够从石墨电极获得电子将CO2还原为乙酸,并正式定义了微生物电合成技术[5]。2012年,May课题组和李大平课题组分别报道基于混菌的生物阴极可以还原CO2产生乙酸以及甲烷[6],并探究了阴极电位对产物的影响[7]。在电化学促进有机物的微生物转化方面,2013年Rabaey课题组发现电流作用下,微生物转化甘油时通过碳链延长产生戊酸[8]。
中链脂肪酸(medium-chain fatty acids,MCFAs)是指由6-12个碳原子构成的一元饱和羧酸,包括己酸(C6H12O2)、庚酸(C7H14O2)、辛酸(C8H16O2)、壬酸(C9H18O2)、癸酸(C10H20O2)、十一酸(C11H22O2)和十二酸(C12H24O2)。与短链脂肪酸(如乙酸:0.60$/kg[9])相比,MCFAs具有更高的市场价值(如己酸:3.82 $/kg[9]),以及更强的疏水性(如己酸:10.82 g/L,而癸酸、十一酸和十二酸几乎不溶于水[10]),因此MCFAs的分离成本更低。MCFAs是重要的化工原料和农用产品,能够制造抗菌剂、润滑油和香料,并应用于畜禽产品的防腐保鲜[11]。
MCFAs的传统产生方法主要依靠石油衍生物或生物质提取[12]。石油衍生物途径污染严重且不可持续;生物质提取途径来源有限且浓度较低(如椰子和棕榈仁等提取的MCFAs占总脂肪酸的7.9%-15%[13])。因此,探究无污染、可持续途径高效产生MCFAs至关重要。微生物生产MCFAs主要包括有机废弃物厌氧发酵以及MES催化转化C1废气两种方法,其中,厌氧发酵中的有机废弃物主要包括城市固体废弃物[14]、污泥发酵液[15]、餐厨垃圾[16]、酿酒废水[17]等,MES中的C1废气主要是和合成气[19]。
MES催化转化CO2生产MCFAs的原理如图1所示,即MES转化CO2为乙酸和乙醇,再利用这些中间产物二次发酵(secondary fermentation),即进行碳链延长(chain elongation)产生MCFAs。MES生产MCFAs可望获得比传统有机废弃物厌氧发酵途径更高的能量效率:MES中可再生能源直接用于捕获并转化CO2;而厌氧发酵途径通过固定CO2形成生物质,再转化生物质获得目标产物。此外,MCFAs的能量密度、价格均高于甲烷和乙酸等MES常见产物,MES生产MCFAs可望推进MES技术的实用化。

图1 MES耦合二次发酵过程产生MCFAsFig.1 MES coupled with secondary fermentation for producing MCFAs
现有综述多介绍MES产生甲烷或乙酸的相关微生物、电子传递或调控方法[20-22]。本综述通过总结MES催化转化C1废气并耦合二次发酵过程进行碳链延长产生MCFAs的研究现状,分析主要代谢路径及涉及的功能微生物、电极材料和关键运行参数,探讨MES特异性产生MCFAs的有效策略。
1 代谢路径及功能微生物
1.1 代谢路径
MES转化CO2产生MCFAs的主要代谢路径如图2所示:首先通过还原性乙酰辅酶A途径(Wood-Ljungdahl pathway,WLP)产生乙酰辅酶A;进而产生乙酸和乙醇;最后通过逆β氧化途径(reversed β-oxidation,R-Box)产生 MCFAs[13]。
每个R-Box周期,乙酰辅酶A均会偶联其他辅酶A衍生物经过一系列反应形成增加两个碳的新辅酶A衍生物(图2-B)[23]。在乙酸增长为丁酸的逆β氧化周期,乙酰辅酶A偶联另一个乙酰辅酶A在乙酰乙酰辅酶A硫解酶的作用下生成乙酰乙酰辅酶A。在一系列酶促反应下生成丁酰辅酶A,乙酸辅酶A转移酶催化丁酰辅酶A的辅酶A转移到乙酸上形成乙酰辅酶A,进而产生丁酸。电子供体氧化阶段生成的乙酰辅酶A与本次逆β氧化形成的丁酰辅酶A作用形成已酰辅酶A,开始丁酸增长为己酸的逆β氧化周期[23]。以此类推,乙酸能够增长为丁酸、己酸、辛酸、癸酸和十二酸,而丙酸则能够增长为戊酸、庚酸、壬酸和十一酸。

图2 乙酸和乙醇产生路径(A) 和逆β氧化循环(B)[23-24]Fig.2 Pathway for producing acetate and ethanol(A), the reverse β oxidation(B)[23-24]
1.2 功能微生物
MES通过产乙酸菌与碳链延长菌协同作用产生MCFAs,所涉及的主要功能微生物如表1所示。目前,已经分离出100多种产乙酸菌[25]。在MES中,多种产乙酸菌(纯菌和混菌)均能够从阴极获得电子转化 CO2产生乙酸[22],如 Acetobacterium、Sulfurospirillum和Desulfovibrio等均能够利用电子产生乙酸[18,26-27]。纯培养实验表明多种产乙酸菌,包括Sporomusa ovata[5]、Clostridium ljungdahlii 和 Clostridium aceticum 及 Moorella thermoacetica[2]可从阴极获取电子产生乙酸。共培养实验表明硫酸盐还原菌Desulfopila corrodens能够利用阴极产生的电子以及氢气作为中介体,而Acetobacterium woodii消耗产生的氢气形成乙酸[28]。多种产乙酸菌,如Clostridium autoethanogenum、Clostridium ljungdahlii和 Clostridium ragsdalei等均能够利用CO2和H2为底物产生乙醇[29]。Clostridium thermoaceticum能够还原乙酸为乙醇[30],Thermoanaerobacter pseudoethanolicus能 还 原有机酸为对应的醇[31],Thermoanaerobacter ethanolicus利用乙酸产生乙醇[32]。
厌氧发酵产生MCFAs主要使用乙醇和乳酸两种电子供体,而MES产生MCFAs尚未见乳酸作为电子供体的报道。野生型Clostridium spp.的纯菌能够进行碳链延长产生MCFAs,如Clostridium kluyveri和Clostridium sp.BS-1[33]等。野生型菌株 Clostridium kluyveri是脂肪酸产生和氧化的模式微生物[34],能够利用实际废弃有机物,比如合成气发酵液(主要成分为乙酸和乙醇)作为底物高效生产MCFAs[35]。Clostridium sp.BS-1能够利用多种有机物(如葡萄糖、淀粉等)作为底物,进行碳链延长产生MCFAs[36]。混菌具有操作步骤简单,不需要灭菌等优点。MES使用混菌生产高附加值产物,受到环境工程领域学者的广泛关注。Clostridium spp.是利用复杂底物产生MCFAs的重要微生物,如利用啤酒[37]、中国黄水[38]等进行发酵。Clostridium_sensu_stricto是产生己酸的关键微生物,能够利用乙醇作为电子供体进行碳链延长[17]。许多研究表明,Clostridium spp.是MES碳链延长产生MCFAs的优势菌群。在MES中,使用Clostridium spp.为优势菌的混菌能够实现同时产酸、产醇以及碳链延长产生MCFAs[39]。在MES中,使用混菌以CO2为底物进行碳链延长时,发现Clostridium spp.是生物膜以及悬浮微生物中的优势菌群[18];以乙酸盐为底物时,发现Clostridium spp.作为优势菌的混菌能够进行碳链延长产生MCFAs[40]。
从胞外固相载体(通电电极以及共生或互生微生物菌群领域的微生物细胞等)中摄取胞外电子的亲电微生物(electroautotrophic microorganisms)是MES的核心微生物,亲电微生物的电子摄取能力和代谢特性直接影响MES产生MCFAs的能量转换效率[41],而功能菌的富集能够提高反应器性能[42]。表1中MES产生MCFAs涉及的微生物是否为亲电微生物,或者与亲电微生物的互作关系还有待研究。因此,在MES中优化亲电微生物与碳链延长微生物的种群结构和空间分布,有望实现MES高效产生MCFAs。

注:-:未报道数据;a:依据MCFAs的电子产生与底物以及电极的电子消耗计算; b:液体产品中MCFAs的电子回收率Note: -: Not available.a: Calculated based on the electron recovery in MCFAs and the electron consumption donated from substrate andelectrode.b: Calculated basedonelectronrecovery in MCFAs andall identified liquid chemicals.
2 电极材料及反应器结构
在MES产生MCFAs的过程中,电极材料以及反应器构型设计对于提高产物生成效率至关重要。构建新型MES反应器以连续运行,增强传质和电子传递,有利于进一步评估MES产生MCFAs的性能。
MES中微生物以CO2为底物从阴极获取电子产生化学品,不同阴极材料下的产物产生效率不同[48]。例如,中空纤维膜阴极是极具潜力的阴极材料,有利于促进气体传质和触发界面电化学反应[49]。复合阴极材料能够增强生物电化学还原CO2性能(图3-A),并且提高乙酸产生浓度[50]。以上阴极材料均已成功应用于MES以提高乙酸产生效率,但是微生物合成MCFAs的步骤更为复杂,以上阴极材料能否促进MES产生MCFAs还有待研究。如表1所示,反应器在不同电极材料下产生MCFAs的性能不同。反应器构型优化有望促进电子传递以及增加产物产生速率,加速产物分离以及产品回收。如图3-B所示[51],连续搅拌反应器能够促进传质以及出水循环,升流式反应器有利于微生物保持悬浮状态,反应器三室结构方便产物提取与分离等。因此,使用新型阴极材料以及反应器构型进行有效的生物反应器设计,提高产物产生效率的同时促进产物选择性分离,有望促进MES高效产生MCFAs。
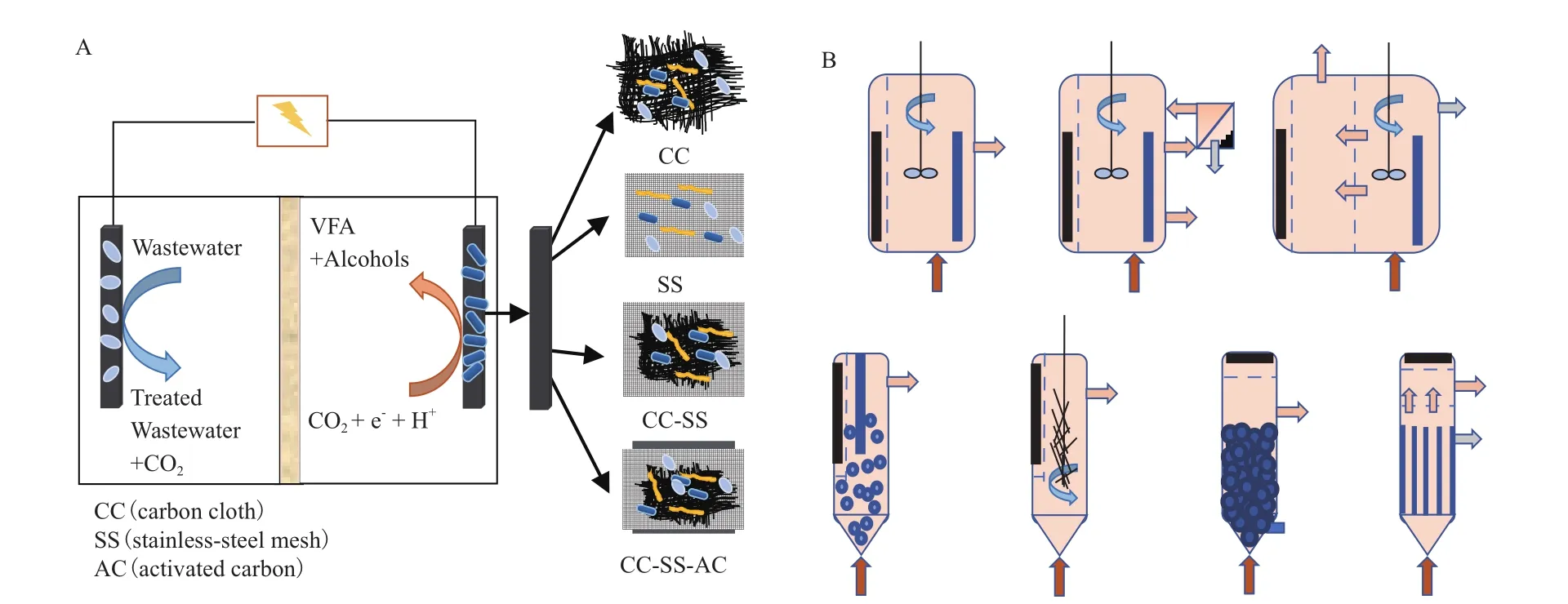
图3 不同(A)电极材料[50],(B)反应器构型[51]用于MESFig.3 Electrode materials[50]and reactor configurations[51]used in MES
3 关键运行参数
关键运行参数(电子供体和电子受体负荷、电极电势、pH和气体分压等)影响微生物催化剂的组成及活性,进而对MES产生MCFAs带来影响。如何综合调控MES的关键运行参数,实现高速转化CO2合成MCFAs,尚需深入研究。
3.1 电子供体和电子受体
电子供体和电子受体直接影响MES产生MCFAs。在MES碳链延长过程中,仅以CO2为电子受体,以电极为电子供体时,MCFAs的延滞期较长,且产物产生速率较低[18,43](表1)。与效率低的H2或电极相比,乙醇被认为是最适合碳链延长的电子供体之一[23]。在MES转化CO2的过程中,加入乙醇电子供体,明显增加MCFAs选择性以及最大MCFAs产量,最终MCFAs浓度达到7.66 g/L[45](表1)。研究表明,乙醇和氢气的电子供体组合比单独使用乙醇产生MCFAs的浓度更高[52]。当CO作为电子供体时,加入乙酸或丁酸电子受体能够提高MCFAs产量[53]。
在设定的乙醇和乙酸比例中,乙醇与乙酸比例越高越有利于产生辛酸盐[54]。当初始乙醇浓度为 28.8 g COD/L(0.3 mol/L,13.82 g/L)时, 抑 制MCFAs产生;而且乙醇/乙酸底物比例越高,微生物碳链延长产生辛酸/己酸的比例越高[55]。CO2/CO比例[19]以及 CO2/H2比例[23]能够影响 MCFAs的产物选择性。因此,通过调控多种电子供体(电极、H2、CO和乙醇等)和电子受体(CO2、甲酸和乙酸等)的组合及比例,有利于促进MES产生目标MCFAs。
3.2 电极电势
电极作为MES中的固体电子供体,阴极的电极电势对微生物代谢具有较大影响[56]。成少安教授[4]发现阴极电位低于-0.700 V(本文出现的电极电势均相对于Ag/AgCl参比电极)时,微生物能够还原CO2为甲烷。李大平课题组以CO2为底物,MES的阴极电位在-0.850 V到-0.950 V之间时,只产生CH4和H2;而当阴极电位低于-0.950 V时,主要产物为CH4和乙酸[7]。有研究在-1.0 V电位下进行MES,微生物转化CO2主要产生乙酸[57]。在-1.047 V的阴极电位下,MES使用生物膜以连续流模式运行能够转化CO2产生 MCFAs[43];增加 CO2加载速率以及水力停留时间能够增强丁酸和己酸的产物选择性[44]。
MES中,电极电势会影响多种反应参数,如氧化还原电位(oxidation-reduction potential,ORP)环境和析氢速率等,并对气体分压以及阴极液pH带来显著影响。电极电势能够影响微生物和电极的电子交换能力[46]。电极电势对MES产生MCFAs的具体影响及调控机制还有待研究。
3.3 气体分压
不同气体分压对MES合成MCFAs过程均有一定影响。CO2分压影响自养微生物的固碳速率和异养微生物转化短链脂肪酸的效率[58],H2分压影响自养微生物与电极间的电子传递过程和异养微生物的乙醇氧化副反应[59],CO分压影响CO对不同种类微生物的毒性[60]。
CO2/CO比例主要通过不同气体底物供应速率或者使用不同电化学特性的阴极材料进行调节。研究表明高CO2负载率与长水力停留时间相结合,能够刺激碳链延长产生丁酸和己酸[44]。CO具有毒性,当CO分压高于0.11 atm时,对产甲烷抑制作用明显高于对产酸或者产醇的抑制作用[60]。在产生乙酸过程中,增加CO气体组分,混菌微生物群落比纯菌灵敏性低,但是在长期运行过程中主要产物从乙酸转为乙醇[61],而乙醇与乙酸的比例会影响产生的辛酸盐和己酸盐的比例[56]。CO占比从8%增加到30%,促进乙醇发酵产生己酸[60];研究表明CO2/CO比例为1∶1时,己酸选择性最高[19]。
在MES中,H2的原位产生和迅速消耗是实现阴极和微生物之间电子转移的重要途径[22],所以H2分压在实验过程中通常比较低。因此,在MES中,有望通过调节气体分压来调控乙酸和乙醇等中间产物的比例,进而增加目标MCFAs的产量。
3.4 pH
在生物活性范围内,pH>6时有利于产生乙酸,pH<5时有利于产生乙醇[62-63],pH在4.8左右时,有利于产生高级醇[25]。pH为5.0-5.5时,乙酸和乙醇同时存在,微生物能够通过逆β氧化途径进行碳链延长产生MCFAs[55]。有研究发现pH为5.5和7时,均能够产生己酸;而辛酸只在pH为7时产生[52]。构建双生物阴极的MES,以离子交换膜分割设置不同pH区域,可实现同时产酸、产醇(pH约4.9)以及碳链延长产生 MCFAs(pH 约 6.9)[39](图4)。

图4 配备双生物阴极的MES实现不同pH区域划分[39]Fig.4 MES equipped with dual biocathodes working at different pH zones[39]
当溶液pH在羧酸的解离常数pKa(4.8-4.9)附近时,溶液中的MCFAs几乎均为未解离MCFAs;当溶液pH为中性时,未解离MCFAs低于1%[64]。酸性pH下存在未解离MCFAs,而产甲烷菌比碳链延长功能菌对未解离MCFAs毒性更敏感[59],所以酸性pH能够抑制并减少与碳链延长微生物竞争底物的产甲烷菌[65]。已有两种方法维持低浓度未解离MCFAs:一是在6.5-7.0的中性pH下直接产生MCFAs[66];二是在5.0-5.5的酸性pH下运行反应器并进行产物提取[37]。
pH直接影响微生物电化学还原CO2以及碳链延长产生MCFAs,而且这两个过程均可能导致阴极液酸化[18]。与此相反,析氢反应可能致使阴极液碱化,当混菌不能消耗原位产生的H2时会出现阴极液过碱化[67],进而导致MES产生MCFAs的性能下降。pH能够通过改变脂肪酸和CO2的解离平衡,影响MES产生产品的分离选择性。因此,可以通过pH调节来调控MES产生目标MCFAs。
4 MES中复杂底物影响MCFAs生产
研究表明MES能够利用不同底物进行碳链延长产生MCFAs,如表1所示。在MES中,底物选取及其比例对MCFAs产生起着重要作用,有望通过底物选择以及比例调控促进特异性产生MCFAs。
4.1 C1废气
4.1.1 CO2气体 MES能够利用CO2为底物直接产生MCFAs(表1)。阴极电势固定在-0.997 V时,阴极溶解的CO2以及产生的羧酸能够抵消阴极产生氢气带来的阴极液碱化,在长期运行过程中阴极pH能够保持稳定以利于产生MCFAs,己酸浓度最大达到1.2 g/L[18]。使用廉价的碳毡阴极,在低CO2供应速率(0.09 L/d)以及短水力停留时间(4 d)下产生己酸的浓度最高达到1.5 g/L[43];而在高CO2加载速率(173 L/d)以及长水力停留时间(14 d)下,己酸浓度最高为3.1 g/L[44]。尽管MES利用CO2产生MCFAs具有环境效益,但是CO2的高氧化电位以及热力学稳定性,使其以MCFAs作为目标产物时仍表现出低产物选择性。
4.1.2 合成气 工业过程(如钢铁产业、有机废物气化等)中通常产生大量C1废气,其组分显著不同,如在炼钢过程[68]、生物质气化过程[69]等产生的合成气中CO占比为5%-70%。不同CO2/CO比例[19]及CO2/H2比例[23]均会影响MCFAs的产物生成以及产生速率。CO对微生物具有毒性,当CO分压高于0.11 atm时,明显抑制产甲烷[60]。CO在生物转化中能够同时作为碳源和电子供体[53]。CO/CO2的氧化还原电位(E0′= -520 mV)低,有利于微生物还原其产生醇或丙酮酸衍生物等化学品[70]。合成气组分以及比例影响MES中MCFAs的产生速率以及选择性,当CO2/CO合成气比例为1∶1时,产生MCFAs的选择性最高[19]。因此,探究MES利用合成气产生MCFAs,有利于C1废气的回收利用,以实现MES利用不同来源的C1废气特异性产生MCFAs。
4.2 有机废弃物
4.2.1 人工合成废弃物 已有研究表明,在MES中微生物能够将短链脂肪酸延长为MCFAs。例如,MES利用乙酸为底物产生己酸(0.739 g/L)和辛酸(0.036 g/L)[40]。有机酸种类和浓度影响MCFAs的生产。乙酸和丁酸对于正己酸产生至关重要,而异丁酸和乙醇促进异己酸产生[71]。辛酸盐浓度随乙醇与乙酸比例增加而升高,己酸盐产生则相反[54]。使用乙酸和乙醇为底物进行电发酵,新鲜碳毡阴极电发酵比不加电组己酸选择性增加28%,而富集阴极电发酵的底物浓度与己酸选择性呈现非线性关系[46]。因此,调节短链脂肪酸与醇的种类和比例进行碳链延长,有利于选择性产生目标MCFAs。
4.2.2 实际废弃物 MES利用有机废弃物为底物进行碳链延长产生MCFAs,需要同时进行水解、初次发酵、碳链延长等多重步骤。在MES中,以甘油为底物,对混菌供电时戊酸积累量增加[8]。利用甘油为底物进行电发酵时,不同阴极电位下混菌产生丙酸和丁酸的比例不同[47]。使用不锈钢网阴极利用酿酒废水发酵,主要产物从丙酸转变为戊酸,表明存在碳链延长过程[72]。在MES中,置入电极会影响微生物群落的分布和结构。通过有毒产物提取等方法增强微生物和电极的协同作用有利于碳链延长。例如,构建膜液液萃取系统,将生物反应器(pH5.5)产生的MCFAs泵入碱性提取液(pH9),再将碱性提取液通入膜电解池的阴极室(pH约9),使阴极液中解离MCFAs通过阴离子交换膜转移到酸性阳极液(pH约1.5),进而实现液相分离并高效提取MCFAs[73]。尽管目前没有相关报道,上述研究揭示MES可望提供一种利用有机废弃物进行碳链延长以实现实际废弃物资源化的新方法。
5 展望
MES是利用C1废气以及有机废弃物产生MCFAs的较有潜力的技术,然而,MES产生MCFAs尚存在一些技术瓶颈。尚需通过菌群优化、调节关键运行参数以及使用新型阴极材料等提高其性能。
(1)合成生物学手段以及混菌群落调控可提高生化反应性能。合成生物学使用基因组设计和有效的分子工具,可以广泛高效地改造功能菌,有望从调控细胞电子传递路径、胞内还原力水平和胞内信号分子的表达等3个方面[74]改造功能菌以实现高效产生MCFAs。对细胞进行材料修饰有望提高MCFAs产率,如使用半导体纳米颗粒修饰CO2固定菌[75],促进阴极CO2还原产生其他高附加值产品。混菌群落调控优化功能菌,有望增强菌群相互作用,以提高MES产生MCFAs的性能。电极生物膜的形成可为不同菌群提供最优微环境,增加生物量以及提高体积产率。
(2)尚须综合优化MES产生MCFAs的关键运行参数。综合调控电子供体和电子受体负荷、电极电势、气体分压和pH等运行参数,控制以C1废气或有机废弃物为底物产生乙酸和乙醇等中间产物的比例,增强微生物和电极的协同作用,能够促进短链脂肪酸和乙醇特异性产生目标MCFAs。
(3)有必要对MES产生MCFAs的长期运行性能进行评估。连续运行MES反应器,促进底物和产物传质以及胞外电子传递;使用同位素标记方法[76]和定量PCR技术对碳链延长过程进行研究;建立动力学模型分析碳链延长过程中不同路径的具体贡献;均有望进一步促进MES高效产生MCFAs。
6 结论
MES利用C1废气以及有机废弃物为底物产生MCFAs,能够在减少碳排放、处理有机废弃物的同时将其资源化并转化为具有较高价值的化合物,具有很高的环境和社会效益。本文总结MES催化转化C1废气并耦合二次发酵过程进行碳链延长产生MCFAs的研究现状,具体如下。
(1)MES研究中多为产乙酸菌与碳链延长菌协同作用产生MCFAs:通过WLP产生乙酸和乙醇,并通过R-Box过程产生MCFAs。(2)探索新型阴极材料以及综合调控MES的关键运行参数,有望实现MES高速合成目标MCFAs。(3)探究不同底物的组合及其比例,有望为MES转化实际废弃物并特异性产生MCFAs提供指导。