酿酒酵母F15 和CC17 共接种发酵对赤霞珠葡萄酒品质及感官特性的影响
2021-06-21金洪伟梁恒宇坤5王加友
金洪伟,梁恒宇 ,郭 坤5,,苏 宁,王加友,田 甜
(1.深圳市光明区疾病预防控制中心,广东深圳 518106;2.中国中化集团有限公司沈阳化工研究院生物与医药研究所,辽宁沈阳 110021;3.武汉生物技术研究院湖北省合成微生物技术工程实验室,湖北武汉 430075;4.武汉大学药学院组合生物合成与新药发现教育部重点实验室,湖北武汉 430071;5.齐齐哈尔市食品药品检验检测中心,黑龙江齐齐哈尔 161005;6.中粮华夏葡萄酒有限公司,河北昌黎 066600)
酿酒酵母是决定葡萄酒品质的关键因素之一[1]。然而,工业上长期使用少数商业酵母菌株不仅降低了葡萄酒加工环境中微生物的多样性[2],还减少了葡萄酒的特色和复杂性[3],造成产品“同质化”问题[4]。为了适应不断变化的市场和消费者对不同风格葡萄酒的追求,葡萄酒制造商需要通过酿造出品质卓越而风格独特的酒来吸引日益扩大的消费群体,并在激烈的竞争中保持市场地位[5]。
葡萄酒地域性差异得到广泛研究,越来越多的结果表明葡萄酒酿造过程中使用本土优良酵母是强化成酒个性风味的有效方法之一[6-7]。遗传背景不同的菌种或菌株因代谢框架差异赋予葡萄酒不同的风味和官感[8-9],近年来通过酿酒酵母与非酿酵母(non-Saccharomyces)或不同酿酒酵母菌株混合发酵酿造葡萄酒成为人们的关注热点[10-11]。然而非酿酵母的安全性、可控性及其功能特性尚需大量研究[12]。因此,利用具有不同代谢框架酿酒酵母菌株进行共接种发酵,以改善葡萄酒的风味和香气成分,是当前的研究重点。研究表明混合发酵过程中不同酿酒酵母菌株之间的相互作用会影响菌株代谢[13]。Cheraiti 等发现葡萄酒混合培养过程中不同酿酒酵母属菌株间的相互作用能影响生物量、发酵模式、代谢物积累以及氧还电势水平,表明不同菌株之间存在着代谢流交换[14]。而这些相互作用和物质交换是使所酿葡萄酒产生与单一菌株发酵不同代谢框架的基础[15]。最近研究表明,高氮源同化速率可能是混合发酵时不同酿酒酵母菌株强化自身竞争能力的一种额外策略,因此在选择混合发酵的菌种时应将氮源利用能力作为筛选标准之一[16]。研究证明利用不同的酿酒酵母菌株进行共发酵可以调整或改变葡萄酒的香气组成[17],并在一定程度上避免因单菌株发酵产生的一些发酵缺陷[18]。朱娟娟等对F9 和F33 两株商业酿酒酵母菌株单发酵和混合发酵过程中理化指标、颜色色调、香气组分和抗氧化特性进行研究,发现混菌接种后发酵启动速率较单菌种快,显著降低总糖含量,且抗氧化性显著提升[19]。然而,对不同酿酒酵母菌株共接种发酵酿造葡萄酒仍需更多深入研究,关于该模式对葡萄酒代谢框架和感官品质影响的认识也十分有限[20]。现有的研究集中在商业酿酒酵母之间的混合发酵,而尚未见利用商业酵母与中国本土优良酿酒酵母菌株进行共发酵的报道。
F15 是我国葡萄酒酿造行业常用的商业酿酒酵母菌株,F15 菌株的广泛使用造成葡萄酒产品品质趋同且缺乏个性[21]。CC17 是从我国河北省昌黎县葡萄酒产区自然发酵葡萄汁中筛选得到的优良本土酿酒酵母[21]。此前研究业已证明F15 和CC17 具有明显不同的遗传背景[21]和代谢特点[22]。而通过与本土酵母进行共接种发酵可能会改善葡萄酒的品质和感官特性。本研究以F15 和CC17 单独发酵为对照,对F15 和CC17 共接种发酵酿造赤霞珠葡萄酒酒精发酵过程中比重、温度、残糖、乙醇、总酸、pH、花青素、单宁、总酚、色度和色调的变化进行了监测,发酵结束后又分别对酒的香气成分和感官特性进行了测评,旨在为工业上开展商业酵母与本土野生酿酒酵母共接种发酵研发和生产提供理论基础。
1 材料与方法
1.1 材料与仪器
赤霞珠葡萄 取自2018 年河北省昌黎县,接种前葡萄汁的基本理化指标为:总糖含量203.2±1.4 g/L,总酸为9.13±0.21 g/L,初始pH 为3.37,色度为5.29±0.64,花青素为0.31±0.02 g/L,单宁为0.66±0.03 g/L,总酚0.98±0.05 g/L;酿酒酵母CC17(CGMCC3284)
中国普通微生物菌种保藏管理中心;商业酿酒酵母F15、果胶酶(AR2000,活力>20000 U/g)法国Laffort 公司;4-甲基-2-戊醇(色谱纯,含量≥99%)美国Sigma 公司;甲醇、乙腈 德国Merck 公司(色谱纯,含量≥99%);YEPD 培养基 葡萄糖20 g/L、蛋白胨20 g/L、酵母抽提物10 g/L,固体添加15 g/L 琼脂,实验室自制。
顶空固相微萃取(head space solid-phase microextractions,HS-SPME)操作平台、磁力恒温加热搅拌器、57330-U 型SPME 手动进样手柄、57348-U 型固相微萃取头 美国Supelco 公司;GCMS 6890-5975B 气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用仪、HP-INNOWax Polyethylene Glycol(60 m×250 μm×0.25 μm)毛细管色谱柱 美国Angilent 公司;紫外可见分光光度计 北京普析通用仪器有限责任公司;1.2 吨双层不锈钢发酵罐 昌黎县金马不锈钢经销处;ALFA7 除梗破碎机 意大利Siprem 公司。
1.2 实验方法
1.2.1 种子的活化和培养 取出冻存菌株于YEPD固体培养基上划线培养48 h,挑取单菌落接种50 mL 液体培养基,200 r/min 振荡培养12 h,再以1%接种量转接于1 L YEPD 液体培养基中静置培养,培养温度均为30 ℃。接种前用血球计数板对种子液进行酵母细胞计数,确定接种量。
1.2.2 酒精发酵 葡萄除梗破碎后以300 kg/罐的量分装发酵罐中,添加果胶酶(20 mg/L)和SO2(60 mg/L),接种酿酒酵母并用泵打循环混匀。F15 和CC17 分别以2×106CFU/mL 的量接种进行单菌株发酵;F15 和CC17 按1:1 比例共接种发酵,总接种量也为2×106CFU/mL。每日早、晚两次打循环后取样监控发酵液的比重和温度。当比重不再下降时视为酒精发酵结束。每组有两个平行发酵罐。
1.2.3 主要理化指标测定 发酵过程中每12 h 使用比重计和温度计测定发酵液的比重和料液温度;每24 h 按GB/T 15038-2006 所述方法对发酵液的残糖、乙醇、总酸和pH 进行监测[23];每48 h 对发酵液的色度、色调、花青素、单宁和总酚含量进行测定。酒样经0.45 μm 滤膜过滤,用pH3.0 的磷酸氢二钠-柠檬酸缓冲液稀释10 倍后待用[24]。色度测定是将稀释样品倒入1 cm 比色皿中,在波长420、520、620 nm下分别测定其吸光值,三者之和即为该样品的色度[25]。色调为420 nm 与520 nm 吸光值之比[26]。花青素、单宁和总酚分别按亚硫酸脱色法、Folin-Denis比色法和Folin-Ciocalteu 比色法进行测定[24-26]。
1.2.4 挥发性香气物质测定 利用HS-SPME 提取香气物质[7]。GC 条件为:手动进样,不分流模式,40 ℃保持5 min,再以3 ℃/min 的速度升温至200 ℃,保持2 min,氦气载气流速为1 mL/min[7]。MS 条件为:质谱接口温度为280 ℃,离子源温度为230 ℃,电离方式EI,离子能量70 ev,质量扫描范围为20~350 u[7]。利用NIST 107 标准谱库自动检索各组分质谱数据,根据化合物结构特征与NIST11s.lib 谱库中标准化合物的图谱进行比较判别化合物类型。采用内标法进行定量分析[21]。
1.2.5 感官评价 感官评价参照文献[21]进行。感官评价室温度在19±1 ℃,8 名感官评价员(4 男4 女)分别对葡萄酒样品的颜色、香气(花香、果香)、口感(酸感、酒体和收敛性)和滋味(典型性、协调性和复杂性)按8 个档次1 至10 分(1~3 分,可排除;3~4 分,有缺陷;4~6 分,普通;6~7 分,良好;7~8 分,好;8~9,非常好;9~10,卓越)进行随机感官评价和打分。感官评价结束后收集打分卡结果进行统计分析。
1.3 数据统计与分析
采用SPSS 16.0 软件(SPSS Inc.,USA)对数据进行统计分析。
2 结果与分析
2.1 比重和温度的变化
酿酒酵母酒精发酵致使葡萄汁比重持续下降,而温度则先持续上升而后持续降低(图1)。图1 表明共发酵比重的变化曲线介于F15 和CC17 单菌株发酵之间。接种24 h 后,比重下降和温度上升幅度加快,尤其是CC17。在前72 h,共发酵组比重下降与温度上升趋势与F15 相近,而与CC17 差异明显;而72 h 后,共发酵组的比重和温度变化曲线开始介于F15 和CC17 之间,并逐渐靠近CC17。共发酵组和CC17 单发酵组在120 h 后比重停止下降,表明这两组乙醇发酵结束;而F15 单发酵组比重直到144 h后才停止下降,其发酵结束的时间较CC17 和共发酵组晚24 h。三组发酵液最高温度均达到23.5±0.2 ℃,CC17 发酵温度峰值出现在60 h,比共发酵和F15 单发酵组早12 h。

图1 酒精发酵过程中比重和温度的变化Fig.1 Changes of specific gravity and temperature during fermentations
2.2 残糖和乙醇含量的变化
图2 显示酒精发酵过程中残糖含量持续下降而乙醇含量持续增加。在24 h 至120 h 之间,对所有采样节点残糖含量测定结果均为F15>F15+CC17>CC17,相反的乙醇含量均为F15<F15+CC17<CC17;发酵144 h 后所有组残糖下降和乙醇增加幅度明显趋稳;发酵168 h 之后三组发酵液中残糖含量均降至4.0 g/L 以下,而乙醇含量均达到11%左右;192 h 后F15、F15+CC17 和CC17 三组葡萄酒中残糖含量分别为2.7、2.5 和3.4 g/L,而乙醇含量分别达到11.06%、11.11%和11.23%。从图2 可知,共发酵组残糖和乙醇变化曲线均介于F15 和CC17 单发酵之间,这表明采取共发酵模式酵母碳源利用速率以及主代谢产物乙醇积累速率介于两种单菌株之间。

图2 酒精发酵过程中残糖和乙醇含量的变化Fig.2 Changes of sugar and ethanol contents during fermentations
2.3 总酸和pH 的变化
葡萄汁中主要包括酒石酸、苹果酸和柠檬酸,而经过酵母菌代谢常使葡萄酒中积累琥珀酸和丙酮酸。酸的含量和组成对葡萄酒的pH、色度、酸度、口味平衡性及发酵过程中微生物的活力均有非常重要和直接的影响[1]。
从图3 中可以看出,发酵48 h 后,F15 单发酵与CC17 单发酵和双菌株共发酵中总酸含量差异显著。酒精发酵24 h 后,三个发酵组总酸均略有增加。在前72 h,各组总酸含量均呈升高趋势,但F15 单发酵组总酸增加幅度低于共发酵组和CC17 单发酵组,在72 h 时F15 单发酵组总酸含量达到最大(10.03 g/L);在发酵至96 h 后CC17 单发酵组和共发酵组总酸也均达到峰值,此后略有下降但幅度不大,而F15 则开始持续缓慢下降。共发酵组总酸的变化趋势与CC17 基本一致,但在24 h 后共发酵组每个采样节点的总酸均显著低于CC17 单发酵组(P<0.05)。192 h 时,F15、F15+CC17 和CC17三个发酵组总酸含量分别为9.11、11.31 和12.11 g/L。此前研究证明本土酿酒酵母CC17 和商业菌株F15在葡萄酒酿造过程中非挥发性有机酸的代谢框架区别明显[21],CC17 产琥珀酸较高是该菌株的特点之一[22]。上述数据表明混合发酵下调了CC17 单发酵时的产酸能力。

图3 发酵过程中总酸的变化Fig.3 Changes of total acids during fermentations
发酵过程中pH 变化波动较大(图4),这与前人结论类似[5]。F15 单发酵组pH 在发酵的前24 h 无变化,48 h 升高至3.66,72 h 时又降至3.61,96 h 时又再次升高至3.66,随后pH 缓慢上升至144 h 时最高的3.77,168 h 后又微降至3.72 并稳定至192 h。CC17 单发酵组pH 变化情况与F15 不同,在前72 h其pH 呈缓慢下降趋势(从0 h 的3.63 降至72 h 的3.58),96 h 时其pH 又回升至3.63,120 h 又微降至3.61,而 144 h 又增至3.66,168~192 h 稳定在3.64。F15+CC17 共发酵pH 变化模式与CC17 相似,0~72 h 该组pH 从3.63 降至3.57,96 h 时陡增至3.66,120 h 又降至3.63,144 h 为3.67 并稳定至192 h 实验结束。整个过程中,除24 和72 h 外,共发酵组pH 均值均处于F15 和CC17 两组pH 之间,这应该是双菌株共发酵组总酸介于两种酿酒酵母单菌株发酵之间引起的。而整个酒精发酵过程中pH 变化的波动很有可能是不同时期菌株有机酸代谢产物差异造成的,具体原因需深入研究。

图4 发酵过程中pH 的变化Fig.4 Changes of pH during fermentations
2.4 色度和色调的变化
色度监测结果表明,在整个发酵过程中F15 单发酵组和CC17 单发酵组存在差异,而共发酵组色度变化则与CC17 更为相似(图5)。在发酵144 h 前三个发酵组色度均稳定上升,F15 单菌株组、F15+CC17 共发酵组和CC17 单菌株组的色度分别为7.96、9.13 和9.56;但192 h 的测定结果显示F15 单菌株组色度出现了明显降低(7.82),而共发酵组与CC17 单发酵组色度值则分别继续上升至9.57 和10.26。与葡萄汁相比,192 h 后F15 单发酵组、F15+CC17 共发酵组和CC17 单发酵组的色度分别提高了1.40、2.05 和2.11 倍。

图5 发酵过程中色度的变化Fig.5 Changes of color intensity during fermentations
色调是检测葡萄酒样品色度时420 nm 波长(黄色)与520 nm 波长(红色)测定值的比值,该值越高表明酒的色调越偏向黄色,越低酒的色调越偏向于红色[26]。从感官评定的角度分析,消费者更青睐偏向红色调的酒[27]。图6 结果显示,以48 h 为时间节点,三组发酵葡萄汁色调变化均呈现先下降再缓慢上升的趋势。这表明在48 h 后发酵葡萄汁的色调逐渐偏向黄色。48 h 后共发酵组色调均低于F15 和CC17 两个单发酵组,而CC17 单发酵组则低于F15 单发酵组。这一结果表明,采用商业酵母F15 和野生酵母CC17 共发酵能够使葡萄酒趋向红色调。这可能是因为共发酵组花青素含量较高[28]。
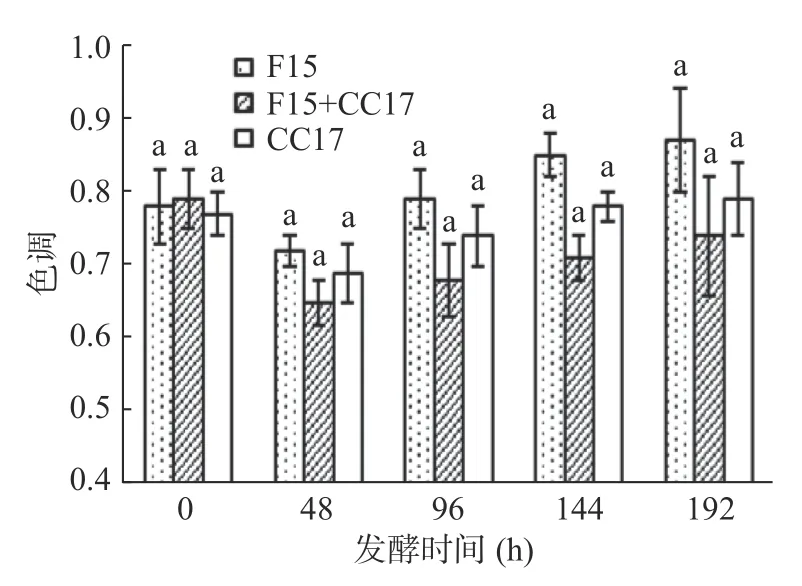
图6 发酵过程中色调的变化Fig.6 Changes of color hue during fermentations
2.5 花青素、单宁和总酚含量的变化
不同的酵母菌株对葡萄皮中花青素的溶出率和葡萄酒中吡喃花青素的降解能力不同[28]。如图7 所示,在发酵的前96 h 三组中花青素含量变化均不明显,但144 h 后三组中花青素含量均出现明显上升。发酵至192 h 时,花青素含量均值的高低顺序分别为:F15+CC17 共发酵组(0.60 g/L)、F15 单发酵组(0.56 g/L)和CC17 单发酵组(0.53 g/L),统计结果看三者之间无显著性差异(P>0.05)。这在一定程度上解释了为什么共发酵组色调偏向红色的内在原因。

图7 发酵过程中花青素含量的变化Fig.7 Changes of anthocyanins contents during fermentations
葡萄酒中的单宁含量不仅与酒体、收敛性等感官属性高度相关,而且在葡萄酒的酿造过程中对酒的颜色和口感起重要影响[26]。不同酿酒酵母菌株所酿酒中单宁含量存在差异,而这种差异会影响成酒的色度、色调和收敛性[29]。本研究结果(图8)显示,发酵至48 h,三组中单宁含量变化均不显著且组间差异不大(P>0.05)。发酵至96 h,F15 单发酵组单宁含量仍无明显变化,而共发酵组和CC17 单发酵组单宁含量明显增加,且后者增加幅度更明显。发酵至144 h,三组单宁含量均出现大幅增加,按含量高低排序为CC17组>F15+CC17 组>F15 组。至192 h 时,三组单宁含量均进一步增加,高低次序仍为CC17 组>F15+CC17 组>F15 组,此时三组葡萄酒中单宁含量分别为2.13、1.92 和1.43 g/L,较0 h 相比分别增加3.18、2.95 和1.97 倍。
总酚含量变化趋势与单宁基本一致,均随时间延长而增加(图9)。初始0 h 时葡萄汁总酚含量均值为0.98 g/L。发酵至48 h,三组中总酚变化不大且组间差异不显著(P>0.05)。至96 h,F15 单发酵组总酚含量均值略有增加,而共发酵组和CC17 单发酵组总酚含量有不同程度增加,同样CC17 组增加幅度更明显。144 h 后,三个发酵组的总酚含量均出现明显增加,按高低排序为CC17 组>F15+CC17 组>F15 组。发酵至192 h,三个组总酚含量均略微增加,但高低次序仍为CC17 组>F15+CC17 组>F15组,此时三组葡萄酒中总酚含量分别为2.71、2.37 和2.05 g/L,与0 h 相比分别增加了2.77、2.42和2.09 倍。

图9 发酵过程中总酚含量的变化Fig.9 Changes of total phenol contents during fermentations
2.6 发酵结束后主要香气物质分析
乙醇发酵结束后,利用HS-SPME GC-MS 对所有葡萄酒样品进行香气物质分析。表1 展示了对38 种香气物质的定量结果,其中包括20 种酯(乙醇酯9 种、乙酸酯6 种及其他酯类5 种)、12 种高级醇、4 种挥发性有机酸和2 种羰基化合物。
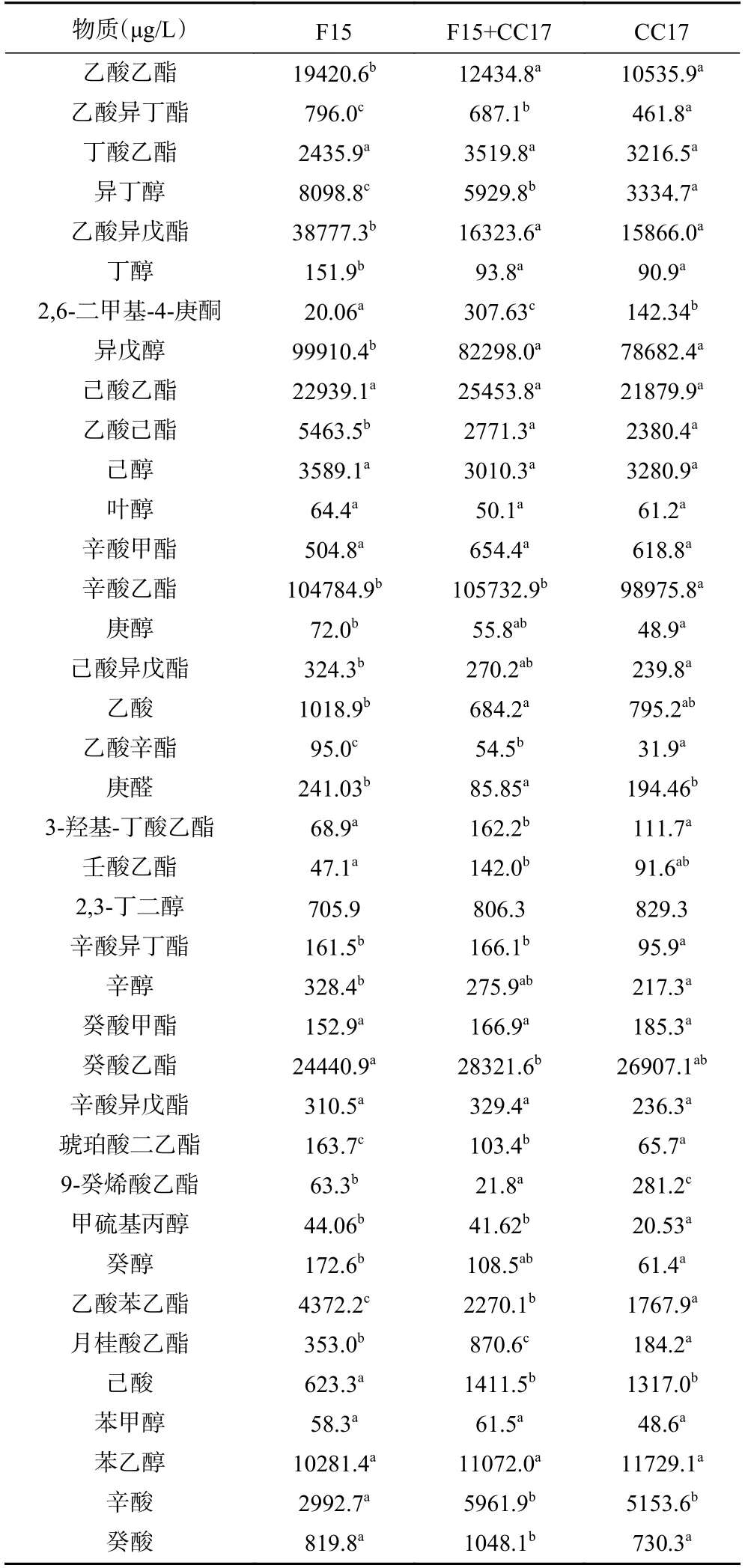
表1 发酵结束后葡萄酒中主要香气物质的含量Table 1 Aroma contents of wines after fermentations
除月桂酸乙酯外,共发酵组样品中其他直链脂肪酸乙酯含量均略高于CC17 和F15 单菌株发酵。三组发酵中丁酸乙酯、己酸乙酯和总乙醇酯含量无显著差异;F15 单发酵组和共发酵组辛酸乙酯含量显著高于CC17;共发酵组壬酸乙酯、癸酸乙酯和3-羟基-丁酸乙酯的含量显著高于单菌株发酵组,而9-癸烯酸乙酯的含量却显著低于单菌株发酵(P<0.05)。共发酵组所有乙酸酯类物质的含量均处于F15 和CC17 单菌株发酵组之间。但是从统计分析结果看,共发酵组乙酸酯的组成框架与CC17 单发酵更为接近。共发酵组乙酸乙酯、乙酸己酯、乙酸异戊酯和总乙酸酯的含量与CC17 单发酵无差异,而与F15 单发酵差异显著(P<0.05);乙酸辛酯、乙酸异丁酯和乙酸苯乙酯的含量则与CC17 和F15 均有显著差异。F15 菌株总乙酸酯的产生能力(68972.3 μg/L)明显高于共发酵(34630.6 μg/L)和CC17(31101.6 μg/L)。其他酯类中,共发酵组除己酸异戊酯和辛酸异丁酯的含量显著高于CC17 外,其他组分之间并无明显差异。
从表1 可以看到,共发酵组中庚醇、辛醇和癸醇的含量均介于F15 和CC17 单发酵之间且与单菌株发酵无明显差异;而F15 单发酵组这三种直链脂肪醇含量显著高于CC17。共发酵组中丁醇和异戊醇的含量显著低于F15,却与CC17 无差异。共发酵组甲硫基丙醇的含量与F15 无差异,但显著高于CC17。异丁醇含量为F15 组>F15+CC17 组>CC17组,且两两之间差异显著(P<0.05)。其他几种高级醇包括总高级醇的含量,三组样品无显著差异(P>0.05)。
双菌株共发酵与F15 单发酵相比乙酸含量显著降低(P<0.05),这一结果与此前研究不同[13]。但双菌株共发酵产生的己酸和辛酸的量显著高于F15,而与CC17 无显著差异。共发酵组癸酸含量均值高于F15 和CC17 单发酵,但差异不显著。共发酵组总挥发性有机酸含量显著高于F15,而与CC17 差异不显著(P>0.05)。共发酵组2,6-二甲基-4-庚酮的含量显著高于F15 和CC17。而另外一种羰基类化合物庚醛,共发酵组则显著低于单发酵组(P<0.05)。
2.7 感官评价结果
从图10 可以看出三组葡萄酒感官特性具有差异。颜色评分结果,F15+CC17 双菌株发酵组介于两单菌株发酵之间。统计结果表明,CC17 单发酵组与共发酵组颜色特性评价均为“卓越”,而F15 单发酵评价为“非常好”。这一结果与CC17 单发酵组和共发酵组色度较高相对应。三组发酵果香和花香两项香气特性指标均为“卓越”。果香评分均值F15+CC17>CC17>F15,这可能是共发酵组部分乙醇酯和挥发性有机酸含量较高造成的;花香评分F15>F15+CC17>CC17,这可能是F15 单发酵组乙酸酯含量较高引起的。口感特性有酒体、酸味和收敛性三项指标。三组葡萄酒酒体的评价均为“非常好”且组间无明显差异,均值比较结果为F15+CC17>CC17>F15,这可能是共发酵组和CC17 单发酵组总酸和单宁含量较高引起的。三组样品酸味评分差异显著(P<0.05),CC17 单发酵组仅为“好”,而共发酵组和F15 单发酵组均为“非常好”。这也证明通过共发酵能够有效改善CC17 菌株酒酸味较重的缺陷。对三组葡萄酒收敛性的评价结果均为“卓越”,但CC17 和共发酵组的评分高于F15,这可能是因为前两者总酚和单宁含量较高。

图10 葡萄酒感官评价得分Fig.10 Score plot for sensory evaluation of wines
对葡萄酒的整体评价有典型性、协调性和复杂性三项指标。F15 所酿葡萄酒的典型性评分显著低于CC17 单发酵和共发酵组(P<0.05)。从图10 上也可以看出,对CC17 单发酵组和共发酵组典型性这一感官特性的评价均为“卓越”,而F15 仅为“好”。协调性评分均值排序为F15+CC17>F15>CC17,三组酒的协调性评价结果分别为“卓越”、“非常好”和“好”。而对复杂性的评分均值排序为F15+CC17>CC17>F15,三组葡萄酒复杂性的评价结果分别为“卓越”、“非常好”和“非常好”。
3 结论
F15 和CC17 菌株酿造特性具有显著差异。菌株CC17 较F15 起酵快、发酵能力强,所酿葡萄酒总酚、单宁含量高,颜色、收敛性和典型性明显好于F15,但CC17 单发酵时酒中总酸较高,导致所酿酒口味较酸。商业酵母F15 所酿葡萄酒虽无明显缺陷,但因总酚、单宁含量较低,典型性、复杂性和收敛性均显著逊于CC17。采用F15+CC17 共接种发酵,葡萄汁比重和温度变化模式在72 h 前与F15 相似,而72 h 后则与CC17 趋近;残糖、乙醇、总酸、pH、单宁、总酚和色度的变化始终介于两种单发酵监测值之间。经双菌株共发酵后,葡萄酒的香气轮廓也发生改变,某些酯类、高级醇、挥发性酸和羰基类化合物变化显著。与F15 单发酵相比,共发酵能够提高葡萄酒中单宁、总酚、部分挥发性香气物质含量和色度,提升葡萄酒颜色、酒体、收敛性和典型性等感官特性;与CC17 单发酵相比,共发酵能明显降低总酸,提高pH,增加大部分香气组分,改善了酒的酸味和协调性。此外,共发酵对葡萄酒的色调和香气起到调谐作用,对葡萄酒整体的协调性和复杂性有显著改善。本研究数据和分析为今后在生产实践中开展商业酵母和本土酿酒酵母菌株共接种发酵酿造葡萄酒工艺研究提供了参考。
