角蛋白酶改性对大米蛋白水解产物起泡性质和结构特征的影响
2021-06-21吴晓江童火艳付桂明刘成梅
吴晓江,童火艳,万 茵,付桂明,刘成梅
(食品科学与技术国家重点实验室,南昌大学食品学院,江西南昌 330031)
大米蛋白的氨基酸组成合理,与WHO/FAO 的推荐值很接近,具有生物价值高、低致敏性、气味清淡,无刺激性气味的优点,被公认为一种优质的植物蛋白[1]。另外大米蛋白还具有抗氧化、降血压、抗癌和抑制肥胖等生理功效,在预防慢性疾病方面发挥着积极的作用[2-4]。然而,与大多数的谷物蛋白一样,因其较低的水溶性,导致其较差的功能性质(例如溶解性、表面活性、起泡性、乳化性等),而这极大的限制了大米蛋白的应用和开发。研究表明造成大米蛋白溶解性差的主要原因是存在于大米蛋白多肽链内和链间大量的二硫键、和其蛋白表面存在较多的疏水性氨基酸残基[5]。因此为了增加大米蛋白的溶解性,有必要降低大米蛋白的分子量,促进蛋白与水的相互作用,进而增加其水溶性,改善其功能性质。
已经有多种改性技术手段被用作改善大米蛋白的溶解和功能性质,根据技术手段改性原理可以分为:物理改性、化学改性、生物改性、基因工程改性等[6-7]。其中生物改性特指酶法改性。酶法改性具有反应条件温和、可控性强、且不易产生毒副作用的优点,因此被广泛应用于大米蛋白的改性。王威,Zhao 和Nisov 等研究不同种类蛋白酶酶解对大米蛋白功能性质影响,研究表明酸性蛋白酶,碱性蛋白酶,中性蛋白酶和胰蛋白酶可以提高大米蛋白的水溶性,其在中性条件下蛋白回收率介于50%~75%,具有较高的蛋白回收率,且制备的大米蛋白水解产物的功能性质和抗氧化性质由蛋白酶的种类决定[8-10]。
角蛋白是一种不溶性、高度稳定的蛋白质,具有很高的机械稳定性和大量的二硫键,因而无法被常见的蛋白酶酶解,例如木瓜蛋白酶、胃蛋白酶和胰蛋白酶。角蛋白酶是一种可专一地降解角蛋白的蛋白酶类,可由多种微生物产生[11]。目前角蛋白酶已被广泛应用于脱毛、皮革和纺织工业,化妆品等领域,能够高效的降解羽毛、羊毛、指甲、头发及角质层等角质蛋白,废物再利用[12]。但关于角蛋白酶对大米蛋白的降解未见报道。因此本研究采用角蛋白酶对大米蛋白进行酶解改性,制备不同水解度(DH0 的大米蛋白水解产物,测定其起泡性和起泡稳定性和氨基酸组分,并采用聚丙烯酰胺凝胶电泳(SDS-PAGE),圆二色谱和内源性荧光测定水解产物的结构,研究结果将为大米蛋白的酶解改性提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
大米浓缩蛋白 由碎米经碱溶酸沉、耐高温α 淀粉酶除杂,水洗数次之后气流干燥制得,蛋白含量85.4%,脂肪含量3.41%,灰分含量2.04%,水分含量2.19%,由江西金农公司提供。角蛋白酶,比酶活:200 kU/g,最佳pH=11,最佳反应温度60 ℃,由济南诺能生物工程有限公司提供。
HH-6 数显恒温水浴锅 江苏常州国华电器有限公司;DFY-500 粉碎机 天津市泰斯特仪器有限公司;SP-756P 紫外-可见分光光度计 上海光谱仪器有限公司;TGL-16B 高速冷冻离心机 美国热电公司;Mini PROTEAN 电泳仪 美国Bio-Rad 公司;L-8900 氨基酸分析仪、F7000 荧光分光光度计 日本HITACH 公司;MOS-450 圆二色谱仪 法国Bio-Logic SAS 公司 JSM-6701F 场发射扫描电镜带能谱仪 日本电子公司。
1.2 实验方法
1.2.1 不同DH 大米蛋白水解产物的制备 称取10 g大米蛋白溶于250 mL 的蒸馏水中,搅拌1 h,使其充分水化。调节溶液pH9,温度60 ℃。然后按2000 U/g加酶量添加角蛋白酶,实验过程中通过不断滴加2 mol/L NaOH 维持反应体系的pH 不变。分别制备5、10、25、45、80、120、240 min 水解时间下对应的水解产物,对照组为未经过酶解的样品。将不同水解时间的大米蛋白灭酶(95 ℃,10 min)后冷却至室温,并调节混合体系pH=7 后,然后在5000 r/min 条件下离心15 min,取上清液,在-80 ℃冷冻24 h 后冻干成粉,用于后续测定。
1.2.2 DH 测定 根据Xu 等[13]的方法采用pH-Stat法测定大米蛋白的DH。从添加角蛋白酶至反应体系中开始计时,在整个反应过程不断滴加2 mol/L NaOH 维持反应体系的pH=9,记录相应的反应时间和对应消耗的的2 mol/L NaOH 的体积。不同水解时间下大米蛋白的DH 计算公式如下:
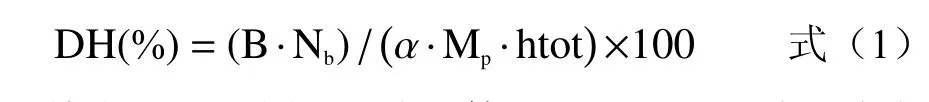
其中:B 为消耗的碱的体积mL;Nb为碱的摩尔浓度mol/L;;Mp为底物蛋白质的含量g;htot为大米蛋白中肽键的理论值,7.40 meq/g 大米蛋白。
1.2.3 不同酶解时间下大米蛋白回收率测定 不同水解时间的大米蛋白在中性条件下的蛋白回收率根据以下公式进行计算:

式中:上清液中蛋白质量为1.2.1 中上清液蛋白质量,上清液中蛋白含量采用福林酚法测定[9],并以牛血清蛋白作为标准蛋白制作标准曲线;总蛋白质量为10 g。
1.2.4 蛋白起泡性及起泡稳定性研究 根据刘成梅等[14]的方法,称取50 mg 蛋白溶于25 mL 去离子水中,用0.1 mol/L 的NaOH 将上述蛋白溶液pH 调至10,于10000 r/min 条件下用高速分散机分散1 min,记录分散停止时泡沫体积,静置30 min 后再次测定泡沫体积,计算起泡稳定性。选用乳清蛋白(WPC)作为对照蛋白。起泡性(Foaming ability,FA)和起泡稳定性(Foaming stability,FS)计算公式如下:

1.2.5 水解产物氨基酸分析测定 精确称取一定量的样品置于水解管中,加入6 mol/L 的HCl 溶液,真空封口,在110 ℃下水解24 h,冷却后定容、过滤、蒸干,取滤液1 mL 于小烧杯中,真空干燥后加入1 mL 0.02 mol/L 的HCl 溶液,在空气中放置30 min后,采用氨基酸分析仪测定氨基酸的含量(色氨酸除外)。
1.2.6 SDS-PAGE 分析 采用SDS-PAGE 对不同DH大米蛋白水解产物的分子量进行标准,具体方法参考Sun 等人方法,并作一定的调整[15]。配制含有0.1% SDS 的12%的分离胶和4%的浓缩胶。配制浓度5 mg/mL 的蛋白样品,蛋白样液分别于还原性上样缓冲液和非还原性上样缓冲液以3:1 的比例进行混合,接着高速离心机进行离心0.5 min,然后95 ℃加热处理10 min,再高速离心0.5 min。跑浓缩胶电压为80 V,分离胶电压为120 V。最后进行染色和脱色处理。
1.2.7 圆二色谱分析水解产物的二级结构 测定远紫外区190~250 nm 范围的CD 光谱。蛋白质浓度为0.1 mg/mL,测定温度为25 ℃,石英比色皿光径为0.1 cm,分辨率为0.2 nm,谱带宽度为1.0 nm。灵敏度为20 mdeg,响应时间为0.25 sec,扫描速率为200 nm/min,重复扫描8 次,累加得到CD 谱图。CD 光谱使用DICHROWEB 网站的SELCON3 方法进行分析[16]。
1.2.8 内源性荧光分析 内源性荧光测定参考Xu等[13]的方法。称取一定量的蛋白质溶解于10 mmol/L pH=7.0 磷酸缓冲液中,配置成0.01 mg/mL 的蛋白质溶液。设置激发波长为280 nm,扫描300~500 nm范围内的发射光谱。激发和发射的狭缝宽度都设置为2.5 nm。
1.3 数据处理
所有实验结果采用平均值±标准偏差,各组之间的显著性分析采用单因素方差分析,采用Ducan进行多重比较,所用软件为SPSS 25.0,所有测试至少三次。
2 结果与分析
2.1 角蛋白酶处理对大米蛋白DH 和蛋白回收率的影响
角蛋白酶处理对大米蛋白DH 和蛋白回收率的影响如图1 所示。由图可知,大米蛋白的DH 在前25 min 内由0%快速增加至7.93%,25~240 min内DH 缓慢增加,240 min 时DH 最大为16.77%。其中水解时间为0、5、10、25、45、80、120、240 min时,大米蛋白对应的DH 分别为0%、3.09%、5.01%、7.93%、9.96%、12.05%、13.88%、16.77%,回收的大米蛋白水解样品分别对应标记为DH0、DH3、DH5、DH8、DH10、DH12、DH14、DH17。大米蛋白回收率随时间变化呈现出先快速增加后逐渐平缓的趋势,前10 min 回收率由1.8%快速增加至75.06%,随后缓慢增加,水解至80 min 时,对应的回收率为92.05%,之后无显著性变化(P>0.05)。
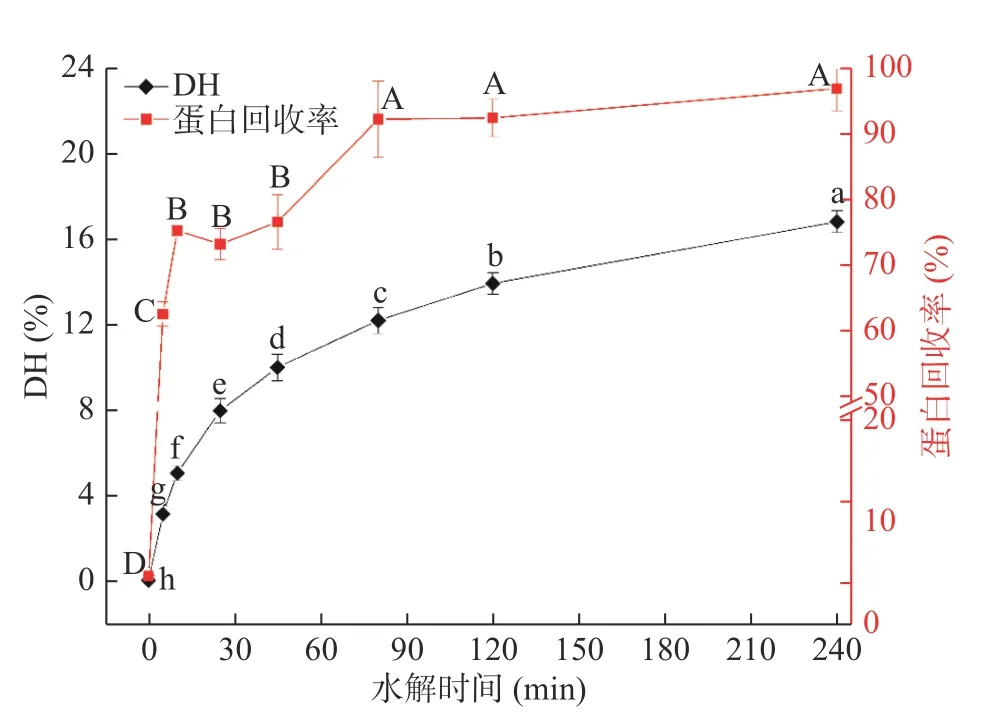
图1 角蛋白酶水解时间对大米蛋白水解度与蛋白回收率的影响Fig.1 Effects of hydrolysis time of keratinase on the hydrolysis degree and protein recovery of rice protein
蛋白质的多种功能性质会受其溶解性影响,特别是增稠、起泡、乳化、凝胶等功能。大米谷蛋白,是大米蛋白中最主要的贮藏蛋白,以蛋白体的形式集中存在,大米谷蛋白因疏水作用和大量的二硫键交联,表现出高度的水不溶性[17-18]。本研究中蛋白回收率测定的是pH=7 时上清液中总蛋白占比总蛋白的比例。从图1 中可以看出,角蛋白酶可显著提高大米蛋白在中性条件下的蛋白回收率(P<0.05)。水解时间10~45 min,5%<DH<10%,大米蛋白回收率为73.0~76.4%,具有较高的回收率。大米谷蛋白与角蛋白结构上兼存在大量的二硫键,角蛋白酶对大米蛋白高效的酶解作用可能与其降解角蛋白的机制类似,即既可以高效降解大米蛋白中的二硫键,又可以发挥蛋白酶的水解作用,将大米蛋白水解[11]。之前的研究表明大米蛋白的回收率主要受蛋白酶种类影响,酸性蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胰蛋白酶、风味蛋白酶及复合蛋白酶等水解大米蛋白后,大米蛋白回收率在50%~72%范围[8,9,19]。对比可知,角蛋白酶是一种可高效水解大米蛋白的蛋白酶。
2.2 不同DH 大米蛋白水解产物起泡性和起泡稳定性
不同DH 大米蛋白的起泡性和起泡稳定性结果如图2 所示。从图中可以看出与DH0 和WPC 相比,水解后的大米蛋白的起泡性均得到了显著的提升(P<0.05)。起泡能力由强到弱依次为DH8>DH5>DH3>DH10>DH12>DH14>DH17>DH0,整体呈现出先增加后降低的趋势。DH8 的起泡性在所有水解产物中最强,为172%,相比DH0,提升了40.0%,相比WPC 提高了46.5%。起泡稳定性结果表明,大米蛋白水解产物与WPC 都具有较好的稳定性,其起泡稳定性均在95%~99%,各组之间无显著性差异(P>0.05)。
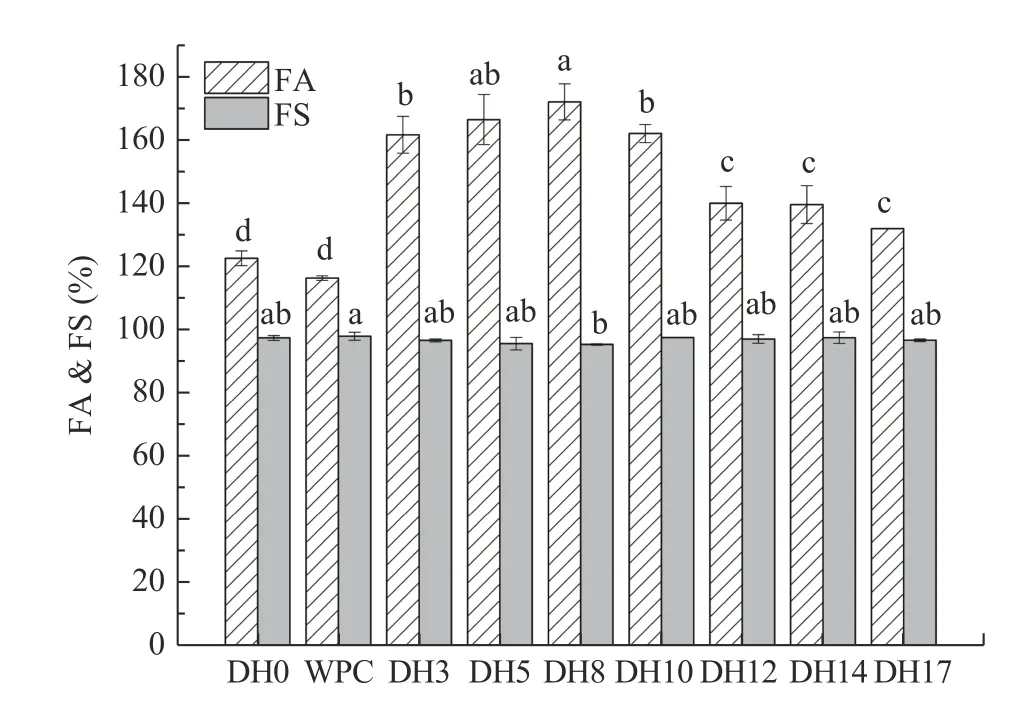
图2 不同水解度大米蛋白水解产物起泡性及起泡稳定性Fig.2 Foamability and foaming stability of rice protein hydrolysate with different degree of hydrolysis
溶解是保证蛋白起泡能力和泡沫稳定性的必要条件之一,溶解后的蛋白能够快速扩散至空气/水界面,降低表面张力,从而拥有较好的起泡性。本研究大米蛋白水解产物取自中性条件下的上清液,其起泡性都明显优于未水解的大米蛋白的起泡性(P<0.05)。这可能是因为大米蛋白水解产物主要由小分子肽构成,而小分子肽具有更好的两亲性和表面活性能力,能快速进入气液界面展开并重组界面,因此起泡性得到增强[20]。但当DH 超过8%时,随着DH 的增加,起泡性呈不断下降趋势。可能是DH 太大时,溶液中电荷数目激增,降低气液薄膜强度,过度的自我交联使片层弹力损失而导致泡沫塌陷,因而泡沫易破裂[21]。蛋白的泡沫稳定性主要由蛋白质溶液的流变学性质决定,如吸附膜中蛋白质的水合、浓度、膜厚度等决定。决定蛋白质泡沫稳定性的因素包括溶液的表面张力、表面粘度、液膜气体通透性和分子表面电荷。其中关键的因素是表面粘度和液膜的弹性[21]。实验结果表明各样品在起泡稳定性上无显著性差异,可能是因为各样品在表面粘度和液膜弹性上无明显差异。
2.3 不同DH 大米蛋白水解产物氨基酸组成分析
不同DH 大米蛋白水解产物的氨基酸组成如表1 所示。大米蛋白是优质的植物蛋白,具有氨基酸组成合理,致敏性低的特点。大米蛋白氨基酸种类丰富,含有人体必须氨基酸,DH0 中含量排前五位的氨基酸分别为:谷氨酸(14.09%)、天冬氨酸(7.23%)、精氨酸(6.17%)、亮氨酸(5.90%)、缬氨酸(4.36%),这与崔沙沙等报道的基本一致[22]。相比DH0,大米蛋白水解产物的含硫氨基酸、疏水性氨基酸含量明显降低(P<0.05)。半胱氨酸是大米蛋白二硫键形成的主要贡献者,从表中可以看出水解之后半胱氨酸的含量降低明显(P<0.05),这将有利于大米蛋白的溶解,与2.1 结果一致。
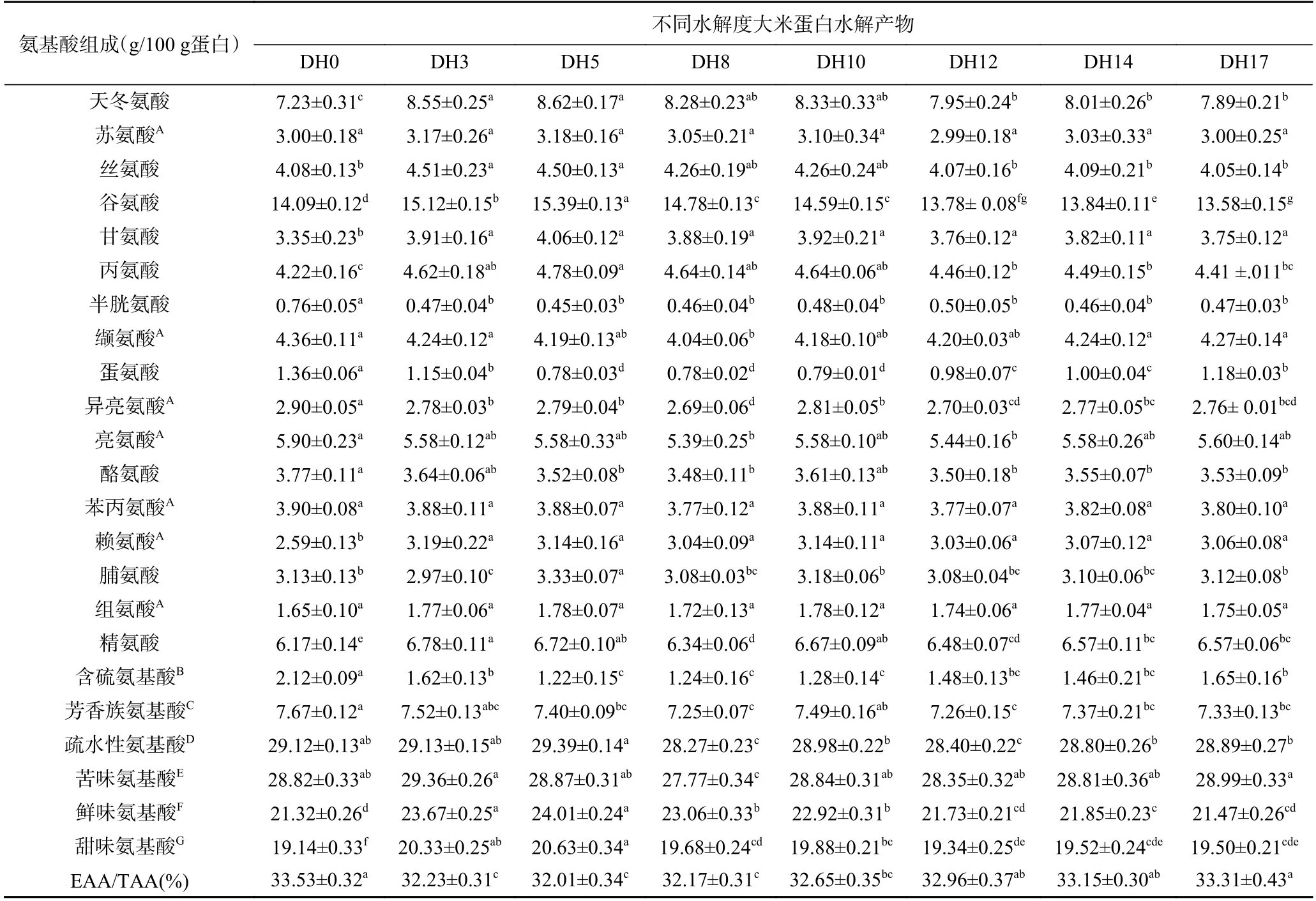
表1 不同水解度大米蛋白水解产物氨基酸组成(%)Table 1 Amino acid composition of rice protein hydrolysate with different degree of hydrolysis (%)
风味氨基酸的分类根据王彩理等[23]报道的进行分类。相比DH0、DH8 中的苦味氨基酸(组氨酸、精氨酸、蛋氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、色氨酸、赖氨酸)降低了3.6%,而DH3 和DH17 中提高了1.8%,但无显著性差异(P>0.05),说明水解后的大米蛋白的苦味没有明显的改变;除DH12、DH17 外,在水解样品中鲜味氨基酸(天冬氨酸、谷氨酸)的含量都得到了明显提升(P<0.05),DH5 时提升最多(11.0%),这表明水解之后的大米蛋白具有更强烈的鲜味,有利于蛋白口感的提升;大米蛋白水解产物中甜味氨基酸(甘氨酸、丙氨酸、脯氨酸、丝氨酸、苏氨酸、蛋氨酸)的含量均得到了显著的提升(P<0.05),DH5 中提升程度最大(7.8%),甜味的提升同样有利于消费者对水解蛋白样品的接受。上述结果表明,大米蛋白水解产物相比原大米蛋白而言在鲜味和甜味、苦味均得到一定程度的提高,且甜味和鲜味氨基酸提升程度大于苦味氨基酸提升程度,这将有利于提高回收蛋白的口感。
2.4 不同DH 大米蛋白水解产物的分子量分布
大米蛋白及其水解产物的SDS-PAGE 如图3所示。从第一泳道可以看出在此电泳条件下,蛋白marker 得到了较好的分离。RP 泳道(等同于DH=0 的泳道)出现30、20、12 kDa,还有分子量大于116 kDa的蛋白条带。其中30、20 kDa 条带分别对应酸性的α 亚基和碱性的β 亚基,12 kDa 是谷醇溶蛋白,它是大米谷蛋白不可或缺的一部分。出现的大于116 kDa 的蛋白条带是大米谷蛋白的聚集体。这也是大米谷蛋白溶解性差的原因之一。这一结果与Xu 等[13]的测定结果一致。Amagliani 等[24]利用SDS-PAGE 技术对大米蛋白进行分子量表征,发现存在大于250 kDa 的蛋白聚集体条带,与本研究中出现的大分子条带类似。DH3~DH10 样品的泳道出现的蛋白条带主要在20 kDa 以下,且14.4 kDa 以下为主。DH 大于10%(DH12-DH17)水解产物的条带集中在14.4 kDa,20 kDa 左右的条带已消失。表明随着角蛋白酶的酶解,大米蛋白的分子量不断减小,大米蛋白被降解为分子量更小的多肽。这一结果也与验证了2.1 中大米蛋白的回收率大幅增加以及2.2 中大米蛋白水解产物起泡性提高的猜想。水解产物分子量的降低也进一步说明角蛋白酶作用大米蛋白的可能机理是先还原大米蛋白中的二硫键,然后继续将其进行水解,从而产生分子量更小的多肽[11]。
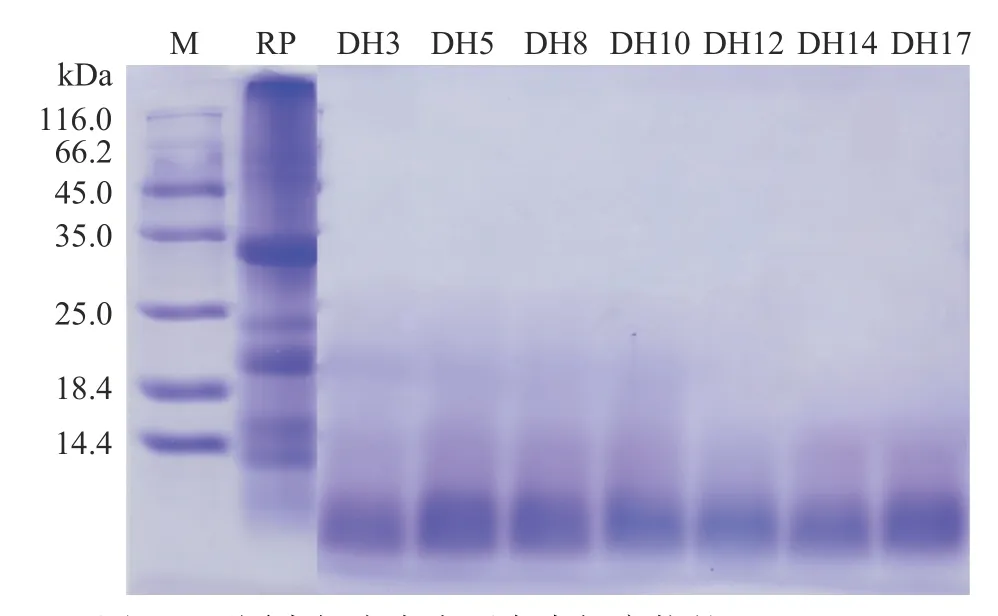
图3 不同水解度大米蛋白水解产物的SDS-PAGEFig.3 SDS-PAGE of rice protein hydrolysate with different degree of hydrolysis
2.5 不同DH 大米蛋白水解产物的二级结构测定
圆二色谱已逐渐被视作测定溶液状态存在的蛋白质二级结构的重要技术手段之一[25]。不同DH 大米蛋白水解产物的圆二色谱计算结果如表2 所示。相比DH0,水解之后大米蛋白的二级结构中α螺旋出现了显著的降低(P<0.05),由9.07%降低至4.72%(DH17),β折叠也出现显著的降低(P<0.05),由41.72%降低至38.15%(DH5),相反无规则卷曲含量出现了明显的增加(P<0.05),在DH10 中,无规则卷曲由25.27%增加至33.94%,增加了34.2%。
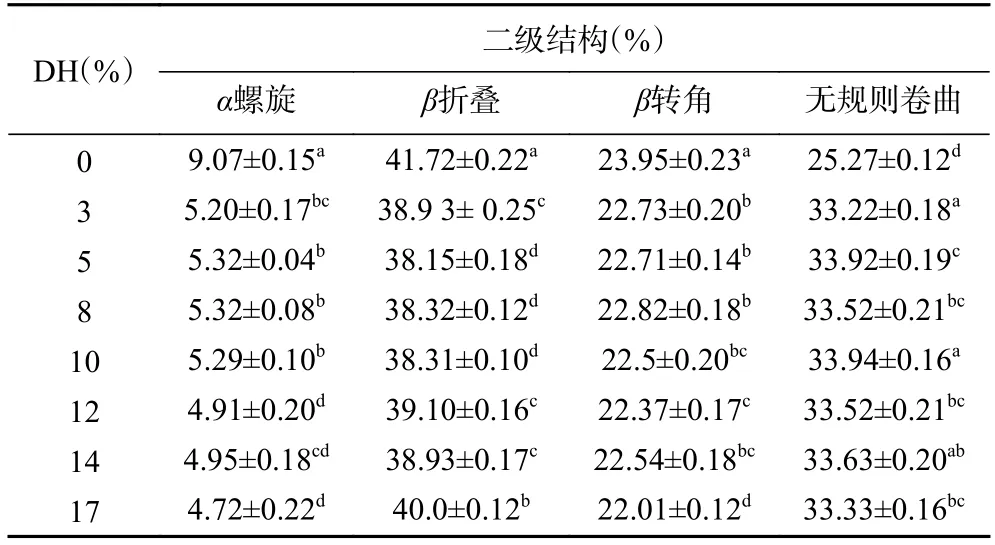
表2 不同水解度大米蛋白水解产物二级结构Table 2 The secondary structure of rice protein hydrolysate with different degrees of hydrolysis
β折叠结构被视作更为稳定的结构,而α螺旋,β转角,和无规则卷+曲被视作更为灵活和松散的二级结构[13,26]。由此可知,相比DH0,大米蛋白水解产物具有更加松散、灵活的二级结构,整体分子结构松弛,分子柔性增加,这也从侧面解释了为什么水解后大米蛋白在中性条件下的回收率能大幅提升的原因,另外结合SDS-PAGE 的实验结果,可以得出水解后的大米蛋白分子量更小,结构更灵活,因而更容易吸附到空气液体界面,从而提高其起泡性。王章存等[27]采用碱性蛋白酶酶解大米蛋白,发现酶解之后大米蛋白的α 螺旋含量明显降低,而β转角和无规则卷曲的比例大幅增加,这与本文结果基本一致。
2.6 不同DH 大米蛋白水解产物内源性荧光分析
内源性荧光能够反应蛋白质芳香族氨基酸在溶液中的暴露情况,即能够反应蛋白质的三级结构。280 nm 激发波长下,荧光光谱主要反应的是色氨酸和酪氨酸残基的荧光特性。大米蛋白及其水解产物的内源性荧光结果如图4 所示。从图中可以看出,相比DH0,大米蛋白水解产物的荧光强度均得到了明显提升,这表明由更多的色氨酸和酪氨酸残基被暴露出来,更多的疏水性基团的暴露会改善蛋白质的两亲性,进而影响蛋白质的功能性质,如:溶解性和起泡性。研究表明,荧光峰位置红移表明色氨酸残基暴露在溶剂中,蓝移则表明色氨酸基团位于更加疏水的环境中[28]。另外,相较于DH0,大米蛋白水解产物的整体波峰发生了明显的红移,这表明更多的色氨酸残基被暴露于水相,被转移到分子表面,原先包裹在蛋白质分子内部的疏水基团暴露到分子表面,蛋白结构会更加松散,这与圆二色谱的结果相吻合。大米蛋白水解产物的荧光强度呈现出先增加后降低的趋势,在DH 小于10%时,随着DH 的增加荧光强度增加,当DH 大于10%时,随着DH 的增加荧光强度下降。可能是因为当大米蛋白被过度水解时形成的小分子肽结构更灵活,在疏水相互作用下又重新聚集,从而出现荧光强度的下降[29]。
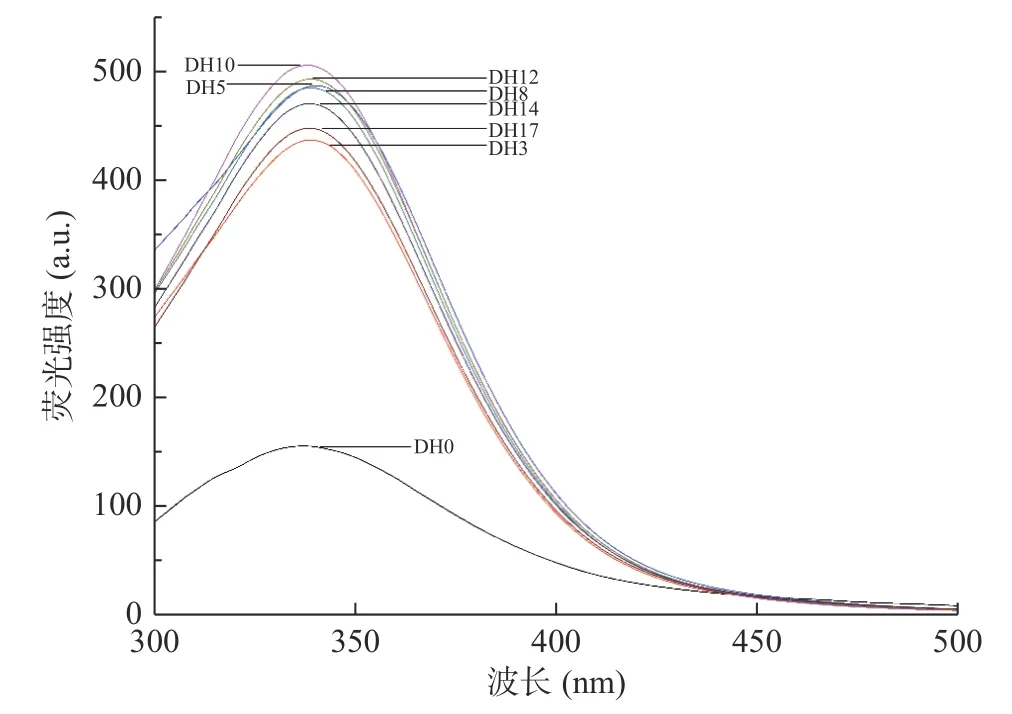
图4 不同水解度大米蛋白水解产物的内源性荧光Fig.4 Endogenous fluorescence of rice proteins hydrolysate with different degrees of hydrolysis
3 结论
本研究采用角蛋白酶对大米蛋白进行改性,并对其起泡性,氨基酸组成和相关结构进行测定。结果表明角蛋白酶能够显著提高大米蛋白在中性条件下的回收率,且回收蛋白具有较好的起泡性和起泡稳定性。大米蛋白水解产物中甜味氨基酸、鲜味氨基酸含量显著提升,这将有利于改善大米蛋白的风味。SDS-PAGE 结果表明,角蛋白酶能够将大米蛋白水解为分子量低于20 kDa 的小肽,且当DH 大于10%时,分子量低于14.4 kDa。圆二色谱结果表明大米蛋白水解产物的二级结构中无规则卷曲含量增加明显,α螺旋和β折叠的含量则明显下降,表明其结构更柔和、松散,有利于提高其溶解性。内源性荧光结果表明,相比未水解大米蛋白,大米蛋白水解产物的三级结构中暴露出更多的疏水性氨基酸。综上所述,角蛋白酶能够将大米蛋白降解为分子量更小,结构更灵活的柔性结构,从而提高大米蛋白的中性条件下的水溶性,改善其起泡性能和氨基酸组成。
