微生物源单宁酶的研究进展
2021-01-10詹晶晶刘虎虎卢向阳
詹晶晶,潘 虎,杨 辉,刘虎虎,王 翀,周 辉,卢向阳,田 云
(1.湖南农业大学生物科学技术学院,湖南长沙 410128;2.西藏自治区农牧科学院农业质量标准与检测研究所,西藏拉萨 850032;3.农业生物化学与生物转化湖南省高校重点实验室,湖南长沙 410128)
单宁是继纤维素、半纤维素和木质素之后第四类丰富的次生代谢产物,被认为是难降解且对机体有毒害的物质,但大量研究表明微生物、植物和动物中存在着一类能够降解单宁的水解酶—单宁酰基水解酶(单宁酶)[1],如植物的果实、树叶、树枝和树皮等部位[2],鱼的消化道以及羊的瘤胃等部位[3-4]。该酶能够催化没食子酸酯和单宁等底物中酯键和缩酚羧键的水解,释放没食子酸和葡萄糖[5]。自被发现以来,单宁酶已被广泛应用于食品、饲料、制药和化学工业[6]等行业。美国和日本等国家已将单宁酶审定为可用于食品工业的安全食品添加剂,我国卫生部2008年发布的第26号公文将单宁酶列入食品工业用加工助剂使用名单。随着日益增长的市场需求,国内外学者对单宁酶展开了深入研究分析。该文综述了不同微生物源单宁酶的酶学性质,作用机制及应用,展望了单宁酶的研究方向和应用前景,以期为单宁酶的研究与应用提供依据与借鉴。
1 微生物源单宁酶的来源
由于微生物的生物化学多样性、产酶稳定性、便于规模化培养等优点,目前工业大规模生产的单宁酶均来源于微生物[7],因此微生物源单宁酶是近年的研究热点。产单宁酶的微生物广泛存在于废水、粪便、堆肥、土壤、泡菜中[8],以真菌和细菌为主,其中真菌大多属于曲霉属、青霉属、木霉属、镰刀菌属、酵母菌等,细菌大多属于乳酸杆菌属、芽孢杆菌属、克雷伯氏菌属、链球菌属、沙雷氏菌属、链霉菌属、葡萄球菌属、假单胞菌属、肠杆菌属等[9-10],且部分已被开发用于工业规模化生产单宁酶[5]。真菌单宁酶在降解可水解单宁时表现出高活性,而细菌单宁酶可有效水解天然单宁和单宁酸[1]。单宁酶不同的底物特异性可能是由于其分子结构不同所致,这一发现对寻找具有新颖酶学特性的单宁酶具有重要的指导意义,为产单宁酶微生物菌株的选育提供了参考方向。
2 微生物源单宁酶的基本特性
微生物源单宁酶研究表明,单宁酶的不同来源及不同的培养条件是造成其酶学性质差异的主要原因[11]。该研究主要从分子质量、pH值、温度、金属离子、有机溶剂和表面活性剂等方面对单宁酶进行分析总结,探讨微生物源单宁酶的基本特性。
2.1 分子质量
单宁酶分子质量在31~320 kDa之间,由单个或多个亚基组成[12],不同来源的单宁酶分子质量差异较大。真菌单宁酶分子质量较大(45~320 kDa),存在同源或异源低聚体,有两个以上亚基[13]。RIUL A J等[14]发现的海枣曲霉单宁酶由120 kDa和93 kDa的两个大小亚基组成,BÖER E等[15]从酵母中发现了由四个相同亚基形成320 kDa的四聚体单宁酶。细菌单宁酶多为分子质量相对较小(31~90 kDa)的单体[11-13,16],但ROY S等[17]从链霉菌AL1L中发现的单体单宁酶分子质量较大(180 kDa)。真菌单宁酶均为糖蛋白,但细菌单宁酶未发现这种翻译后修饰[11],故真菌单宁酶分子质量较细菌单宁酶偏大。
2.2 稳定性
微生物源单宁酶的最适温度为30~40 ℃,30~60 ℃内热稳定性良好,但近年来一些嗜冷和嗜热单宁酶也相继被报道。KASIECZKA-BURNECKA M等[18]从南极轮枝孢属菌株中分离、鉴定到两种嗜冷单宁酶TAH1和TAH2,其最适温度分别为20 ℃和25 ℃;SABU A等[19]研究发现,多变拟青霉源单宁酶的最大酶活温度为60 ℃,这些发现拓展了微生物源单宁酶的应用范围,为单宁酶在废水等高温环境中的应用提供了可能。多数微生物源单宁酶的最适pH值为4.0~6.5,在pH 3.0~8.0之间稳定[13,15,16],但植物乳杆菌ATCC 14917T来源的单宁酶最适pH为8.0,且在pH为9.0时仍然保持88%的生物活性[11],这将拓展单宁酶在碱性环境中的应用。
2.3 活性
单宁酶一般不需要重金属类辅助因子,但重金属能够普遍抑制单宁酶的活性。BÖER E等[15]报道了Hg2+和Cd2+是酵母单宁酶的抑制剂,但Mg2+对大多单宁酶具有较好的促进作用[13,16,18],同时Mg2+却能够抑制黑曲霉ATTC 16620[19]、植物乳杆菌CECT 748T[20]来源的单宁酶活性。
有机溶剂能够普遍抑制单宁酶的活性,BENIWAL V等[16]报道了没食子酸酯对阴沟肠杆菌单宁酶活性的抑制作用,但JANA A等[13]研究发现,枯草芽孢杆菌源单宁酶在甲醇、乙醇和丙三醇存在时酶活得到大幅提高,这有助于单宁酶催化没食子酸和多种醇类在有机介质中通过酯化反应合成没食子酸酯。
表面活性剂通过与蛋白质分子的直接作用影响酶的催化活性,并减少疏水作用,从而有助于维持单宁酶的三级结构的稳定,对底物和酶在有机溶剂中的溶解度起着重要作用。1%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)对枯草芽孢杆菌源单宁酶活性具有促进作用,而吐温60、吐温80和Triton X-100具有明显的抑制作用[13];吐温20能够抑制轮枝孢属[18]和阴沟肠杆菌[16]源单宁酶的活性;SDS、吐温60和吐温80能够完全抑制青霉菌源单宁酶的活性[21];乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)强烈抑制了轮枝孢属源单宁酶的活性[18],不同的表面活性剂对不同的微生物源单宁酶活性表现各异。
上述研究表明,金属离子、有机溶剂和表面活性剂对不同微生物来源的单宁酶活性的影响各不相同,这可能是不同来源的单宁酶三级结构的差异所致,这些研究为工业上提升单宁酶的活性提供了可靠的基础数据。
3 微生物源单宁酶的蛋白序列特征
尽管许多微生物通过各种分析被鉴定为具有单宁酶活性,但在最近几年才开始陆续研究单宁酶的蛋白质序列,为单宁酶的异源表达重组生产提供了理论基础。AMRITAB等[22]从美国国家生物信息中心(national center for biotechnology information,NCBI)数据库中检索了149株细菌和36株真菌的单宁酶蛋白序列,其中只有77个细菌单宁酶和31个真菌单宁酶序列具有不同的氨基酸组成,对这些序列进行了生物信息学分析,如理化性质、超家族搜索、多序列比对、系统发育树构建和基序发现等。这些单宁酶存在多种超家族,一些细菌和真菌的序列与不同的超家族有相似性。单宁酶蛋白序列的多重序列比对显示,在不同的序列上有保守区域,氨基酸残基389~469和482~523之间具有最大同源性,可用于设计单宁酶产生菌和真菌特有的简并引物或探针。系统发育树显示了两个不同的类群,一个只有细菌,另一个既有真菌又有细菌,显示了这些不同属之间的某种关系。虽然在第二簇中,几乎所有的真菌物种都被发现在一个角落里,这表明真菌属之间的序列水平相似性。14个基序的分布表明,基序1的特征氨基酸序列为29个氨基酸,即GCSTGGREALKQAQRWPHDYDGIIANNPA,在83.3%的单宁酶序列中均能观察到,它参与了结构和酶功能。对细菌和真菌来源的单宁酶蛋白序列进行了分析,序列水平的相似性可用于设计基于简并引物聚合酶链式反应(polymerase chain reaction,PCR)扩增的基因克隆。来自细菌和真菌的序列有着基本的关系,因为它们具有基序特性。基于单宁酶蛋白序列相似性的信息也可以用来研究细菌和真菌之间进化关系的一部分。另一方面,理化参数分析可以用来预测单宁酶的结构。
4 微生物源单宁酶的作用机制
IIBUCHI S等[23]研究了米曲霉单宁酶的水解途径、抑制作用和底物特异性。研究显示,单宁酶可催化水解单宁中的葡萄糖没食子酸酯生成没食子酸和葡萄糖,水解中间产物有1,2,3,4,6-黄棓酰单宁、2,3,4,6-四棓酰单宁及两种单体没食子酸葡萄糖,单宁水解反应途径如图1所示。
由图1可知,单宁酶由酯酶和缩酚羧酶混合物组成,以酯酶为主,分别具有酯键和间双没食子酸键的特异性,因此单宁酶可水解单宁中的酯键(醇基的没食子酰酯)和缩酚羧键(没食子酸的没食子酰酯)。含有酚羟基的底物类似物,无论其是否含有羧基,均可竞争性抑制单宁酶的活性,而不含酚羟基的底物类似物不抑制单宁酶的活性,即单宁酶只对某些酚羟基底物起作用。由此可见,单宁酶对底物是否具有催化作用取决于酶-底物复合物(enzyme-substrate compound,ES)的形成。ES的形成有以下三个特点:(1)组成底物酯、醇的结构没有限制,但酸必须是没食子酸;(2)任何酚羟基都可能与酶的结合位点发生反应,抑制形成真正的ES复合物;(3)由于酯键或羧基化合物没有被水解或抑制酶活性,酯键、羧基本身与酶不结合,除非它含有酚羟基。
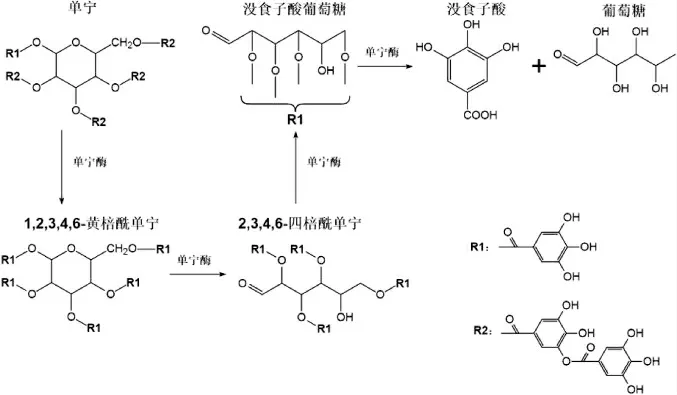
图1 单宁水解的反应途径Fig.1 Reaction pathway of tannin hydrolysis
REN B等[24-25]成功解析了植物乳杆菌单宁酶的晶体结构(图2),研究发现植物乳杆菌单宁酶主要由一个保守的α/β水解酶折叠和一个插入水解酶折叠末端的cap结构域组成。α/β水解酶由18个α螺旋和13个β折叠组成,水解酶折叠结构域是由Ser163、Asp419和His 451组成的催化三联体。在该结构中,有一个五肽活性位点基序,丝氨酸位于五肽序列基序中心,即Gly161-X-Ser163-X-Gly165(X=任何氨基酸残基),属于典型的丝氨酸水解酶,而cap结构域是参与底物结合的结构特征。在没食子酸的结合过程中,没食子酸的羧基与酶的催化三联体形成氢键相互作用,而没食子酸的三个羟基则与Asp421、Lys343和Glu357形成另一个氢键网络。突变研究表明,催化三联体和与没食子酸羟基相互作用的三个残基对与单宁酶活性是必不可少的,每一个残基的定点突变都导致单宁酶活性几乎完全丧失。前文提到的重金属离子Hg2+和Cd2+抑制单宁酶活性,也是由于单宁酶的催化三联体被破坏所致。
根据单宁酶的晶体结构,REN B等[24]提出了单宁酶催化单宁底物水解的机理。当底物结合时,Ser163的羟基对没食子酸单元的羰基发起亲核攻击,His451起协助作用,形成四面体中间体,该中间体通过与Gly77和Gly164的相互作用形成氢键来保持稳定。在His451-H作为一种普通酸时,四面体中间体将分解形成醇产物和酰基-酶中间体。随后水分子被His451激活,攻击酰基酶,形成第二个四面体中间体,该中间体分解释放没食子酸并使酶再生,His451通过与Asp419和Cys204相互作用形成氢键来保持稳定。单宁酶结构的解析为进一步揭示单宁酶与底物的作用机制、修饰单宁酶以满足多方面的应用提供了重要的分子理论基础。
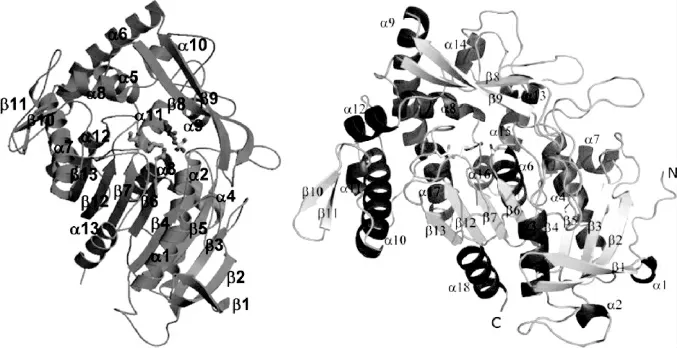
图2 植物乳杆菌单宁酶的结构[24,25]Fig.2 Structure of tannase from Lactobacillus plantarum
5 微生物源单宁酶的应用
单宁酶具有较好的生物活性,已经被广泛应用于各行各业中,该文将从食品、饲料、制革、精细化工业等方面探究单宁酶的实际应用价值。
5.1 食品工业
单宁酶主要被用于速溶茶、葡萄酒和果汁等产品的处理,这将有助于提升高单宁产品的品质。茶膏的形成增大了茶叶加工中的浑浊度,单宁酶处理后可改善茶饮料冷后浑现象[26],减少速溶茶中茶膏的形成[27],提高茶饮料的澄清度[28],还可以增加多酚类物质在冷饮中的溶解度[29],改善色泽、脂肪含量和抗氧化性能等[30]。山楂汁[31]、芒果汁[32]、柿子汁[33]等高单宁果汁在储存时容易形成苦涩味,单宁酶处理后能够显著降低果汁的苦涩度,提升果汁的口感及品质[34]。葡萄酒酿制过程中加入单宁酶可水解橡木桶中析出的单宁,使葡萄酒具有浓郁的芳香和诱人的色泽,可大幅降低葡萄酒的苦涩味,提高葡萄酒的品质及经济价值[35]。此外,DE QUEIRÓS L D等[36]首次利用单宁酶来增加豆浆中异构体的含量从而提升其抗氧化活性,ROBERTO B S等[37]将固定化的单宁酶用来增加茶的抗肥胖和降血糖活性,单宁酶在食品工业上的应用越来越广泛。
5.2 饲料工业
研究表明高水平的膳食单宁对动物营养具有不良影响,单宁能与蛋白质、淀粉、纤维素、矿物质等形成牢固的复合物,可降低动物的摄食量、降低蛋白质消化率、抑制消化酶活性或直接引发全身毒性,对反刍动物具有毒性或抗营养等作用,严重影响家畜的生产效率及品质[38]。然而,单宁广泛存在于自然界的饲料和牧草中,如树叶、农副产品、农业废弃物等,经单宁酶处理后的饲料,其单宁含量显著降低[39]、营养成分得到改善[40]、适口性和消化吸收率得到提高[41],从而提高畜牧养殖业的经济效益[42]。
5.3 制革工业
动物皮革制作过程中通常会产生大量高单宁废水,对周围的植物、动物和微生物具有较强的毒害作用,如何消除制革废水中大量的单宁是摆在生态环境保护面前的重大问题。传统的生物氧化法、混凝法或活性炭吸附法等容易造成单宁的相转移[43],不能有效的去除废水中大量的单宁,无法实现废水资源的循环再利用。近年来,微生物源单宁酶被广泛应用于制革废水的无害化处理过程中[44],SHARMA S等[21]使用黑曲霉和可变青霉单宁酶处理制革洗脱液可使单宁含量分别降低45%和36%。
5.4 精细化工业
没食子酸和没食子酸丙酯是重要的抗菌、抗病毒、抗肿瘤等生物活性物质[45],是重要的高附加值产品。目前,没食子酸和没食子酸丙酯的大规模生产主要采用化学法,高温、高压、强酸的生产环境,不仅耗能较高,且容易造成严重的工业“三废”污染,急需高效、清洁、环境友好型的没食子酸和没食子酸丙酯生产工艺。单宁酶可催化可水解的单宁(主要是单宁酸)水解形成没食子酸,同时可通过单宁酸的酯交换反应和没食子酸与各种醇在有机介质中的酯化反应来合成没食子酸酯。酶水解法生产没食子酸和没食子酸丙酯可以在温和的条件下进行,并且形成的工艺副产物较少,单宁酶是没食子酸和没食子酸丙酯[43]生产的重要基础。目前使用单宁酶催化合成没食子酸丙酯是在有机介质中进行的,但是一些有机溶剂对人体有很高的毒性。因此,寻求更安全、高效的非水介质,提高底物转化率,对今后研究酶法合成没食子酸酯具有重要意义。
6 展望
单宁结构复杂,应用行业环境不同,需要可以适应不同底物、温度、pH值、金属离子、表面活性剂和有机溶剂的单宁酶。但目前,微生物源单宁酶主要来源于可培养微生物,而绝大部分的微生物都是不可培养的,急需采用宏基因组学方法挖掘更多尚未被发现的单宁酶基因,增加单宁酶的来源。同时,较高的工业生产成本限制了单宁酶的大规模应用,急需采用合成生物学、酶的定向突变等技术构建功能强大的单宁酶高产基因工程菌,降低单宁酶的使用成本,提高其工业化应用产出比。笔者目前拟使用定点突变技术构建高效分泌表达单宁酶的工程菌,以期建立基于酶法的五倍子单宁生产没食子酸的绿色工艺,促进产业的高效可持续发展。
