黄芪菟箭合剂对高糖诱导的足细胞损伤及凋亡的影响
2021-06-18王亚荣董兆珵刘宝利尹德海朴元林
王亚荣,董兆珵,张 娜,刘宝利,郭 传,尹德海*,朴元林#
(1北京协和医学院,中国医学科学院,北京协和医院中医科,北京 100730;2首都医科大学附属北京中医医院肾病科;3中国中医科学院,广安门医院肾病科;*通讯作者,E-mail:yindehai123@126.com;#共同通讯作者,E-mail:pumchpyl@163.com)
糖尿病肾病(DKD)特征性临床表现是蛋白尿,随着病情的进展,可能会出现蛋白尿伴动脉高压,导致肾小球滤过率(GFR)下降和肾小球硬化,最终发展为终末期肾病(ESRD)[1]。DKD是糖尿病(DM)患者死亡的主要原因,也是ESRD的主要原因,约有30%-47%的DKD往往发展为ESRD[2]。足细胞附着于肾小球基底膜的外侧,是维持肾小球滤过屏障完整性的重要细胞,其结构和功能的异常参与了蛋白尿的发生发展[3-5]。因此,足细胞的损伤被认为是DKD的始动环节,对于寻找足细胞损伤的机制,预防其结构和功能的异常或许是寻找DKD有效治疗方案的关键。
传统的DKD治疗方法如控制饮食、降低血糖水平以及药物治疗[6]的疗效有限,并不能够延缓或阻止DKD的进展[7]。因此,研究DKD的发病机制,探讨DKD的防治措施具有十分重要的临床意义。既往已有诸多临床观察证实了中药在DKD的预防和治疗中起着重要作用[8,9],因而目前许多DKD患者采用中西医结合的综合治疗方案。本课题组已在前期实验证明了中药菟箭合剂可以通过抑制肾小球TGF-β1的表达和肾皮质蛋白激酶C的活性而显著降低糖尿病大鼠模型尿蛋白水平[10,11],而黄芪及其提取物对DKD亦有良好的治疗作用[12]。黄芪菟箭合剂(Huangqi Tujian decoction,HTD)是一种常用的中药处方,其成分包括生黄芪、菟丝子、鬼箭羽、汉防己,已被广泛应用于临床治疗。本研究在前期试验的基础上,首次在体外研究观察HTD,即已证实对降低蛋白尿有明确疗效的中药黄芪与菟箭合剂的中药联合处方,对高糖诱导足细胞损伤及凋亡机制的影响,以其为HTD的临床应用及DKD足细胞损伤的可能机制提供依据。
1 材料和方法
1.1 材料
永生化小鼠肾小球足细胞,由首都医科大学附属北京中医医院的刘宝利教授提供。HTD配方颗粒购自四川新绿医药科技有限公司,对应中药饮片每日处方剂量含黄芪30 g,菟丝子15 g,鬼箭羽30 g,汉防己10 g。
1.2 主要试剂
RPMI-1640培养基购于美国Hyclone公司,胎牛血清、0.25%胰蛋白酶EDTA消化液和含5%DAPI抗荧光衰减封皮剂购于美国Gibco公司,Alexa Fluor 594购于美国Thermo Fisher公司,WES试剂盒购于美国Protein Simple公司,BCA蛋白定量试剂盒购于中国上海碧云天生物技术公司,CytoTox96Non-Radioactive试剂盒购于美国Promega公司,兔抗鼠Nephrin多克隆抗体(ab58968)购于美国Abcam公司,兔抗鼠ZO-1多克隆抗体(21773-1-AP)购于美国Proteintech公司,兔抗鼠NF-κB多克隆抗体(10745-1-AP)购于美国Proteintech公司,兔抗鼠Caspase多克隆抗体(19677-1-AP)购于美国Proteintech公司,山羊抗兔IgG(ZF-0511)购于中国北京中杉金桥生物技术有限公司,鼠GAPDH抗体(60004-1-Ig)购于美国Proteintech公司。
1.3 仪器与设备
恒温CO2培养箱(美国Thermo Fisher公司),超速离心机(美国Beckman公司),Gen5酶标仪(美国BioTek公司),荧光显微镜(LSM800,德国ZEISS公司),WES全自动蛋白表达分析仪(美国Protein Simple公司)。
1.4 HTD冻干粉的制备
将HTD配方颗粒在100 ℃下加热煎煮3次,每次2 h,用纱布过滤后合并3次滤液,用旋转蒸发仪将滤液减压浓缩至膏状(温度设定50 ℃,转速设定40 r/min),随后将浸膏置于冷冻干燥机中冷冻干燥,工艺流程如下:在-20 ℃处预冻2 h,在-25 ℃处升华干燥48 h,5 ℃解析干燥20 h。干燥结束后关闭真空泵,收集干燥粉末样品,-20 ℃密封保存。
1.5 足细胞培养
从液氮中取出足细胞,并迅速转移到细胞间。将细胞在37 ℃水浴锅中解冻,解冻后的足细胞转移入培养皿中,加入4 ml包含10%胎牛血清和50 U/ml干扰素γ的1640培养基,在包含5% CO2的33 ℃培养箱中培养。待足细胞长满70%-80%以后可进行传代,加入包含10%胎牛血清的1640培养基,在包含5% CO2的37 ℃培养箱中继续培养。待细胞在10-14 d完全分化后,方可进行后续实验。
1.6 乳酸脱氢酶(LDH)释放率分析法检测黄芪菟箭合剂的最佳药物浓度
取对数生长期的足细胞,PBS清洗,胰蛋白酶在37 ℃培养箱消化3 min。待细胞消化完全后加入包含10%胎牛血清的1640培养基终止消化,1 000 r/min离心5 min。弃上清,加入包含10%胎牛血清的1640培养基均匀混合。取10 μl细胞液在镜下计数。以0.8×104的密度接种于96孔板,每孔100 μl在37 ℃培养箱孵育24 h,待细胞完全贴壁后加入不同浓度的黄芪菟箭合剂(0.25,0.5,0.75,1,1.25,1.5 mg/ml)干预24 h,加入CytoTox96Non-Radioactive试剂孵育30 min,用酶标仪测定每组在490 nm的吸光度值。
1.7 观察高糖和HTD对足细胞形态的影响
为了观察高糖和HTD对足细胞形态的影响,将足细胞随机分为4组。未分化足细胞组加入包含10%胎牛血清和50 U/ml干扰素γ的1640培养基;分化足细胞组加入包含10%胎牛血清的1640培养基;高糖刺激组先加入包含10%胎牛血清的1640培养基,待细胞分化良好时,再加入30 mmol/L的葡萄糖;HTD刺激组先加入包含10%胎牛血清的1640培养基,待细胞分化良好时,再加入0.75 mg/ml HTD,孵育24 h后在光学显微镜下观察各组足细胞形态。
1.8 免疫荧光分析足细胞Nephrin、ZO-1、Caspase、NF-κB的表达
为了定性观察高糖和HTD对足细胞目标蛋白Nephrin、ZO-1、Caspase、NF-κB的影响,我们进行免疫荧光分析。将分化的足细胞随机分为对照组、高糖组和HTD组。对照组和高糖组分别加入1640培养基,HTD组加入0.75 mg/ml HTD,在37 ℃培养箱孵育24 h后,对照组、高糖组和HTD组分别再用5,30,30 mmol/L葡萄糖刺激。24 h后1 ml PBS洗涤3次,1 ml 4%多聚甲醛在4 ℃下固定20 min。用含0.1% Triton(PBST)的PBS洗3次,每次5 min。足细胞膜在室温下用0.5%TritonX-100渗透30 min,PBST再次洗涤3次,每次5 min。1 ml 5%牛血清白蛋白(BSA)在室温下阻断细胞30 min,丢弃BSA,将足细胞与兔抗小鼠原代抗体在4 ℃下孵育24 h。丢弃一抗,PBS洗涤细胞3次,每次5 min。随后,细胞与山羊抗兔二次抗体在37 ℃下孵育1 h。然后用5% DAPI染色足细胞核,用AlexaFluor594染色靶蛋白。最后,在荧光显微镜下观察细胞。
1.9 Western blotting分析足细胞Nephrin、ZO-1、Caspase、NF-κB的表达
为了定量观察高糖和HTD对足细胞目标蛋白Nephrin、ZO-1、Caspase、NF-κB的影响,我们进行Western blotting分析。按照1.8的分组进行干预。24 h后弃去培养基,收集细胞。将样本在含蛋白酶抑制剂和磷酸酶抑制剂的裂解液中裂解30 min,12 000g离心10 min。收集上清液,并用BCA定量分析试剂盒测定蛋白质浓度。随后,使用WES试剂盒在北京中医药大学第一附属医院进行Western blotting。参照WES试剂盒说明书,设定WES自动蛋白质表达分析设备温度在18-24 ℃和湿度在20%-60%之间,以确保WES套件的正确性能。依次加入样品缓冲液稀释好的蛋白、一抗、二抗、发光液,最后在样品板中加入500 ml洗涤缓冲液。样品板在2 500g下室温离心5 min后,将样品板放入WES自动蛋白质表达分析设备中,自动运行3 h。之后,我们使用Compass软件对获得的数据进行了分析。
1.10 统计学分析

2 结果
2.1 LDH释放法筛选HTD的最佳药物浓度
黄芪菟箭合剂浓度在0.75 mg/ml时,其LDH释放率最低,称其为亚杀伤浓度(见图1)。因此,0.75 mg/ml HTD被作为后续实验的给药浓度。
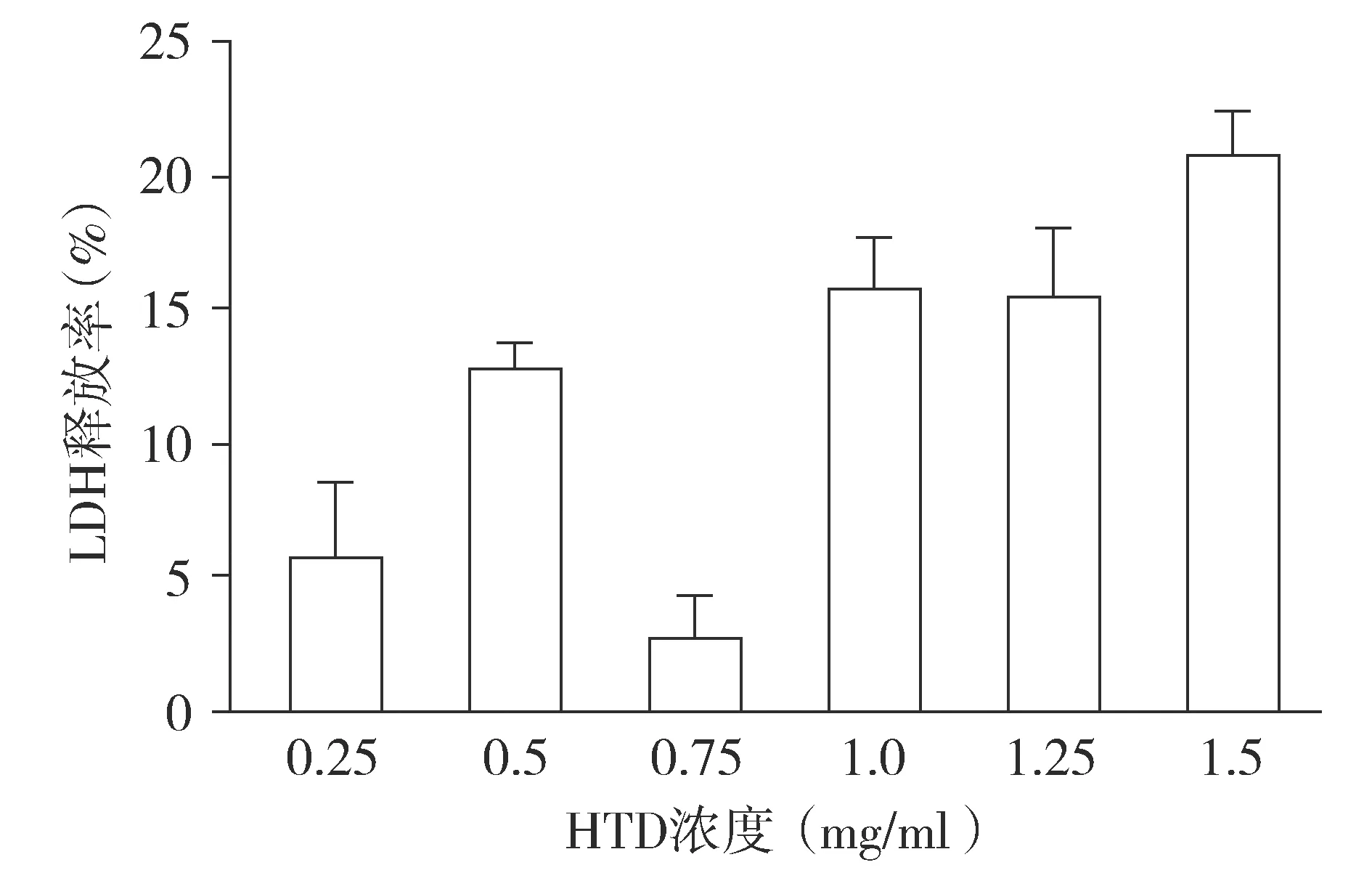
图1 黄芪菟箭合剂(HTD)作用于足细胞最佳浓度Figure 1 The optimal concentratin of Huangi Tujian decoction(HTD) to podocytes
2.2 高糖和HTD冻干粉对足细胞形态的影响
与未分化的足细胞相比,分化的足细胞胞体和细胞核明显增大,形态从纺锤体改为星状;与正常组相比,高糖组足细胞形态明显改变,部分细胞表现为凋亡或坏死(见图2),提示高糖环境可诱导足细胞造成损伤,而HTD组足细胞形态无明显改变,结果表明HTD冻干粉对足细胞形态没有明显影响。
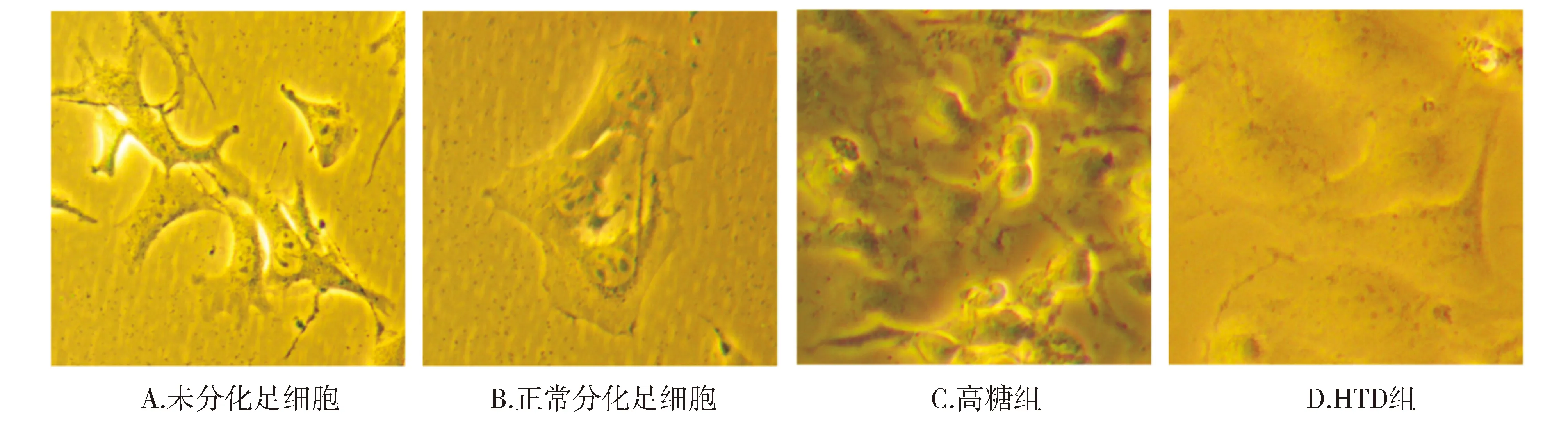
图2 高糖和HTD对足细胞形态的影响Figure 2 Effect of high glucose and HTD on the morphology of podocytes
2.3 HTD对高糖诱导的足细胞标志蛋白Nephrin和ZO-1的影响
与正常组相比,高糖组的足细胞标志蛋白Nephrin和ZO-1的表达显著降低(P<0.05),而与高糖组相比,HTD组Nephrin和ZO-1蛋白水平显著升高(P<0.05,见图3)。这些结果表明HTD可以干预高糖诱导的足细胞损伤。
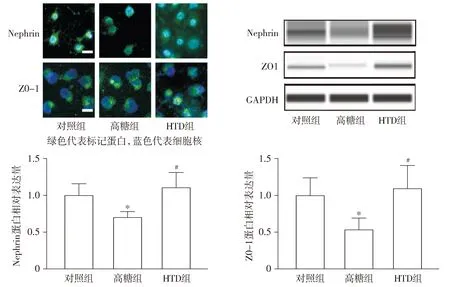
与对照组相比,*P<0.05;与高糖组相比,#P<0.05图3 免疫荧光和Western blot检测HTD对高糖诱导的足细胞标志蛋白Nephrin和ZO-1的影响Figure 3 Effect of HTD on podocyte-related protein Nephrin and ZO-1 induced by high glucose using immuno-fluorescence and Western blot
2.4 HTD对高糖诱导的足细胞凋亡蛋白NF-κB和Caspase的影响
与正常组相比,高糖组足细胞凋亡蛋白NF-κB和Caspase的表达显著升高(P<0.05),而与高糖组相比,HTD组NF-κB和Caspase蛋白水平显著降低(P<0.05,见图4)。这些结果表明高糖可以通过促进足细胞凋亡造成其损伤,而HTD可以通过干预凋亡途径减轻高糖诱导的足细胞损伤。
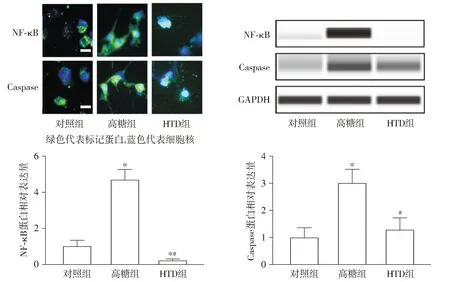
与对照组相比,*P<0.05;与高糖组相比,#P<0.05图4 免疫荧光和Western blot法检测HTD对高糖诱导的足细胞凋亡蛋白NF-κB和Caspase的影响Figure 4 Effect of HTD on podocyte apoptosis-related proteins NF-κB and Caspase induced by high glucose using immunofluorescence and Western blot
3 讨论
DKD是DM的常见并发症,也是全球ESRD的主要原因[13,14],严重影响糖尿病患者的生活质量和生命安全[15]。足细胞,即肾小囊脏层上皮细胞,它附着于肾小球基底膜的外侧,连同血管内皮细胞和肾小球基膜一起构成了肾小球血液滤过屏障,是维持肾小球正常滤过功能的主要细胞类型之一[16]。正常机体的肾小球足细胞是一种终末分化细胞,一旦受损就不会再生,体外培养的原代细胞也不能增殖,因此我们实验均采用永生化的肾小球足细胞[17,18]。而足细胞的损伤和凋亡也是引发DKD的重要因素[17,19]。因此,保护足细胞对DKD的防治具有重要作用。目前,DKD的临床治疗方案主要包括药物治疗[20]和改变生活方式[21],而中药由于其治疗DKD的有效性近年来备受关注[22]。HTD是一种常用的中药处方,其成分生黄芪及菟箭合剂均已在前期研究中证实了其减轻尿蛋白水平的有效性[12],但其对足细胞的作用以及机制尚未有学者进行研究。基于此,本研究首次在体外研究了HTD对足细胞的保护作用。
本研究首先利用LDH释放率检测HTD作用于足细胞的最佳药物浓度为0.75 mg/ml,且在该浓度时对足细胞形态无明显影响,而高糖刺激会引起足细胞形态的破坏,导致部分细胞凋亡或坏死,因此我们用该浓度HTD刺激足细胞进行后续实验。
基于Nephrin和ZO-1和两种连接蛋白在足细胞的形态与功能中的重要作用,本研究重点探讨了该蛋白在足细胞的表达水平的变化。Nephrin是一种黏附蛋白,主要表达于肾小球足细胞胞间连接处,是足细胞裂孔膜的关键成分,也是肾小球滤过屏障的主要成分。人类中的nephrin基因突变或动物遗传模型中的缺失均会导致足突形成发育失败。诸多研究表明,在各种有蛋白尿表现的肾病和肾小球疾病患者与动物模型中,Nephrin的表达降低,其对于成年成熟肾小球损伤后足细胞的恢复是必需的[23]。此外,糖尿病肾病患者的肾脏切片显示Nephrin表达降低,并与疾病严重程度成比例[24]。由于在肾小球疾病中已证实足细胞减少与肾脏疾病病情进展有关,所以观察到的Nephrin表达下降可能是由于足细胞密度下降所致。Verma等[23]进一步证实Nephrin在维持足细胞间连接及足细胞损伤后重建连接过程中的重要作用,Nephrin表达下降会对足细胞损伤后的恢复能力造成负面影响,从而使其易于分离,参与蛋白尿的形成。ZO-1是一种连接蛋白,参与一些紧密连接的结构组成及功能发挥,也在足细胞与裂隙隔膜的连接处表达。既往有研究发现在糖尿病动物模型中可观察到肾小球中ZO-1的表达降低且重新分布,证明ZO-1表达水平和定位的改变可能与糖尿病性蛋白尿的发病机制有关[25]。肾脏中的肾小球足细胞起源于具有紧密连接的柱状上皮细胞,在足细胞分化过程中,紧密连接被缝隙隔膜代替,缝隙隔膜形成于足突之间,并起着血液过滤屏障的作用。尽管在足细胞分化过程中抑制了最紧密连接成分的表达,但始终表达包括ZO-1和ZO-2在内的几种成分,而足细胞ZO-1基因的特异性缺失会损害缝隙隔膜的形成,从而导致蛋白尿和肾小球硬化[26]。
本研究根据Nephrin和ZO-1和蛋白的表达水平间接评估足细胞的状态,观察到高糖组Nephrin及ZO-1表达水平下降,远低于正常组,经不影响足细胞形态的HTD干预后的足细胞在高糖环境刺激后,两种蛋白的表达水平仍高于高糖组,进一步证实了HTD干预可抑制高糖刺激所引起的Nephrin及ZO-1蛋白的表达水平下降,减少足细胞的损伤。
在高糖的长期刺激下,足细胞激活氧化应激反应,释放大量反应活性氧(ROS),参与到足细胞凋亡中,这是DKD足细胞数量减少的主要原因[27]。在DKD小鼠模型中,足细胞中Caspase的表达和Gasdermin D(GSDMD-N)的裂解显著增加,Nephrin和Podocin蛋白的表达减少,足细胞足突的损失和融合,炎性细胞因子NF-κB增加[28],因此,在本研究中选择Caspase和NF-κB评估足细胞的凋亡水平以阐明HTD对足细胞凋亡的影响机制,发现高糖刺激后足细胞Caspase和NF-κB表达水平显著提高,提示高糖刺激可诱导足细胞的凋亡,其机制可能是持续的高糖可以促进RAC1的激活,从而导致ROS释放的增加和NF-κB的激活,从而诱导足细胞凋亡[29]。而经HTD干预后再以高糖环境刺激,足细胞Caspase与NF-κB表达水平明显低于高糖组,提示其可减少足细胞凋亡,从而保护足细胞,减轻蛋白尿症状。除HTD外,已有研究证实梓醇可以通过抑制NOX4减轻ROS的产生,并抑制TLR4/MyD88和p38 MAPK信号通路来阻止NF-κB活化和转移到核中,从而改善细胞凋亡和炎症[30];雷公藤甲素也是通过抑制NF-κB/GADD45B信号传导减弱蛋白尿和足细胞凋亡,这些研究都证明了NF-κB信号在细胞凋亡和炎症中起重要作用,从另一个角度证明可抑制NF-κB表达的HTD有着保护足细胞、减轻蛋白尿的可能。
综上所述,本研究证实了HTD可以减轻高糖诱导的足细胞损伤以及减少足细胞凋亡,通过保护足细胞,可以减少蛋白尿以及DKD的进展,为今后临床上中西医结合治疗DKD提供了新的方向。但同时,本研究只是在细胞层次上证实了中药黄芪菟箭合剂复方对足细胞的影响,具体的中药有效成分以及相关通路仍然需要被进一步探讨,以便为临床预防和治疗DKD提供更有效的方案。
