色素上皮衍生因子联合顺铂对卵巢癌的抑制作用
2021-06-18陈巧玲白亦光张家勇
陈巧玲,白亦光,别 俊,杨 蜜,张家勇
(1川北医学院第二临床医学院,南充市中心医院肿瘤科,南充 637000;2川北医学院第二临床医学院,南充市中心医院骨科;*通讯作者,E-mail:baiyiguang@163.com)
卵巢癌是常见的女性生殖系统恶性肿瘤,依据其病理分型可分为上皮癌、恶性生殖细胞肿瘤,严重威胁患者生命健康。目前常规治疗方式包括手术治疗、化学疗法、放射疗法、靶向治疗和免疫治疗等[1]。由于肿瘤位居盆腔深处,体积较小,早期难以发现,确诊时常常已发展为晚期。手术难以完整切除,需要辅以化疗、放疗等。
色素上皮衍生因子(pigment epithelium-derived factor,PEDF)是一种分子量为50 kD的内源性糖蛋白,属于非抑制性丝氨酸蛋白酶抑制剂家族,具有很强的神经分化活性。PEDF在胎儿视网膜上皮细胞条件培养基诱导视网膜母细胞瘤细胞神经元分化的实验中发现的一种新的神经活性因子[4]。此外,PEDF在肿瘤的表达水平与肿瘤生长和转移呈负相关[5]。鉴于衰老、血管生成和炎症反应在肿瘤生长和转移中的病理作用,补充PEDF蛋白和/或增强内源性PEDF表达可能是治疗癌症的一种新的治疗策略。
因此,本研究将联合PEDF和顺铂在体内外共同干预ID8细胞株以及卵巢癌动物模型,观察两种药物协同治疗能否取得良好的治疗效果。
1 材料与方法
1.1 实验动物
C57BL/6小鼠24只,雌性,8周龄以上,购于川北医学院实验动物中心。
1.2 材料和仪器
小鼠卵巢癌ID8细胞(中科院上海细胞库,中国);RPMI-1640细胞培养液(Sigma);顺铂(DDP,江苏豪森医药公司,中国);胎牛血清(FBS)和胰酶(Thermo公司,美国);细胞凋亡检测试剂盒(BD公司,美国);酶标仪(Thermo公司,美国);低温离心机(Eppendorf公司,德国),荧光倒置显微镜(Olympas公司,日本)。重组小鼠PEDF蛋白(Abcam公司,英国)。
1.3 小鼠卵巢癌细胞的培养
ID8细胞株用含10%FBS的RPMI-1640完全培养液,置于37 ℃、CO2为5%的培养箱中培养,待细胞呈贴壁生长,汇合度达到80%-90%时,消化传代培养,采用0.25%的胰蛋白酶消化后传代。
1.4 细胞增殖能力检测
CCK-8体外培养ID8细胞,当细胞融合度达到80%时,使用0.25%胰蛋白酶消化细胞,离心,重悬后,以2 000/孔密度接种于96孔板上,在37 ℃,5%CO2浓度的培养箱中培养,24 h后使用含有药物的完全培养基换液,每个浓度3个副孔,其中三组细胞分别加入100 μl PBS、100 μl PEDF(50 μg/ml)、50 μl PEDF(100 μg/ml)+50 μl DDP(20 μg/ml)培养12,24,36,48 h后,每孔加入10 μl CCK-8,将96孔板放回细胞培养箱孵育2 h,通过Microplate Reader 795酶标仪测450 nm波长处的OD值,并进行数据统计分析。
1.5 细胞迁移能力检测
收集取生长状态良好对数生长期的细胞,采用划痕实验检测各组细胞迁移能力。将ID8细胞接种于6孔板中,5×105个/孔,培养至铺满,预冷PBS液冲洗1次,于6孔板细胞上划痕,预冷PBS液清洗2次,对照组、PEDF组和PEDF+DDP组分别加入1 ml PBS、1 ml PEDF(50 μg)、0.5 ml PEDF(50 μg)+0.5 ml DDP(20 μg),并且每组各加入含10%胎牛血清的1640培育基1 ml,余为对照组,均设2个复孔。分别于0,24 h显微镜下观察并照相,测量记录划痕间距离,实验重复5次,取均值。
1.6 Transwell小室实验检测各组细胞侵袭能力
收集取生长状态良好的对数生长期细胞,将细胞分为对照组、PEDF组和PEDF+DDP组,三组细胞分别加入100 μl PBS、100 μl PEDF(50 μg/ml)、50 μl PEDF(100 μg/ml)+50 μl DDP(20 μg/ml)培养48 h,无血清RPMI-1640培养液重悬细胞,小室置于24孔板,上室加无血清细胞悬液2×105/100 μl,分为3组,各组上室中分别加入100 μl PBS、100 μl PEDF(50 μg/ml)、50 μl PEDF(100 μg/ml)+50 μl DDP(20 μg/ml),下室加1640培养液(含10%FBS)500 μl,37 ℃、50 ml/L CO2饱和湿度培养箱中培养24 h,取出小室,PBS冲洗,用无菌棉签拭去上层的细胞。40 ml/L甲醛固定30 min,结晶紫染色5 min,在显微镜下计数穿透细胞数,选10个视野计算均值,各组重复3次。
1.7 小鼠卵巢癌皮下瘤模型的建立
将浓度为1×106个/ml的ID8细胞于小鼠背部皮下注射皮丘,剂量为0.5 ml。每3 d测量一次肿瘤体积来观察肿瘤大小,计算公式为:肿瘤体积=肿瘤宽度2×肿瘤的长度×0.52。当小鼠肿瘤体积大约为150 mm3时,用于后续实验过程。
3.网络多媒体+古诗词:通过适当运用多媒体,增加古诗词教学的新路径。利用网络免费优质资源,编写校本诗词教材,通过班级QQ群、微信群等网络平台,推送古诗词欣赏,专家专题讲座等内容,提高农村学生语言文字的接触量,引导学生扩大阅读。
1.8 小鼠分组及治疗
将24只C57BL/6小鼠随机分成3组:模型组、PEDF组和PEDF+DDP组,每组各8只。模型组给予100 μl PBS,PEDF组给予静脉注射12.5 mg/kg PEDF蛋白,PEDF+DDP组给予静脉注射12.5 mg/kg PEDF蛋白和腹腔注射2 mg/kg顺铂注射液。隔日给药,共给药3次。第20天将小鼠处死,剥离肿瘤,进行下一步实验。肿瘤剥离后放入10%甲醛溶液中固定,进行病理组织学观察。
1.9 免疫组化染色检测肿瘤组织CD31表达
肿瘤标本石蜡切片置于3%过氧化氢溶液中,封闭内源性过氧化物酶;PBS缓冲液冲洗,5 min×3次;滴加一抗(CD31蛋白单克隆抗体工作液);置于孵育盒中,恒温恒湿孵育2 h;PBS缓冲液冲洗,5 min×3次;滴加试剂I(聚合物增强剂);置于孵育盒中,恒温恒湿孵育20 min;加试剂II(辣根酶标记山羊抗兔/小鼠IgG多聚体);置于孵育盒中,恒温恒湿孵育30 min;PBS缓冲液冲洗,5 min×3次;将DAB液混匀后滴加至切片,盖住标本。室温显色,在显微镜下观察,苏木精复染1 min;0.1%HCl分化;PBS冲洗;95%乙醇10 min;95%乙醇2 min;无水乙醇10 min;无水乙醇Ⅱ 2 min;二甲苯Ⅰ 10 min;二甲苯Ⅱ 10 min;中性树胶封固;显微镜下观察染色情况并采集照片。
1.10 TUNEL染色观察肿瘤组织细胞凋亡情况
准备好肿瘤标本石蜡切片,脱蜡至水,按照TUNEL原位细胞凋亡检测试剂盒标准步骤进行TUNEL染色,PBS洗涤3次,使用抗荧光淬灭封片液封片后,在荧光显微镜下观察。在5个随机区域内随机选择的视野中的凋亡细胞数量进行定量。避免坏死区干扰,统计凋亡率。
1.11 统计学方法
数值以平均数±标准差表示,采用SPSS24.0统计软件(IBM,Corp.)进行统计分析。采用采用单因素方差分析及Tukey事后检验比较各组间的差异。P<0.05被认为差异具有统计学意义。
2 结果
2.1 ID8细胞经过不同处理后增殖能力的比较
结果显示,PEDF组和PEDF+DDP组细胞的OD值在36 h和48 h这两个时间点明显低于对照组,差异有统计学意义(P<0.05)。与PEDF组相比,PEDF+DDP组细胞的OD值在36 h和48 h这两个时间点明显降低,差异有统计学意义(P<0.05,见图1)。
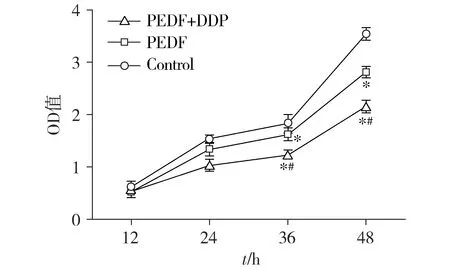
与control组相比,*P<0.05;与PEDF组相比,#P<0.05图1 经过不同处理后的ID8细胞增殖能力的比较Figure 1 Comparison of proliferation ability of ID8 cells after different treatments
2.2 ID8细胞经过不同处理后迁移能力的变化
结果显示24 h时PEDF组和PEDF+DDP组ID8的迁移能力均显著抑制(P<0.01)。与PEDF组相比,PEDF+DDP组抑制效果更加明显(P<0.01,见图2)。

与control组相比,**P<0.01;与PEDF组相比,#P<0.05图2 经过不同处理后的ID8细胞迁移率的比较Figure 2 Comparison of ID8 cell migration after different treatments
2.3 ID8细胞经过不同处理后的细胞侵袭能力的变化
我们对三组的侵袭细胞数进行分析,结果显示与对照组相比,24 h时PEDF组和PEDF+DDP组ID8的细胞侵袭能力显著降低(P<0.01)。与PEDF组相比,PEDF+DDP组的抑制效果更加明显(P<0.01,见图3)。
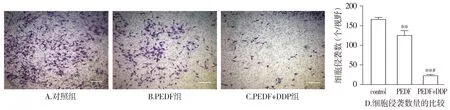
与control组相比,**P<0.01;与PEDF组相比,#P<0.05图3 经过不同处理后的ID8细胞侵袭能力的比较 (bar=100 μm)Figure 3 Comparison of invasive ability of ID8 cells after different treatments (bar=100 μm)
2.4 小鼠肿瘤体积和小鼠体质量的变化
我们通过每5 d测量1次小鼠皮下肿瘤体积来评价各组药物对肿瘤的抑制作用。结果显示,与模型组相比,PEDF组和PEDF+DDP组肿瘤生长均显著抑制(P<0.05),与PEDF组相比,PEDF+DDP组抑制效果更加明显(P<0.05)。
我们通过每5 d测量1次小鼠体质量来评价小鼠毒副反应。在实验过程中,PEDF组、PEDF+DDP组与模型组比较,荷瘤小鼠的体质量变化无明显差异(P>0.05,见图4)。同时,各组小鼠的皮毛、食欲、行为等也无特殊改变。表明PEDF组和PEDF+DDP组的给药剂量对小鼠并不产生明显的毒副作用。
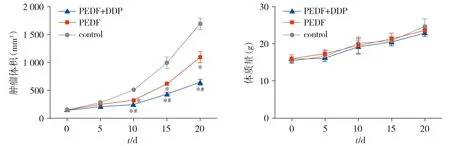
与control组相比,*P<0.05;与PEDF组相比,#P<0.05图4 经过不同治疗后荷瘤小鼠肿瘤体积和小鼠体质量的比较Figure 4 Comparison of tumor volume and body weight of tumor-bearing mice after different treatments
2.5 肿瘤组织CD31表达的比较
我们对肿瘤标本体外进行病理切片后,进行CD31免疫组织化学染色检测,CD31表达于细胞膜表面,为内皮细胞的特异性抗原。显微镜下观察结果显示,模型组CD31表达强阳性,PEDF组和PEDF+DDP组均表现为弱阳性或者阴性表达(P<0.05)。与PEDF组相比,PEDF+DDP组的CD31阳性率表达更低(P<0.01,见图5)。
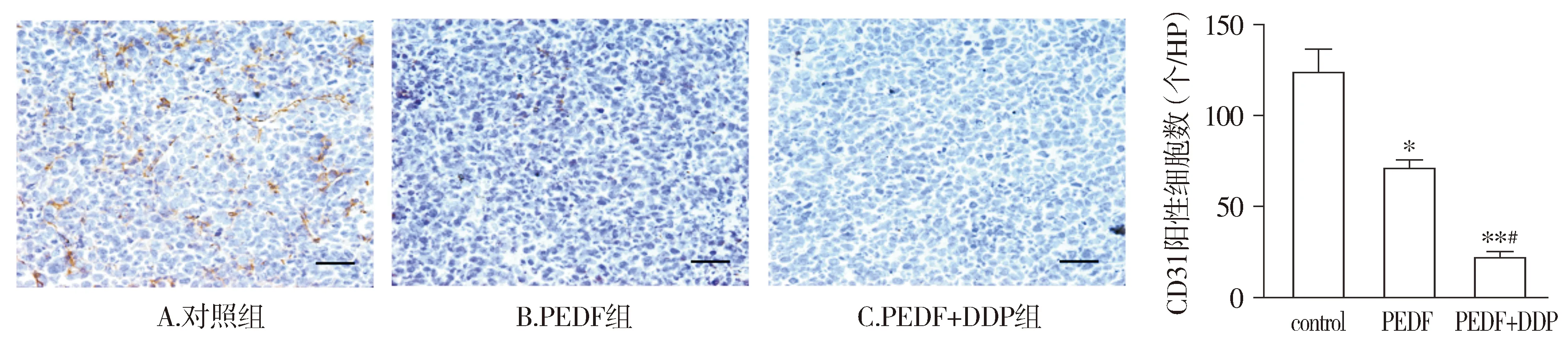
与control组相比,*P<0.05,**P<0.01;与PEDF组相比,#P<0.05图5 经过不同治疗后肿瘤组织CD31表达的比较 (bar=100 μm)Figure 5 Comparison of CD31 expression in tumor tissues after different treatments (bar=100 μm)
2.6 肿瘤组织中细胞凋亡的比较
在荧光显微镜下对三组病理切片进行观察可以发现:PEDF组和PEDF+DDP组绿色荧光着色的细胞明显多于模型组,凋亡细胞的数量与模型组比较明显增加。PEDF+DDP组细胞凋亡率明显高于模型组和PEDF组(P<0.01或P<0.05,见图6)。
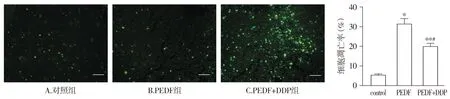
与control组相比,**P<0.01;与PEDF组相比,#P<0.05图6 经过不同治疗后肿瘤组织中细胞凋亡的比较 (bar=100 μm)Figure 6 Comparison of apoptosis in tumor tissues after different treatments (bar=100 μm)
3 讨论
卵巢肿瘤的病死率居妇科恶性肿瘤首位,手术联合化疗使晚期卵巢癌患者的近期生存率有了明显提高,但治疗后患者5年生存率仍为25%-30%[6]。多数卵巢癌患者在治疗初始阶段对化疗较敏感,但是随着疗程的延续逐渐出现获得性耐药,所以以铂类为基础的化疗具有一定的弊端。
PEDF是一个多功能蛋白质,近年来其抗血管生成作用和抗肿瘤作用越来越受到关注。外源性PEDF在肺癌治疗作用的研究已取得初步进展,腺病毒载体介导的PEDF基因对小鼠Lewis肺癌的生长具有抑制作用[7]。PEDF不仅能够抑制肿瘤血管的生成,而且还能直接促进肿瘤细胞的凋亡发挥抗肿瘤作用[8]。PEDF是一种50 kD的分泌型糖蛋白,属于丝氨酸蛋白酶抑制剂的丝氨酸蛋白酶超家族,调节与凝血、炎症、血管生成、蛋白质折叠和运输等关键生物学过程相关的蛋白水解级联反应[9]。PEDF是一种多功能分子,已知具有心脏保护、分化、神经营养、抗血管生成、抗凋亡和抗肿瘤作用[10],有研究表明,PEDF作为最强的内源性血管生成抑制因子,可以通过增加肿瘤细胞分化、抑制新生血管和抑制癌细胞侵袭和转移来阻止癌症进展[11]。本实验通过使用PEDF蛋白和DDP联合作用于ID8细胞株以及小鼠卵巢癌模型,观察两种药物协同治疗所取得的效果。
本研究中体外研究显示,PEDF和PEDF+DDP均能显著抑制ID8的迁移、增殖和侵袭能力,PEDF+DDP抑制效果更加明显。随后,我们建立了卵巢癌小鼠模型,通过观察小鼠肿瘤体积和小鼠体质量的变化评价肿瘤的治疗效果和小鼠毒副反应,结果提示荷瘤小鼠的体质量变化无明显差异,表明药物的剂量在安全范围之内。但PEDF组和PEDF+DDP组肿瘤体积较对照组明显减少,并且PEDF+DDP组的治疗效果更佳。为了进一步了解治疗效果的机制,我们对肿瘤进行了病理组织学检测,CD31免疫组织化学染色提示,PEDF组和PEDF+DDP组CD31均表现为弱阳性或者阴性表达,表明药物的处理明显抑制了CD31表达。CD31又称为血小板-内皮细胞黏附分子,分子量为130 kD,其结构属于免疫球蛋白超家族成员,常表达于内皮细胞间,参与白细胞的迁移、血管生成和整合素的激活。我们在实验中发现PEDF和PEDF+DDP均有效抑制了CD31表达。TENEL凋亡实验也显示了PEDF和PEDF+DDP促进了肿瘤细胞的凋亡,并且PEDF+DDP组的凋亡率更高。
综上所述,本研究证实了PEDF和DDP的联合对卵巢癌起到了协同治疗作用。不但能够直接抑制卵巢癌细胞的生长,还可以通过抑制血管内皮细胞的增殖从而抑制新生血管的生成,间接抑制卵巢癌的生长,并促进肿瘤细胞的凋亡。这与PEDF破坏瘤体内的血管网络以及DDP导致细胞DNA损伤并诱导线粒体凋亡有关。但本实验还有一些不足,并未在分子蛋白层面探讨两种药物协同治疗的分子机制,并未在逆转顺铂的耐药性方面继续深入探讨,这也是本课题组下一步的研究方向。
