上调lncRNA OIP5-AS1通过靶向miR-181d-5p减少脂多糖诱导的心肌细胞损伤
2021-06-18陈健佳张小梅马文斌黄玉梅
陈健佳,张小梅,马文斌,黄玉梅,赵 强
(广州医科大学附属顺德医院心内科,佛山 528315;*通讯作者,E-mail:326400975@qq.com)
心肌炎是一种会导致心脏功能障碍的心肌炎症性疾病,病因包括免疫损伤、感染等,可显著影响心脏的收缩和舒张功能,导致心律失常[1]。心肌炎的诊断主要依赖于免疫学、免疫组织化学及组织病理学[2]。心肌炎的具体发病机制目前并不明确,探究心肌炎的分子靶向治疗具有重要意义。长链非编码RNA(long non-coding RNA,lncRNA)是一类超过200个核苷酸组成的内源性小分子RNA,属于单链非编码RNA[3]。lncRNA参与调控血管生成、细胞分化、细胞增殖、细胞凋亡等各种细胞功能[4,5]。lncRNA广泛参与各种心脏疾病的发生、发展过程[6]。研究表明,OIP5-AS1是一种lncRNA,其可通过抑制线粒体介导的细胞凋亡,降低急性心肌梗死后的心肌缺血再灌注损伤[7]。OIP5-AS1对细菌性心肌炎时心肌细胞损伤的研究尚未见报道。本研究旨在观察OIP5-AS1对脂多糖诱导细菌性心肌炎时对大鼠原代心肌细胞的作用及可能的作用机制。
1 材料和方法
1.1 细胞与试剂
用于分离原代心肌细胞的3 d新生SD大鼠购于武汉万千佳兴生物科技有限公司。载有OIP5-AS1序列的GFP慢病毒、空载GFP慢病毒、miR-NC、miR-181d-5p、OIP5-AS1野生型及突变型荧光报告载体购于广州锐博生物技术有限公司。工具293细胞、ELISA试剂盒和CCK-8试剂盒购于上海碧云天生物科技有限公司。胎牛血清、DMEM培养基购于美国Hyclone公司。Annexin Ⅴ-FITC细胞凋亡检测试剂盒购于美国BD公司。双荧光素酶报告基因检测试剂盒购于上海翊圣生物科技有限公司。转染试剂LipofectamineTM3000购于美国Invitrogen公司。胶原酶Ⅰ购于美国Sigma公司。实时定量聚合酶链反应(qRT-PCR)试剂盒购于日本Takara公司。一抗和二抗购于美国Cell Signaling Technology公司。
1.2 细胞分离、培养和分组
采用胶原酶Ⅰ将3 d新生SD大鼠的心脏组织解离为单细胞悬液,加入含20%胎牛血清的DMEM培养基中,在37 ℃、5% CO2条件下培养。将大鼠原代心肌细胞分为两组:分别感染空载GFP慢病毒和载有OIP5-AS1序列的GFP慢病毒,感染复数(MOI)均为20,命名为对照组和实验组。12 h后荧光显微镜下观察细胞状态。每组细胞分别滴加100 μl浓度为10 μmol/L脂多糖,24 h进行后续实验。
1.3 qRT-PCR检测OIP5-AS1和miR-181d-5p的表达
TRIzol法提取细胞总RNA,逆转录为cDNA进行qRT-PCR检测。反应参数:96 ℃预变惈3 min,96 ℃变性20 s,60 ℃退火20 s,72 ℃延伸20 s,35个循环。OIP5-AS1的表达以β-actin为内参,miR-181d-5p的表达以U6为内参。引物序列如下:miR-181d-5p正向引物为AACAUUCAUUGUUGUC,反向引物为CGACGTGTAGTGTTTCCTA;U6正向引物位CTCGCTTCGGCAGCACA,反向引物为ACGCTTCACGAATTTGCGT。β-actin正向引物为TGTCACCAACTGGGACGATA,反向引物位GGGGTGTTGAAGGTCTCAAA;OIP5-AS1正向引物为GTGTTGTGGAGATTGAGGCAGGAG,反向引物为GGCAAGGTGAAGGACAGACAGC。以2-ΔΔCt法计算OIP5-AS1和miR-181d-5p的相对表达。
1.4 ELISA法检测肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)含量
大鼠原代心肌细胞经脂多糖处理24 h后,收集各组细胞的上清,根据ELISA试剂盒说明书进行操作,在酶标仪450 nm波长处检测每孔吸光度(A)值,比较每组细胞上清液中TNF-α和IL-1β的含量。
1.5 CCK-8法检测细胞活力
将经脂多糖处理后的大鼠原代心肌细胞以每孔1×103个细胞接种于96孔板,设置4个复孔。24 h后,每孔加入20 μl CCK-8试剂,继续培养4 h,在酶标仪450 nm波长处检测每孔吸光度(A)值,比较各孔的细胞活力。
1.6 流式细胞术检测细胞凋亡率
胰酶消化经脂多糖处理后的大鼠原代心肌细胞,采用预冷的PBS溶液洗2次,采用缓冲液重悬,分别取100 μl细胞悬液加入流式管,分别加入5 μl Annexin Ⅴ-FITC试剂和5 μl PI试剂,混匀后避光孵育25 min。加入100 μl缓冲液,流式细胞仪检测细胞凋亡率。
1.7 生物信息学方法预测和双荧光素酶报告基因实验验证OIP5-AS1的靶基因
采用生物信息学软件Starbase预测OIP5-AS1的潜在靶向基因。采用LipofectamineTM3000转染试剂,将OIP5-AS1野生型和突变型荧光报告载体分别和miR-NC或miR-181d-5p共转染工具293细胞,24 h后根据双荧光素酶报告基因检测试剂盒说明书进行操作,检测每组细胞的相对荧光素酶活性。
1.8 Western blot法检测凋亡相关蛋白Bcl-2、Bax、Caspase-3的表达
对照组和实验组细胞分别滴加100 μl浓度为10 μmol/L脂多糖诱导心肌细胞损伤,24 h后采用预冷的PBS溶液洗2次,采用细胞裂解液提取总蛋白。蛋白变性后,采用十二烷基聚丙烯酰胺凝胶电泳分离蛋白,转至硝酸纤维素膜,采用5%脱脂牛奶进行封闭,在4 ℃冰箱内采用一抗Bcl-2(稀释度1 ∶2 000)、Bax(稀释度1 ∶1 000)、Caspase-3(稀释度1 ∶1 000)孵育过夜,在室温下采用二抗孵育2 h。均匀滴加增强型化学发光试剂,在凝胶成像系统中曝光、拍照。
1.9 统计学方法

2 结果
2.1 两组细胞中OIP5-AS1的相对表达
对照组和实验组细胞均显著表达绿色荧光蛋白(见图1),提示细胞感染成功。对照组和实验组细胞中OIP5-AS1相对表达分别为1.01±0.07和9.22±1.06,实验组OIP5-AS1相对表达明显高于对照组(P<0.01,见图2)。
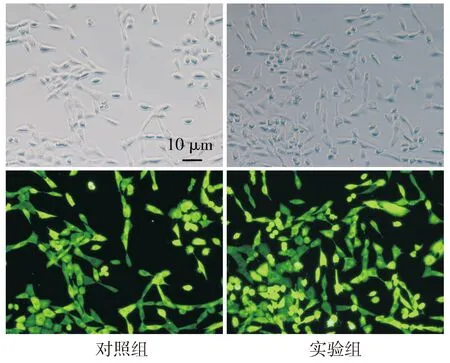
图1 对照组和实验组细胞绿色荧光蛋白表达Figure 1 The expression of green fluorescent protein in control group and experimental group

与对照组比较,**P<0.01图2 对照组和实验组细胞中OIP5-AS1的相对表达Figure 2 The relative expression of OIP5-AS1 in control group and experimental group
2.2 高表达OIP5-AS1对TNF-α和IL-1β含量的影响
ELISA法结果显示,脂多糖处理后对照组和实验组培养基中TNF-α含量分别为(39.45±2.15)pg/ml和(30.26±1.85)pg/ml,两组间比较差异有统计学意义(P<0.05);对照组和实验组培养基中IL-1β含量分别为(22.49±1.50)pg/ml和(12.34±1.77)pg/ml,两组间比较差异有统计学意义(P<0.01)。与对照组相比,实验组培养基中TNF-α和IL-1β含量均明显降低。
2.3 高表达OIP5-AS1对细胞活力的影响
CCK-8法结果显示,脂多糖处理后的对照组和实验组细胞活力分别为1.00±0.02和5.89±0.61,与对照组相比,实验组细胞的活力明显较高(P<0.01)。
2.4 高表达OIP5-AS1对细胞凋亡率的影响
流式细胞术显示,脂多糖处理24 h后,实验组和对照组细胞凋亡率分别为(22.70±1.88)%和(48.64±2.37)%;与对照组比较,实验组高表达OIP5-AS1明显抑制细胞的凋亡,差异具有统计学意义(P<0.01,见图3)。

与对照组比较,**P<0.01图3 流式细胞术检测OIP5-AS1对细胞凋亡率的影响Figure 3 The effect of OIP5-AS1 on cell apoptosis rate was detected by flow cytometry
2.5 生物信息学方法预测OIP5-AS1的靶基因
采用生物信息学软件Starbase预测OIP5-AS1可靶向结合miR-181d-5p(见图4)。

图4 生物信息学方法预测OIP5-AS1的靶基因Figure 4 Bioinformatics methods predicted the target gene of OIP5-AS1
2.6 OIP5-AS1与miR-181d-5p的靶向关系
双荧光素酶报告基因检测结果显示,野生型miR-NC组、野生型miR-181d-5p组、突变型miR-NC组和突变型miR-181d-5p组的相对荧光素酶活性分别为1.02±0.08、0.30±0.04、1.08±0.15和1.01±0.06,野生型miR-181d-5p组较野生型miR-NC组明显降低(P<0.01,见图5),证实OIP5-AS1与miR-181d-5p之间可靶向结合。

与野生型miR-NC组比较,**P<0.01图5 双荧光素酶报告基因实验验证OIP5-AS1与miR-181d-5p的靶向关系Figure 5 The dual luciferase reporter gene experiment verified the targeting relationship between OIP5-AS1 and miR-181d-5p
2.7 高表达OIP5-AS1对细胞中miR-181d-5p表达的影响
qRT-PCR结果显示,实验组和对照组细胞miR-181d-5p的表达分别为0.19±0.06和1.01±0.06,高表达OIP5-AS1可抑制miR-181d-5p的表达(P<0.01)。
2.8 高表达OIP5-AS1对凋亡相关蛋白表达的影响
Western blot结果显示,与对照组相比,脂多糖处理的高表达OIP5-AS1的细胞中,抗凋亡蛋白Bcl-2表达增加,促凋亡蛋白Bax、Caspase-3表达下降(见图6)。

图6 Western blot法检测高表达OIP5-AS1后凋亡相关蛋白的表达Figure 6 Expression of apoptosis-related proteins after OIP5-AS1 overexpression by Western blot
3 讨论
近年的研究表明,lncRNA在各种心血管事件的发生、发展过程中具有重要调控作用[8,9]。心肌炎导致炎性渗出,心肌细胞耗氧量增加,心肌细胞更易凋亡,导致恶性临床事件[10]。lncRNA介导的心肌细胞损伤被广泛的研究。Zhang等[11]研究发现,lncRNA ROR通过调节C-Myc蛋白的表达,促进病毒性心肌炎大鼠心肌的纤维化。Cao等[12]研究发现,在柯萨奇病毒B3诱导的心肌炎中,lncRNA HIF1A-AS1的表达明显增加,沉默lncRNA HIF1A-AS1可抑制心肌细胞的凋亡,miR-138是lncRNA HIF1A-AS1的靶基因。Niu等[7]研究发现,OIP5-AS1在心脏缺血再灌注心肌细胞中的表达下调,过表达OIP5-AS1可减轻活性氧引起的线粒体损伤,降低心肌细胞的凋亡。OIP5-AS1对细菌性心肌炎时心肌细胞的影响及作用机制尚不明确。
本研究显示,OIP5-AS1可增加细菌性心肌炎心肌细胞的活力,上调OIP5-AS1可抑制TNF-α和IL-1β炎症因子的渗出,降低心肌细胞的凋亡率,减轻心肌细胞的损伤。越来越多的研究表明,lncRNA主要通过“海绵作用”结合微小RNA(miRNA),降低miRNA的表达,进而抑制miRNA的功能[13-15]。本研究采用生物信息学软件Starbase预测,OIP5-AS1的靶基因可能是miR-181d-5p。双荧光素素酶报告基因检测显示,OIP5-AS1可配对结合miR-181d-5p。研究表明,miR-181d-5p在急性病毒性心肌病患者血清外泌体中的表达显著增加,miR-181d-5p可增强心肌的炎症反应,促进心肌细胞的凋亡和不可逆损伤[16]。本研究显示,OIP5-AS1表达增加后,脂多糖处理的心肌细胞中miR-181d-5p的表达降低,OIP5-AS1可明显抑制miR-181d-5p的表达。本研究通过Western blot检测显示,高表达OIP5-AS1的心肌细胞中Bcl-2蛋白表达增加,Bax、Caspase-3蛋白表达减少,提示OIP5-AS1抑制miR-181d-5p表达后心肌细胞凋亡明显减少。
综上所述,OIP5-AS1可有效增强脂多糖处理的心肌细胞的活力并抑制其凋亡,OIP5-AS1主要通过抑制miR-181d-5p表达发挥作用。本研究首次揭示OIP5-AS1可能有利于改善细菌性心肌炎心肌细胞的功能,为细菌性心肌炎的分子靶向治疗提供了新的方向。
