ALYREF在肝癌中的表达及生物学意义
2021-06-18陈嘉乐
陈嘉乐,张 可,杜 楠,邓 敏
(广州医科大学附属肿瘤医院肿瘤研究所,广州 510095;*通讯作者,E-mail:dengmin510095@163.com)
肝癌是常见的恶性肿瘤之一,是全球第五大常见癌症[1]。肝细胞癌约占全部肝癌的85%-95%[2]。肝细胞癌发病隐匿,恶性程度高,进展迅速,早期较难发现,很多患者在被诊断有肝细胞癌时都已经到达中晚期,预后非常差[3]。且预后在很大程度上受肿瘤分期的影响[4]。因此,找到新的预测肝癌及其预后的生物标志物至关重要。
ALYREF是一个重要的RNA结合蛋白,是mRNA输出的关键因子之一TREX复合物(TREX)的组成部分之一,TREX复合物包括THO亚复合物、RNA解旋酶UAP56和RNA结合蛋白ALYREF[5]。有研究[6]表明ALYREF的表达在多种肿瘤中都有改变,但具体研究癌症与其关系的报道尚少,尤其是与肝癌的发生发展的关系尚未见有报道。本研究通过观察ALYREF表达水平与肝癌患者临床预后之间的相关性,及敲低ALYREF表达对肝癌细胞的影响,探讨其生物学意义。
1 材料与方法
1.1 细胞株、组织标本和主要试剂
人肝癌细胞株MHCC97H来源于广州医科大学附属肿瘤医院肿瘤研究所细胞库。肝癌与癌旁组织蜡块取自广州医科大学附属肿瘤医院病理科,其中肝癌组织90例,癌旁组织20例,病理及资料完善。胰酶、DMEM、血清购自Gibco公司。免疫组化试剂盒购自迈新生物技术开发有限公司。CCK-8试剂盒购自日本同仁公司。转染试剂Lipofectamine3000购于美国Thermo Fisher Scientific公司。ALYREF抗体购于美国Abcam公司。本研究通过广州医科大学附属肿瘤医院伦理委员会批准。
1.2 生物信息学分析
利用在线分析网站UALCAN分析TCGA数据库中371例肝癌组和50例正常对照组ALYREF基因的表达水平与预后信息。同时从CPTAC公开数据库中下载肝癌数据集,共159例肝癌患者数据及其配对的癌旁数据。利用此数据集,分析ALYREF在在肝癌患者中蛋白表达和mRNA水平的情况。
1.3 免疫组化检测ALYREF在正常肝与肝癌组织中的表达情况
组织蜡块切片、制片后,取需要的切片放进60 ℃恒温箱中烤片3 h,环保透明剂脱蜡,梯度乙醇脱水后,用高压锅煮沸枸橼酸盐溶液进行抗原修复10 min,然后室温自然冷却。冷却后使用即用型免疫组化UltraSensitiveTMSP试剂盒,按说明书进行操作后孵育一抗(ALYREF),放入湿盒中4 ℃过夜。次日室温复温30 min,PBS洗3次后,滴加生物素标记的第二抗体,室温孵育10 min,PBS冲洗3次,滴加链霉菌抗生物素-过氧化物酶溶液,室温孵育10 min。PBS冲洗3次。然后进行DAB显色,苏木素复染,自来水冲洗返蓝,1%盐酸酒精分化后梯度酒精脱水干燥,中性树胶封固。观察ALYREF基因表达分布及相对表达量。阳性细胞分数评定:≤25%,1分;26%-50%,2分;51%-75%,3分;>75%,4分。染色强度评定:无着色,0分;弱性,1分;中等阳性,2分;强阳性,3分。总得分为两项分数之积,总得分>3分为阳性表达。
1.4 细胞转染和细胞培养
取对数生长期MHCC97H细胞接种于6孔细胞培养板中,第2天细胞密度到达70%-90%时用Lipofectamine3000试剂盒进行转染。分别将5 μg shALYREF质粒和5 μg shControl质粒转染入MHCC97H细胞中,以敲低细胞中ALYREF的表达。转染24-72 h后,收集细胞进行Western blot免疫印迹实验以验证基因的敲低效果。MHCC97H肝癌细胞转染后分为shALYREF组和shControl组,培养于含有10%胎牛血清的高糖DMEM培养基中,放置于37 ℃,5% CO2湿度饱和的培养箱中培养。
1.5 Western blot检测ALYREF蛋白的表达水平
分别收集shALYREF组和shControl组细胞,用RIPA法裂解后,提取总蛋白,用PierceTMBCA Protein Assay Kit试剂盒测定蛋白质浓度。取30 μg蛋白进行SDS-PAGE凝胶电泳。湿转转膜后用5%脱脂牛奶封闭1 h。分别孵育ALYREF单克隆抗体(1 ∶1 000)和β-actin抗体(1 ∶5 000),4 ℃过夜。第2天TBST洗膜3次,每次10 min。孵育特异性二抗2 h后,TBST洗膜3次,每次10 min,之后用ECL化学发光试剂对X线片显影,扫描仪扫描胶片。
1.6 Transwell实验检测细胞迁移能力
使用不带基质胶的Transwell小室,用胰酶消化shALYREF细胞和shControl细胞,终止消化后1 000 r/min离心5 min,弃培养基,用无FBS的DMEM培养基重悬细胞,进行细胞计数。取5×104个细胞放入Transwell小室,加无血清DMEM补至200 μl。Transwell下室加入10% FBS的DMEM培养基600 μl,置于37 ℃,5%CO2的培养箱中培养48 h后,弃上室液体,用甲醇固定30 min,用棉签擦去上室细胞,加入1%结晶紫染色15 min,流水洗涤干净。晾干后拍照,并随机选取5个视野进行计数。
1.7 CCK-8实验检测敲低ALYREF后对MHCC97H细胞的增殖能力的影响
取shALYREF细胞和shControl细胞,消化后计数,在96孔板中配制100 μl的细胞悬液,每孔细胞数2×103个,设置5个复孔。将培养板放在37 ℃,5% CO2的培养箱预培养24 h。向每孔加入10 μl CCK-8溶液。将培养板在培养箱内孵育1-4 h。用酶标仪测定在450 nm处的吸光度(OD值)。每天同一时间测定,连续测定5 d。所得OD值作均一化处理后描绘增殖曲线。
1.8 统计学分析
采用软件GraphPad Prism 7.0和SPSS16进行统计学分析,两组间比较用t检验,多组间比较使用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 ALYREF在肝癌组织中高表达且与预后相关
在线分析网站UALCAN分析结果显示,ALYREF在肝癌组的表达水平高于正常对照组(P<0.05,见图1A)。且ALYREF的表达水平与肝癌患者组织肿瘤分期相关(P<0.005),临床分期越高,ALYREF表达越高(见图1B)。再利用GEPIA网站的分析,数据表明ALYREF高表达患者的OS(总生存)比低表达患者短(P=0.001 5,见图1C)。

图1 在线网站分析ALYREF在肝癌中的表达及生存分析Figure 1 Expression and survival analysis of ALYREF in hepatocellular carcinoma patients by online website analysis
2.2 ALYREF在肝癌中的蛋白表达和mRNA水平
利用CPTAC公开数据库中的肝癌数据集分析ALYREF在肝癌患者中蛋白表达和mRNA水平的情况。结果显示肝癌患者癌组织中ALYREF蛋白相对表达量及mRNA水平均高于癌旁组织,差异具有统计学意义(P<0.001,见图2)。

与癌旁组织比较,***P<0.001图2 公开数据分析得ALYREF在肝癌中蛋白质和mRNA水平的表达情况Figure 2 Protein and mRNA expression of ALYREF in hepatocellular carcinoma based on open data
2.3 免疫组化验证ALYREF在肝癌组织及癌旁组织的表达
肝癌组织中ALYREF蛋白阳性表达呈棕黄色或棕褐色,主要位于细胞核中,部分胞浆也可见表达(见图3)。在肝癌组织中阳性表达率67.8%(61/90),而在癌旁组织中阳性表达率35.0%(7/20),差异具有统计学意义(χ2=7.448,P<0.005)。
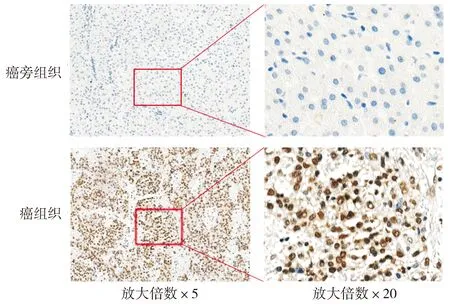
图3 ALYREF在肝癌组织中的表达Figure 3 Expression of ALYREF in hepatocellular carcinoma
2.4 转染敲低质粒shALYREF后MHCC97H细胞中ALYREF的蛋白表达
Western blot检测结果显示,转染后,MHCC97H细胞中ALYREF的表达量明显降低(见图4)。
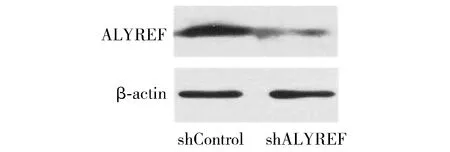
图4 Western blot检测MHCC97H细胞ALYREF表达的敲低效果Figure 4 ALYREF expression in MHCC97H cells after transfected wtih shALYREF by Western blot
2.5 敲低ALYREF对肝癌细胞MHCC97H迁移能力的影响
Transwell实验结果显示,敲低了ALYREF的MHCC97H细胞迁移细胞数比对照组显著减少,细胞迁移能力显著下降,差异有统计学意义(P=0.000 3,见图5)。
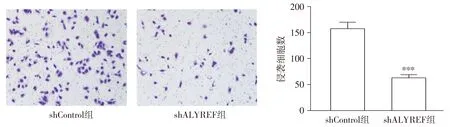
与shControl组比较,***P<0.001图5 敲低ALYREF对MHCC97H细胞迁移的影响Figure 5 Effect of knocking down ALYREF on migration of MHCC97H cells
2.6 敲低ALYREF对肝癌细胞MHCC97H增殖能力的影响
CCK-8实验结果表明,敲低ALYREF后MHCC97H细胞的增殖能力比对照组降低,差异有统计学意义(P<0.0001,见图6)。

与shControl组比较,***P<0.001,****P<0.0001图6 敲低ALYREF对MHCC97H细胞增殖能力的影响Figure 6 Effect of knocking down ALYREF on the proliferation of MHCC97H cells
3 讨论
近年来,肝癌的发病率增长迅速[7,8],尤其是在中国,肝癌的发病率和死亡率一直居高不下。严重威胁着我国人民的生命健康,目前,肝癌是我国第4位常见恶性肿瘤及第2位肿瘤致死病因[9]。肝癌细胞具有很强的增殖能力,肝癌病情发展迅速,预后较差,抑制肝癌细胞增殖能力能够有效提高肝癌的治疗效果[10]。一直以来,原发性肝癌的治疗方法包括了肝切除术、肝移植术、局部消融治疗、TACE、放射治疗、全身治疗等多种手段。而手术是主要的治疗手段,但是大部分病人确诊时已达中晚期,能获得手术切除机会的病人仅20%-30%[11]。因此,早期诊断以及提前预测肝癌患者预后非常重要,而ALYREF这个基因与肝癌患者的生存预后有着密切相关性。
ALYREF作为一个RNA结合蛋白,在5′RNA加帽、RNA POL Ⅱ(RNA聚合酶Ⅱ)延伸、转录剪接和mRNA输出中起着不同的作用[12,13]。除了作为TREX复合物的组成部分之一,目前ALYREF还被发现与m5C甲基化密切相关,它是m5C的阅读蛋白,目前只有两个m5C阅读器蛋白被报道:一个是ALYREF,是一个mRNA核质输出因子[14];另一个是YBX1,调节mRNA稳定性[15,16]。m5C甲基化修饰是主要的RNA转录后修饰之一,是一个动态可逆过程,受到RNA甲基化酶和去甲基化酶调控,而且甲基化修饰后需要RNA甲基化结合蛋白的参与才能发挥生物学作用[17]。mRNA甲基化修饰可调控肿瘤的发生,这种转录后修饰在肿瘤疾病中发挥着重要作用[15]。mRNAs中m5C的形成主要由RNA甲基转移酶NSUN2催化和由mRNA输出接头ALYREF特异性识别。ALYREF核质穿梭依赖于NSUN2的催化活性。mRNA输出接头ALYREF是一种特异性的m5C结合蛋白,促进mRNA输出方面发挥了重要作用[14]。选择性mRNA输出可以调节癌症发展中某些重要的生物学过程,如细胞的增殖和基因组的完整性,而且一些癌症癌可能会增加mRNA的输出,从而改变蛋白质的输出[18]。ALYREF参与的甲基化过程和mRNA输出过程都对肿瘤有重要影响。
目前,ALYREF与肿瘤相关的报道尚不多。有研究发现在乳腺癌细胞中敲低ALYREF可抑制其增殖能力[19],在口腔鳞癌中,ALYREF过表达可能与区域淋巴结转移有关[20]。在其他疾病中,ALYREF与肌萎缩侧索硬化症(ALS)和额颞叶痴呆(FTD)相关,它在ALS运动神经元中增加,其下调可能抑制多种ALS和FTD相关基因的毒性[21]。作为m5C阅读器蛋白ALYREF在调节小鼠白血病病毒(MLV)复制方面发挥着重要作用[22]。
ALYREF与肝癌的相关研究未见报道,本研究通过UALCAN在线网站分析ALYREF在肝癌组织与正常对照组织表达水平的差异以及ALYREF表达水平与临床预后的相关性,结果显示ALYREF在肝癌组织中高表达,且肿瘤分期越高,ALYREF表达水平越高。通过GEPIA分析显示ALYREF高表达肝癌患者的OS下降。用临床病理标本进行免疫组化验证上述结果,分析证实ALYREF在肝癌组织中高表达。另外使用shRNA技术敲低MHCCH97H细胞株中ALYREF的表达,通过Transwell与CCK-8实验发现肝癌细胞的ALYREF表达下调后,其迁移和增殖能力均降低。这些实验结果提示ALYREF对于肝癌可能是一种促癌基因及预测其预后的新的生物标志物。
综上,ALYREF在肝癌组织和细胞中表达上调,敲低ALYREF的表达可抑制肝癌细胞的迁移和增殖能力。但是关于该基因在肝癌中的机制尚未清楚,所以有必要对该基因进行多层面研究,更全面掌握ALYREF在肿瘤中的作用,为肝癌的预防诊治提供更多依据。
