乳腺癌4T1细胞中过表达鼠白介素-10对宿主抗肿瘤免疫应答的影响
2021-06-18王晓倩李丹丹王孟影贺龙梅王晓琴马运峰
王晓倩,李丹丹,王 丹,王孟影,贺龙梅,3,王晓琴,马运峰,4*
(1西安交通大学第一附属医院检验科,西安 710061;2西安交通大学基础医学院病原生物学与免疫学系;3陕西省中医医院检验科;4西安交通大学转化医学研究院感染免疫研究所;*通讯作者,E-mail:mayunfeng@xjtu.edu.cn)
乳腺癌是最常见的癌症之一,也是全世界范围内女性癌症相关死亡的首要原因[1]。虽然传统的治疗方法(手术治疗、化疗、放疗等)有了很大的改进,但是几乎所有转移性乳腺癌患者都会死亡,特别是三阴性乳腺癌,靶向治疗效果微乎其微,因此寻找一种新的治疗方法至关重要。普遍认为IL-10是一种免疫抑制因子,能够下调主要组织相容性复合体Ⅱ类抗原(MHCⅡ)、CD80/CD86等表达以及抑制干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、白介素-2(IL-2)等细胞因子的分泌,从而抑制抗肿瘤免疫应答。但也有越来越多的证据证明,大剂量IL-10能够促进抗肿瘤免疫,在黑色素瘤[2]、结肠癌[3]中已经得到证实,但是在乳腺癌中的相关作用并不清楚。因此,本文从细胞水平以及动物水平研究过表达mIL-10对小鼠乳腺癌4T1细胞以及荷瘤生长的影响,并探讨其作用机制,为临床乳腺癌治疗提供新的思路。
1 材料与方法
1.1 动物与细胞系
SPF级BALB/c 6-8周雌性小鼠购买于西安交通大学医学部动物实验中心,并且在该动物实验中心SPF级实验室饲养。小鼠乳腺癌细胞系4T1来自美国组织培养库(American Tissue Culture Collection, ATCC),293T为本实验室保存。
1.2 试剂
表达载体pLenti-CMV-GFP-puro、pLenti-CMV-mIL-10-GFP-puro购自质粒与蛋白共享库,包装载体ΔR9、pVSVG为本实验室保存,RPMI-1640(美国Hyclone公司),磷酸盐缓冲液(美国Hyclone公司),胰蛋白酶(美国Hyclone公司),青霉素链霉素溶液(美国Hyclone公司),胎牛血清(杭州四季青生物工程材料有限公司),Pacific Blue anti-mouse CD45、PerCP-Cy5.5 anti-mouse CD3、PE-CY7 Rat anti-mouse CD4、BV510 Rat anti-mouse CD8、PE anti-mouse IFN-γ、APC anti-mouse MHCⅡ、PE anti-mouse PDL1、PE anti-mouse CD86、 APC anti-mouse IL-10(美国BioLegend公司),小鼠外周血淋巴细胞分离液试剂盒(北京索莱宝科技有限公司),胶原酶、透明质酸酶、DNA酶(美国sigama公司),Cell Activation Cocktail(with Brefeldin A)(美国Biolegend 公司),Mouse IL-10 ELISA试剂盒(达科为生物技术有限公司)。
1.3 仪器
流式细胞仪(美国BeckmanCoulter公司)、超微量分光光度计(美国Thermo公司)、低温离心机(美国Thermo公司)、DMILLED倒置显微镜 (德国Leica公司)、HERACELL150iC02细胞培养箱(美国Thermo公司)、SC-3610低速离心机(安徽中科中佳科学仪器有限公司)。
1.4 慢病毒包装以及稳定转染细胞株的建立
慢病毒包装前1 d,将对数生长期的293T消化重铺于60 mm细胞培养皿中,37 ℃ CO2培养箱培养过夜,第2天细胞密度达到70%-80%时,进行慢病毒包装。重组质粒pLenti-CMV-GFP-puro或者pLenti-CMV-mIL-10-GFP-puro各2.5 μg、慢病毒包装质粒ΔR9 2.25 μg、pVSVG 0.25 μg、500 μl不完全DMEM、5 μl Fugene混匀,室温静置30 min,随后均匀的加入293T细胞培养液中,37 ℃ CO2培养箱培养。72 h后,收集病毒上清液,0.45 μm滤膜过滤,-80 ℃保存。
状态良好的4T1细胞消化并接种于六孔板中,待细胞密度达60%左右即可进行慢病毒感染。丢弃原先的细胞培养上清液,加入5 ml病毒上清液和5 μl polybrene混匀,37 ℃ CO2培养箱培养6 h,弃去病毒液,加入新鲜的完全1640培养基,48 h后,添加嘌呤霉素(2 μg/ml)进行筛选。
1.5 流式细胞仪检测感染效率
将4T1以及嘌呤霉素筛选后的4T1/GFP(对照组)、4T1/mIL-10(实验组)扩大培养后,取100 μl细胞悬液过滤,流式细胞仪检测感染效率。
1.6 ELISA以及FCM检测mIL-10的表达水平
4T1、4T1/GFP、4T1/mIL-10细胞接种于六孔板中,48 h后收集细胞培养上清,2 000 r/min离心20 min,按照ELISA试剂盒说明书进行操作。
细胞4T1、4T1/GFP、4T1/mIL-10经Cell Activation Cocktail(with Brefeldin A)(1 ∶1 000)刺激4 h后,胰蛋白酶消化收集细胞,PBS清洗2遍,弃上清,500 μl fix buffer重悬,室温避光20 min,加1 ml破膜剂,1 800 r/min离心5 min,弃上清,重复一遍,然后每管加100 μl破膜剂,加APC anti-mouse IL-10抗体1 μl,室温避光20 min,每管加1 ml破膜剂,离心1 800 r/min,5 min,弃上清,加150 μl PBS,过滤细胞,流式细胞仪检测。
1.7 细胞增殖能力检测
将对数生长期的4TI/GFP、4TI/mIL-10细胞消化,以5×104个/孔种植于12孔板中,37 ℃ CO2培养箱培养,每隔1 d收获细胞,台盼蓝染色,区分死活细胞,计算活细胞的数量,共计3次。
1.8 流式细胞术检测细胞表面分子PDL1、MHCⅡ、CD86的表达水平
收集对数生长期的4T1、4TI/GFP、4TI/mIL-10细胞,PBS清洗两遍,100 μl PBS重悬,PDL1、MHCⅡ、CD86抗体各加1 μl,冰上避光孵育20 min,1 ml PBS 1 500 r/min离心5 min,弃上清,重复一遍,300 μl PBS重悬,200目滤网过滤,流式细胞仪检测。
1.9 皮下4T1乳腺癌转移模型的建立
生长状态良好的4TI/GFP、4TI/mIL-10细胞消化离心,重悬于PBS中,调整细胞密度为1×107/ml,每只小鼠皮下注射100 μl,观察成瘤情况。每3 d用游标卡尺测量肿瘤大小,以公式(长×宽×宽/2)计算肿瘤体积,绘制生长曲线。
1.10 FCM检测肿瘤组织中免疫细胞的变化
荷瘤小鼠15 d后,将荷瘤小鼠安乐死,分离肿瘤组织,拍照。将瘤块置于1640培养液中,手术剪将组织剪碎,使组织碎片小于5 mm。随后,将剪碎的组织块及液体转移至15 ml离心管中,加入胶原酶、透明质酸酶、DNA 酶,使其终浓度分别为2 mg/ml,2 mg/ml,25 μg/ml,37 ℃消化45 min,研磨,70 μm滤网过滤,除去组织残渣。PBS洗涤细胞,用小鼠淋巴细胞分离液富集淋巴细胞,PBS洗涤细胞两遍,重悬。一部分流式细胞仪检测肿瘤组织中CD4+T、CD8+T细胞的数量变化,另一部分细胞刺激剂刺激4 h,收获细胞,然后用流式细胞仪检测肿瘤组织中CD4+T、CD8+T细胞分泌IFN-γ的变化。
1.11 统计学分析

2 结果
2.1 成功构建过表达mIL-10的4T1稳定转染细胞株
流式细胞术检测结果显示,对照组(4T1/GFP)和实验组 (4T1/mIL-10)感染效率都达到93%以上(见图1)。ELISA与FCM结果显示,实验组mIL-10的表达水平显著高于对照组(P<0.05,见图1)。结果表明,成功构建过表达mIL-10的4T1稳定转染细胞株。
2.2 过表达mIL-10对4T1细胞增殖能力的影响
细胞计数显示,4T1/mIL-10组与4T1/GFP组差异无统计学意义(P>0.05,见图2)。结果表明,过表达mIL-10对4T1细胞的增殖能力无明显影响。

图1 过表达mIL-10的4T1稳定转染细胞株的构建与鉴定Figure 1 Construction and identification of 4T1 stably transfected cell line overexpressing mIL-10

图2 细胞计数检测mIL-10过表达对4T1细胞增殖的影响Figure 2 Effect of IL-10 overexpression on the proliferation of 4T1 cells
2.3 过表达mIL-10对4T1细胞表面分子的影响
流式细胞仪检测细胞表面CD86、MHCⅡ、PDL1的表达,发现4T1/mIL-10组与4T1/GFP组相比差异无统计学意义(P>0.05,见图3)。结果表明,过表达mIL-10对4T1细胞表面CD86、MHCⅡ、PDL1的表达无影响。
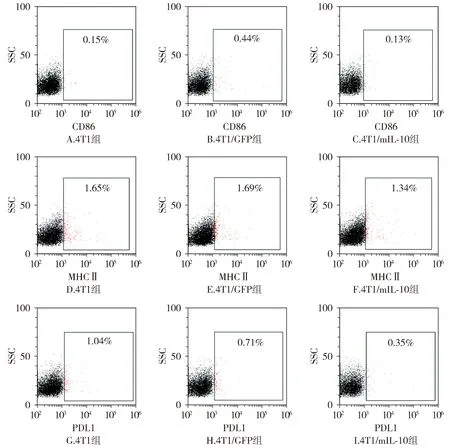
图3 过表达mIL-10后4T1细胞表面分子的变化Figure 3 Changes of surface molecules in 4T1 cells after overexpression of mIL-10
2.4 mIL-10治疗后小鼠皮下4T1乳腺癌转移模型中免疫细胞的变化
流式细胞仪检测结果显示,与未治疗组(4T1/GFP)相比,mIL-10治疗组(4T1/mIL-10组)CD8+T/CD4+T比例明显增加(P<0.05,见图4)。肿瘤组织中,mIL-10能够促进CD8+T细胞分泌IFN-γ(P<0.05),但对CD4+T细胞无明显影响(P>0.05,见图4)。结果表明,mIL-10能够增强荷瘤小鼠的抗肿瘤免疫应答。

与4T1/GFP组比较,*P<0.05图4 4TI/mIL-10小鼠乳腺癌肿瘤组织中免疫细胞的变化Figure 4 Changes of immune cells in breast cancer tissues of 4T1/mIL-10 mice
2.5 mIL-10治疗后荷瘤小鼠肿瘤大小变化
与未治疗组(4T1/GFP)相比,mIL-10治疗组(4T1/mIL-10)肿瘤大小明显减小(P<0.05,见图5)。结果表明mIL-10能够显著抑制肿瘤的生长。
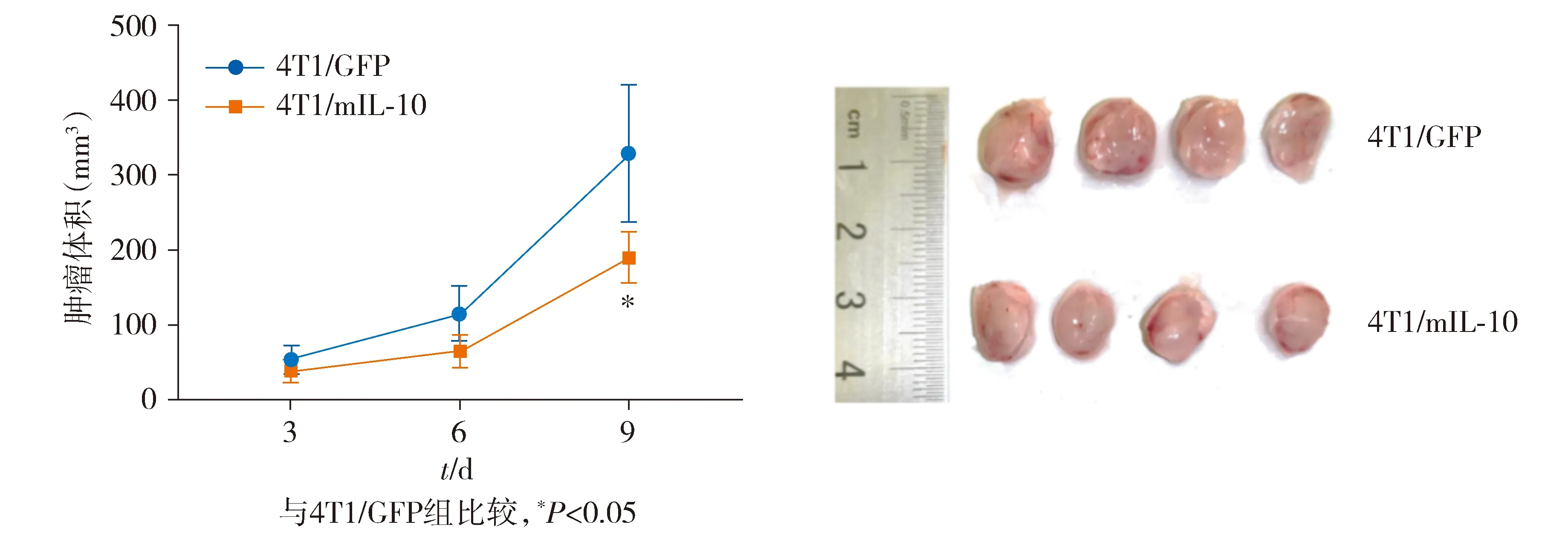
图5 荷瘤小鼠肿瘤大小变化Figure 5 Changes of tumor size in tumor bearing mice
3 讨论
免疫治疗已成为继手术治疗、化疗和放射治疗之后的第四大癌症治疗方法[4]。免疫检查点阻断剂(PD-1/PD-L1抑制剂、CTLA4抑制剂等)在不同肿瘤类型中的临床应用说明免疫治疗的独特之处。免疫刺激因子,比如IL-2能够有效地激活免疫细胞,并获得美国食品和药物管理局(FDA)的批准用于临床[5]。如今,免疫治疗已经成为乳腺癌的一种新的治疗方式[6]。作为一种异质性疾病,乳腺癌具有3种不同的临床亚型,分别为:Luminal、表皮生长因子受体-2+(HER-2+)以及三阴性乳腺癌。对于Luminal、HER-2而言,雌激素、孕激素以及赫赛汀(Herceptin)等免疫疗法具有良好的反应[7],而三阴性乳腺癌迄今为止没有好的治疗方法。
IL-10可以由多种细胞分泌,包括单核/巨噬细胞、B细胞、树突状细胞(DC)、CD4+以及CD8+T细胞等[8]。作为一种关键的免疫调节因子,IL-10的缺乏与自身免疫性和炎症性疾病有关。有文献报道,在IL-10或者IL-10R缺乏的动物模型中,小鼠会自发地形成炎症性肠病(IBD),IL-10治疗后症状明显改善[9]。一直以来,IL-10被认为可以抑制单核细胞与树突状细胞表面CD80/CD86、MHCⅡ分子的表达,从而促进肿瘤逃逸[10]。在正常生理条件下,PDL1/PD1信号通路起着负性调节的作用,防止免疫系统过度活化,维持机体免疫稳态。在癌症组织中,肿瘤细胞受到一些炎症因子(如IFN-γ)的刺激,表面PDL1的表达上调,与T细胞表面配体PD1结合后,引起T细胞的失能,这也是肿瘤细胞逃避免疫监视的重要手段之一[11]。本研究通过慢病毒感染细胞,构建过表达mIL-10的小鼠乳腺癌4T1细胞系,发现4T1细胞系表面CD86、MHCⅡ分子并没有下降,而且PDL1的表达也没变化,这极有可能与细胞类型有直接的关系。
免疫系统在乳腺癌的发生、发展和控制中起着重要的作用[12]。其中,CD8+T细胞在抗肿瘤免疫应答中起着重要的作用。活化的CD8+T细胞不仅能够直接分泌穿孔素、颗粒酶直接杀伤肿瘤细胞,而且能够分泌促炎因子IFN-γ来增强免疫应答[13]。因此,一些肿瘤可以通过降低肿瘤特异性CD8+T的活性来介导免疫逃逸。在大多数抗肿瘤的免疫研究中,认为IL-10是引起免疫抑制肿瘤微环境的主要原因[14]。然而,与以往观点不同,越来越多的证据证明IL-10能够促进抗肿瘤免疫。Mumm等[15]发现系统性地注射聚乙二醇化的IL-10(PEG-IL-10)能够促进肿瘤组织中CD8+T细胞的浸润以及活化,从而抑制肿瘤的生长。Huang等[2]发现在黑色素瘤小鼠模型中,mIL-10能够抑制肿瘤的生长和转移。在本研究中,过表达mIL-10对4T1细胞本身的增殖并没有影响,这说明mIL-10在体内抑制肿瘤的生长并不是通过影响肿瘤细胞本身引起的,这与Adris等[3]的研究一致。体内实验中,我们发现mIL-10治疗组CD8+T/CD4+T比例明显增加,而且CD8+T细胞活性增强,分泌更多的IFN-γ,但对CD4+T细胞无明显影响。说明mIL-10并没有改变4T1细胞本身的免疫原性,而是作用于宿主的免疫系统,促进肿瘤组织中淋巴细胞的浸润,从而延缓肿瘤的生长。
综上所述,过表达mIL-10能够促进抗肿瘤免疫应答,从而抑制肿瘤的生长,为乳腺癌的治疗方法提供新的思路与理论基础。
