ZM447439对乳腺癌细胞运动能力及凋亡的影响
2021-06-18王耀一武雪亮张志生杨修明乔志飞梁晚平
张 月,王耀一,武雪亮,张志生,杨修明,姜 洋,乔志飞,梁晚平,薛 军
(河北北方学院附属第一医院乳腺外科,张家口 075000;*通讯作者,E-mail:xuejunhebei@163.com)
三阴性乳腺癌(triple negative breast cancer,TNBC)发病年轻,就诊时原发肿瘤大,组织学分级高,腋淋巴结阳性者较多,分期较晚,生物学上更具有侵袭性,由于TNBC缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER-2)的表达,传统细胞毒性化疗,仍然是治疗三阴性乳腺癌的有效方法,可选择药物并不多,受到耐药性的限制,治疗方法有限,临床预后差[1]。然而,目前尚无十分有效的靶向治疗药物,发掘新的治疗靶点和开发新的药物,改善三阴性乳腺癌的疗效和预后,成为我们研究的重点。
ZM447439作为高选择性Aurora A、B抑制剂,证实在急性骨髓淋巴细胞系可有效诱导凋亡[2],但关于ZM447439抑制乳腺癌细胞侵袭及转移方面研究较少,本研究通过探讨ZM447439对Aurora激酶高表达的三阴性乳腺癌细胞系MDA-MB-231凋亡和运动能力的影响及分子机制,从而为晚期乳腺癌的治疗提供有效靶点、发掘有效抗癌药物提供理论基础。
1 材料与方法
1.1 细胞与试剂
MDA-MB-231细胞系由河北北方学院实验室传代保存。ZM447439由Selleck chemicals公司惠赠。RPMI-1640培养液购自美国Gibico公司;胎牛血清购自新西兰Hyclone公司;趋化小室购自美国Neuro Probe公司;Fibronectin购自美国Sigma公司;BCA蛋白分析试剂盒购自美国Pierce公司;p-Aurora A、Aurora A、p-HistoneH3、HistoneH3、cdc25c、p-cdc25c、cdc2、p-cdc2、p-丝切蛋白(Cofilin-1)、Cofilin-1、Bcl-XL、Bcl-2、PARP、Caspase-3、β-actin一抗单克隆抗体均购自美国Cell Signaling公司。染料Hochest 333342、Yo-Pro-1购于美国Invitrogen公司;Annexin Ⅴ/碘化丙啶(propidium iodide,PI)试剂盒购自美国BD pharmingen公司。
1.2 方法
1.2.1 MTT法检测细胞增殖制率 取不同浓度(0,0.01,0.1,1,10 μmol/L)ZM447439分别处理MDA-MB-231细胞24,48 h后每孔加入MTT,继续培养4 h后弃上清,加入二甲基亚砜震荡充分溶解显色,酶标仪波长570 nm处检测各孔吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率(%)=(对照孔A值-加药孔A值)/对照孔A值×100%。
1.2.2 细胞周期和DNA倍体分析 将进行细胞周期检测的MDA-MB-231细胞,分别用ZM447439浓度为0,1 μmol/L处理细胞48 h,收集细胞并调整细胞数至1×106/ml,用冷PBS洗涤细胞,离心,预冷的95%乙醇固定,再离心,弃去乙醇,加入PI后,在流式细胞仪上机分析,检测每管样品1×104个,并用Multicycle软件进行DNA倍体及细胞周期的分析。
1.2.3 荧光染料显色法检测细胞多核现象 MDA-MB-231细胞以适当细胞浓度接种于6孔板中。将ZM447439以0,1,10 μmol/L预处理细胞24 h,PBS冲洗,1 μmol/L ZM447439处理MDA-MB-231细胞48 h加入Hoechst 33342(5 μg/ml)染色液,Hoechst 33342是DNA特异性染料,将细胞核染为蓝色,室温孵育30 min后,倒置荧光显微镜下观察多核细胞。
1.2.4 流式细胞术检测细胞凋亡 ZM447439(0,0.1,1,10 μmol/L)处理MDA-MB-231细胞,24 h后收集细胞,用0 ℃预冷的PBS洗涤2次,调整细胞密度,取105个细胞进行试验,分别加Annexin Ⅴ 5 μl和PI(5 mg/L)5 μl,混匀,室温避光孵育15 min后,加入500 μl结合缓冲液,4 ℃静置30 min,在流式细胞仪上测定细胞凋亡率。
1.2.5 Western Blotting检测凋亡相关蛋白(Bcl-2、Bax、PARP等)的表达 ZM447439(0,0.01,0.1,1,10 μmol/L)处理细胞后进行裂解、变性、进行蛋白定量后电泳,分离蛋白,转膜。封闭后将膜转入p-Aurora A、Aurora A、p-Histone H3、Histone H3、CyclinB1、cdc25c、p-cdc25c、cdc2、p-cdc2、p-cofilin-1、Cofilin-1、Bcl-XL、Bcl-2和PARP一抗稀释液(1 ∶1 000)中4 ℃过夜,二抗室温孵育1 h,TBST洗膜3次后ECL显影,于暗室曝光。
1.2.6 划痕试验 将细胞接种于6孔板内培养,待细胞长满单层后用灭菌10 μl枪头在细胞单层上垂直划痕,用PBS洗两次以洗去细胞碎片,加入ZM447439(0,0.01,0.1,1,10 μmol/L)继续培养,以0,3,6,12,24 h为时间梯度,在倒置显微镜下测量划痕愈合程度,计算平均值。
1.2.7 趋化试验 ZM447439(0,0.01,0.1,1,10 μmol/L)分别处理MDA-MB-231细胞24 h,调整细胞密度至1×105/ml,在Boyden趋化小室上室中加入,取0.001% Fibronectin包被后的聚碳酸酯膜置于趋化小室的上下室之间压紧,在上室中加入上述细胞悬液250 μl,培养5 h后取出聚碳酸酯膜,将穿过膜的细胞固定染色后,在显微镜下(×40)随机取3个视野,计数穿膜细胞数。
1.3 统计学处理
2 结果
2.1 ZM447439抑制细胞增殖
MTT法显示不同浓度ZM447439(0.01,0.1,1,10 μmol/L)分别作用24,48 h时,在同一时间下随着ZM447439药物浓度的增加,细胞增殖抑制率逐渐增加;在同一浓度下随着ZM447339药物作用时间的延长,细胞增殖抑制率逐渐增加,差异有统计学意义(P<0.05),ZM447439对MDA-MB-231细胞的增殖抑制作用具有剂量及时间依赖性,24 h的IC50值为(0.15±0.33)μmol/L,10 μmol/L ZM447439作用于MDA-MB-231细胞24,48 h增殖抑制率为(62.23±0.03)%和(84.17±0.01)%(见图1)。
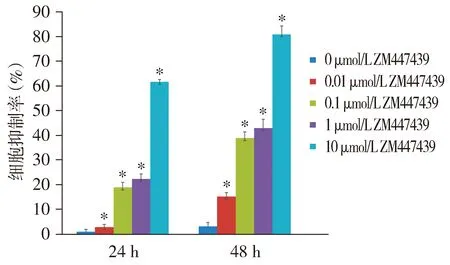
与0 μmol/L比较,*P<0.05图1 ZM447439作用于MDA-MB-231细胞不同时间的抑制率Figure 1 Inhibition rate of MDA-MB-231 cell proliferation after treated with ZM447439 for different time by MTT
2.2 ZM447439诱导MDA-MB-231细胞多核的形态学变化
与0μmol/L相比,1 μmol/L ZM447439作用于MDA-MB-231细胞48 h可见细胞核分叶,出现多核现象(见图2)。

图2 ZM447439作用于MDA-MB-231细胞48 h可诱导多核细胞 (×100)Figure 2 ZM447439 induced polynuclear of MDA-MB-231 after treatment for 48 h
2.3 ZM447439对细胞周期和凋亡的影响
1 μmol/L ZM447439作用于MDA-MB-231细胞48 h出现了多倍体现象(见图3),且0.1,1,10 μmol/L的ZM447439分别作用于MDA-MB-231细胞时,凋亡率分别为(17.4±2.2)%,(28.5±3.1)%,(51.8±5.4)%。与对照组[(0.6±0.2)%]相比,差异均有统计学意义(P<0.05,见图4),可见随着ZM447439浓度的增加,细胞的凋亡率增加。Western blotting显示,随ZM447439浓度的增加,抗凋亡蛋白Bcl-XL、Bcl-2表达逐渐减少,而凋亡相关蛋白PARP剪切带更加明显(见图5)。
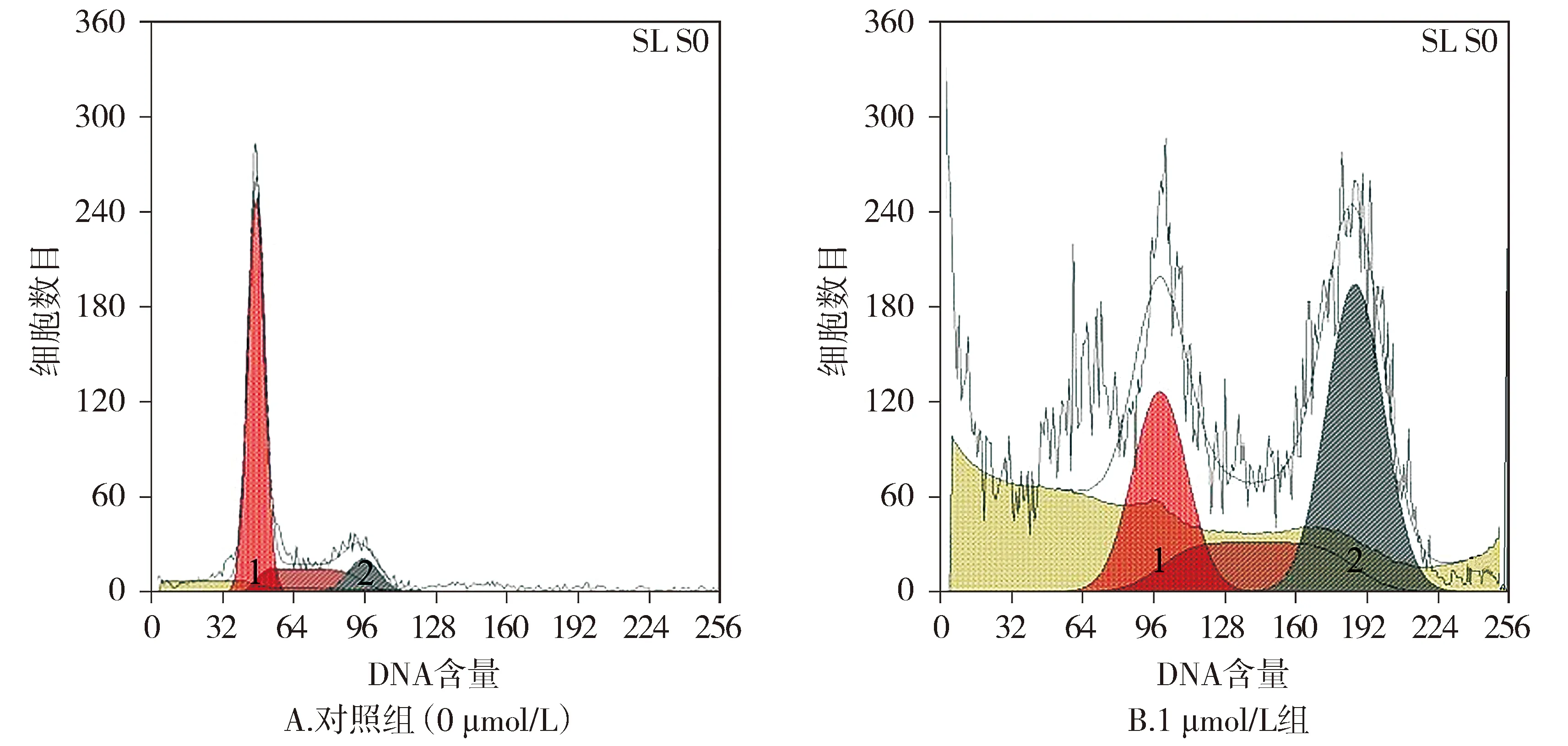
1.G1峰;2.G2/M峰图3 ZM447439作用48 h对MDA-MB-231细胞周期的影响Figure 3 Effects of ZM447439 on cell cycle of MDA-MB-231 at 48 h

图4 ZM447439对MDA-MB-231细胞凋亡率的影响Figure 4 Effects of ZM447439 on apoptotic rate of MDA-MB-231

与0 μmol/L比较,*P<0.05图5 ZM447439对MDA-MB-231细胞凋亡相关蛋白表达的影响Figure 5 Effect of ZM447439 on apoptotic proteins in MDA-MB-231 by Western blot
2.4 ZM447439对细胞划痕愈合能力的影响
0 μmol/L ZM447439作用24 h划痕已大部分愈合,而10 μmol/L ZM447439作用后划痕愈合速度明显慢于0 μmol/L ZM447439(见图6)。同一时间不同浓度ZM447439(0.01,0.1,1,10 μmol/L)分别与0 μmol/L相比,差异均有统计学意义(P<0.05,见图6),不同时间、不同浓度对细胞划痕愈合能力的影响不同,同一时间随着药物浓度增加迁移距离减慢,同一浓度随着时间增加迁移距离减慢。

图6 ZM447439对MDA-MB-231细胞迁移能力的影响Figure 6 Effects of ZM447439 on migration of MDA-MB-231
2.5 ZM447439对细胞趋化能力的影响
0,0.01,0.1,1,10 μmol/L ZM447439作用后穿膜细胞数分别为每个高倍镜视野下129.7±2.1,103.3±2.5,96.0±3.6,79.3±2.3,68.3±2.8,0.01,0.1,1,10 μmol/L ZM447439组穿膜细胞数分别与0 μmol/L组相比,差异均有统计学意义(P<0.05,见图7)。随着ZM447439浓度的增加,穿膜细胞数目减少。

图7 ZM447439对MDA-MB-231细胞趋化能力的影响Figure 7 Effects of ZM447439 on chemotaxis of MDA-MB-231
2.6 ZM447439对细胞Aurora A、Histone H3、cdc25c、cdc2、Cofilin-1磷酸化水平及CyclinB1的影响
随着ZM447439浓度的增加,Aurora A、HistoneH3、Cofilin-1总蛋白表达没有明显变化,而相应磷酸化蛋白逐渐减少,cdc25c、cdc2总蛋白表达没有明显变化,而相应磷酸化蛋白逐渐增加(见图8),提示ZM447439可以有效抑制Aurora激酶和Cofilin-1磷酸化水平及CyclinB1的表达。
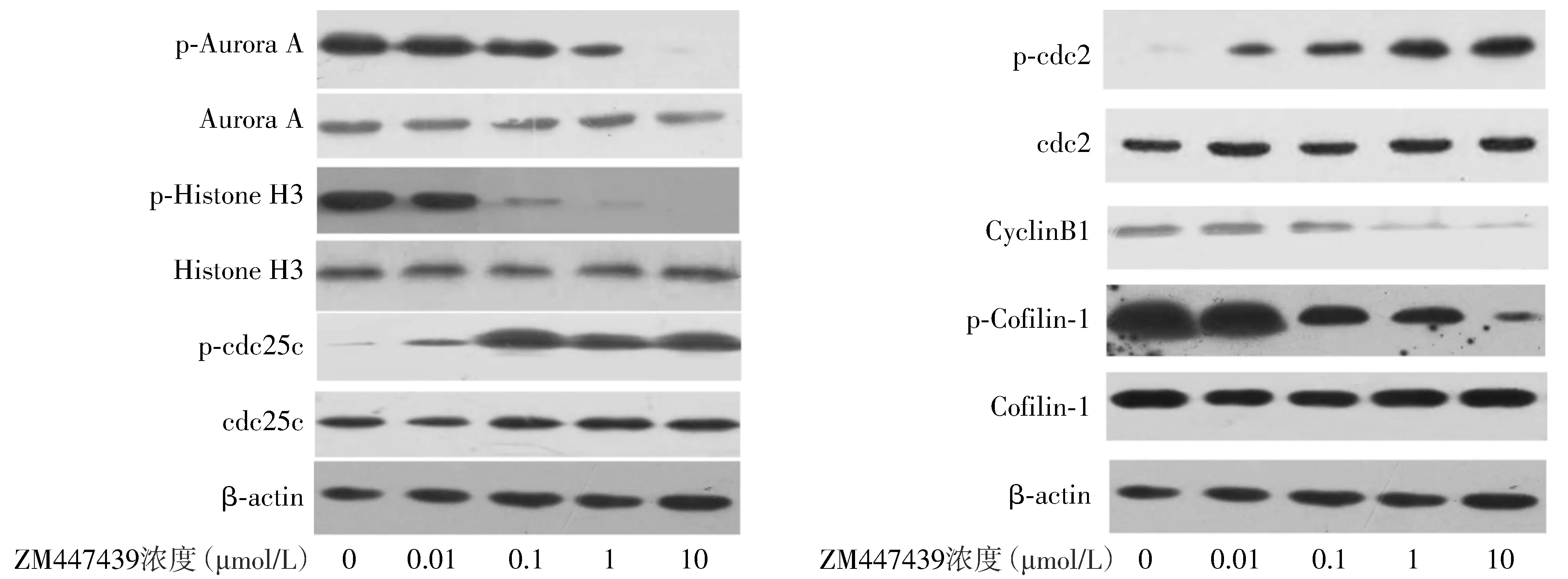
图8 Western blot对MDA-MB-231细胞周期相关蛋白表达的影响Figure 8 Effects of ZM447439 on expression of cell cyclin proteins in MDA-MB-231 by Western blot
3 讨论
TNBC作为一种独特的乳腺癌亚型,其临床、病理以及分子生物学特征具有高度异质性,有着某些独特的生物学行为,其中95%TNBC为浸润性导管癌,只有1%-2%TNBC为浸润性小叶癌,在诊断TNBC的前3年内早期复发风险高,远处转移常见,肺、脑转移率高,病情进展快,对于gBRCA突变的TNBC,PARP抑制剂是可选择的唯一靶向药物,只有10%的TNBC存在gBRCA突变,TNBC肿瘤异质性很高,PARP抑制剂并不适合所有TNBC患者,寻找新的靶点对于TNBC有着重要意义,Aurora激酶为TNBC的治疗提供新的思路。
Aurora激酶家族属于丝苏氨酸激酶,在有丝分裂染色体线性结构形成,胞质分离中有重要作用,包括Aurora A、Aurora B、Aurora C三种,AuroraA位于近中心体区域,负责收集在有丝分裂中形成线粒体的重要物质,调节G2期向M期过渡,有研究证实,到目前为止Aurora激酶家族中只有Aurora A是致癌基因[3-5]。Aurora B作为染色体信使蛋白在有丝分裂前中期位于中心体,在后期及末期位于微管中区,Aurora B在染色体线性结构形成,着丝点微管双定位,纺锤体检查点激活和细胞分裂中发挥作用,并且与组蛋白H3的磷酸化相关[6]。Aurora C位于染色体信使复合物中,在细胞周期中维持纺锤丝的整体性。
小分子Aurora激酶抑制剂ZM447439抑制TNBC细胞运动,诱导凋亡从以下几方面体现:①ZM447439抑制TNBC细胞增殖:TNBC细胞周期的进程启动是由细胞周期蛋白依赖性激酶(CDK)家族的成员与细胞周期蛋白结合共同作用的,cyclinB1/CDK1在成熟促进因子(MPF)中心有催化活性,在G2期不被激活,当核胞膜破裂前被激活,有丝分裂前期激发一系列反应[7]。磷酸化Aurora激酶减少可促进cdc25c转化为磷酸化cdc25c,cdc25c磷酸化使CDK1的Thr14位点(即cdc2)磷酸化从而抑制cyclinB1/CDK1活性,ZM447439抑制Aurora激酶向磷酸化Aurora激酶转化,使磷酸化cdc25c和磷酸化cdc2的表达增加,从而抑制cyclinB1的表达[8],阻止G2期向M期过渡,抑制细胞增殖,流式细胞术及Western blot证实了这一点。②ZM447439抑制TNBC细胞侵袭及转移:TNBC细胞高侵袭性相关基因为Cofilin-1,Cofilin-1蛋白是肌动蛋白聚合和解聚的重要影响因子,促进形成细胞膜伪足,决定了细胞迁移的方向,细胞发生侵袭。Cofilin-1和p-Cofilin-1激活/失活调控癌细胞运动和转移[9,10]。Aurora A增加有活性的Cofilin-1在乳腺癌中的表达,促进细胞骨架重组,降低细胞间的黏附性,促进细胞运动,从而促进乳腺癌细胞迁移和淋巴结转移,Aurora激酶抑制剂可抑制乳腺癌细胞AuroraA的表达,下调p-Cofilin-1的表达,抑制乳腺癌细胞侵袭和转移[11]。③ZM447439诱导TNBC细胞凋亡:ZM447439作为小分子Aurora激酶抑制剂可抑制Histone H3的磷酸化,使细胞核分裂失败,乳腺癌细胞出现多核现象,胞质分离失败,形成多倍体细胞和很少部分二倍体细胞,最终为非整倍体,抑制G2/M过渡,诱导凋亡[12],使促凋亡蛋白表达增加,抑制凋亡蛋白表达减少,同时抑制磷酸化Aurora A的表达,可引起G2/M期阻滞,抑制p-Cofilin-1的活性,从而抑制TNBC细胞的侵袭及转移[13,14],本研究细胞划痕试验和趋化试验也证实了这一点。本研究中24 h的IC50值为(0.15±0.33)μmol/L,10 μmol/L ZM447439作用于MDA-MB-231细胞24,48 h增殖抑制率为(62.23±0.03)%和(84.17±0.01)%,随着ZM447439药物浓度的增加,细胞凋亡明显增加,在0.1,1,10 μmol/L凋亡率分别为(17.4±2.2)%,(28.5±3.1)%和(51.8±5.4)%,ZM447439可以增加MDA-MB-231细胞p-cdc25c、p-cdc2的表达,抑制CyclinB1,p-Cofilin-1表达,从而抑制迁移及趋化的能力,从分子机制上阐释了ZM447439具有抑制肿瘤侵袭和转移的作用Bcl-2表达逐渐减少,Bax,PARP剪切增加,抑制增殖,促进凋亡。
TNBC作为一个排他性诊断,事实上是一组异质性很大的疾病,依靠现有的临床和病理指标难以对患者进行个体化治疗和预后分析,TNBC治疗需要分而治之,从而达到改善患者治疗策略及预后目的,寻找潜在治疗靶点至关重要,ZM447439抑制MDA-MB-231细胞系增殖、侵袭和转移的研究,为Aurora激酶可作为治疗TNBC新的靶点和ZM447439作为治疗TNBC新的药物提供了理论依据。
