芍药甘草汤对炎症后肠易激综合征大鼠的干预作用和机制研究
2021-06-18常壮鹏邓贵凤邵云云
武 蓓,常壮鹏,邓贵凤,2,邵云云*
(1山西医科大学第二医院药学部,太原 030001;2山西医科大学药学院临床药学室;*通讯作者,E-mail:shaoyunyun4466@163.com)
肠易激综合征(irritable bowel syndrome,IBS)是一种常见的功能性胃肠道疾病,伴有腹痛和腹部胀大,烦躁不安和/或粪便性状改变等主要临床表现[1]。流行病学调查显示,在我国IBS发病率约为5%-6%,其中由胃肠道炎症引起的IBS又叫炎症后IBS(post-inflammatory IBS,PI-IBS),约占IBS总病例的1/3[2]。PI-IBS指急性胃肠道炎症恢复后仍存在持续的IBS症状,以腹痛和腹泻为主,严重影响患者生活质量和增加经济负担[3]。目前PI-IBS的病因尚不完全明确,多认为与内脏痛觉高敏感型、低度炎症、脑-肠轴超敏反应或肠道感染等有关[4]。由于其复杂的发病机制,临床上治疗PI-IBS多为对症治疗(如东莨菪碱、复方地芬诺酯等),疗效不确切且长期应用会产生较大副作用[5]。中医因其辨病与辨证相结合,整体调整,可弥补西医治疗方案的不足,减少西药长期服用的不良反应,在PI-IBS治疗方面有独特优势。芍药甘草汤(Shaoyao Gancao decoction,SGD)是著名的中药经典方剂,出自汉代张仲景的《伤寒论》,由白芍和甘草两味中药组成,有柔筋止痛之效,传统用于多种痛症和炎症疾病的治疗[6]。现代药理学研究表明,SGD主要成分如芍药苷和甘草次酸等均有解痉镇痛的作用[7,8],本课题组最近也发现SGD可以明显改善PI-IBS大鼠的腹痛腹泻症状[9],但由于SGD成分众多、作用靶点复杂,因此目前有关其治疗PI-IBS的分子机制尚不完全清楚,难以有效进行疗效评价,成为限制其现代化和临床应用的瓶颈。
代谢组学主要研究机体内源性代谢物质整体变化规律,与中医的整体观念和辨证思维相一致。利用系统代谢组学研究方法筛选出组织和体液中多种代谢产物及活性成分,进而发现药物作用靶点,充分发掘中药复方的整体性作用机制和疗效。本研究旨在探讨SGD对PI-IBS大鼠的干预作用,并基于代谢组学研究大鼠血浆内源性代谢产物的差异,以期为中药治疗PI-IBS作用机制的研究提供客观依据和新思路。
1 材料与方法
1.1 动物
雄性SD大鼠18只,体质量(200±20)g,购于国家食品药品检定研究院实验动物中心,合格证号:SCXK(京)2014-0013。空气温度25 ℃,12 h明暗交替,大鼠可以自由进食和饮水。
1.2 药物与试剂
白芍(安徽精诚本草中药饮片有限公司)、甘草(国药乐仁堂河北药业有限公司)饮片经山西医科大学第二医院张京平中药师鉴定为正品,2,4,6-三硝基苯磺酸(TNBS,美国Sigma公司),色谱甲醇(美国Fisher公司)。
1.3 仪器
超高效液相色谱仪(日本岛津公司),四级杆飞行时间质谱仪Q-TOF(美国AB Sciex公司),DZF-6050型真空干燥箱(苏州江东精密仪器公司),Kinetex XB-C18色谱柱(2.1 mm×100 mm,2.6 μm),高速离心机(德国Biofuge公司),真空干燥箱(苏州江东精密仪器公司)。
1.4 芍药甘草汤的制备
称取白芍和甘草饮片,按照质量1 ∶1比例混合,加入10倍量的无菌双蒸水,浸泡1 h,然后煎煮3次,每次1 h。合并滤液,浓缩至2.12 g/ml,放置在4 ℃冰箱中保存。
1.5 动物模型制备及给药
大鼠适应性喂养1周后,随机分为正常组、PI-IBS模型组和芍药甘草汤(SGD)组,每组6只。按照课题组前期方法[9]进行造模处理:大鼠禁食过夜后,通过塑料导管将TNBS溶液(0.8 ml/只)注入结肠中造模28 d,同时正常组大鼠给予等量的生理盐水,造模后通过测定大鼠的疾病活动指数(DAI)和内脏痛阈值评定模型制备是否成功。本课题组前期采用SGD低、中、高剂量[6.25,12.5,25 g/(kg·d)]对PI-IBS大鼠给药后发现高剂量组疗效最为显著[9],故本实验造模结束后SGD组给予25 g/(kg·d)灌胃给药14 d。
1.6 大鼠DAI值和内脏痛阈值的测定
记录大鼠造模及给药SGD后体质量变化率、粪便潜血量和粪便性状,共42 d,计算三者评分的均值,得到大鼠的DAI值。采用腹壁回缩反射实验检测大鼠的内脏痛阈值,将气囊导管导入结肠,大鼠适应30 min后,逐渐加压,直到观察到腹壁明显收缩,记录此时压力值为内脏痛阈值。
1.7 大鼠结肠组织病理学考察及病理损伤评分
末次给药24 h后,腹主动脉取血,4 000 r/min离心10 min取上清,-80 ℃保存备用。收集结肠组织,置于4%的甲醛溶液中固定,依次使用70%,80%,90%,95%的乙醇,二甲苯常规脱水,石蜡包埋,采用苏木素-伊红(HE)染色,光镜观察大鼠结肠组织病理形态学变化并依照参考文献[10]进行病理损伤评分。
1.8 血浆样本的处理
取各组大鼠血浆100 μl,加入300 μl甲醇涡旋震荡3 min,13 000 r/min离心10 min,取上清液真空干燥(37 ℃),100 μl甲醇复溶,涡旋3 min,13 000 r/min离心10 min,取上清待测。
1.9 检测条件
1.9.1 色谱条件 流动相水(A)和甲醇(B)梯度洗脱(0-2.0 min,5%B;2.0-8.0 min,5%-15%B;8.0-13.0 min,15%B;13.0-17.0 min,15%-30%B;17.0-22.0 min,30%B;22.0-26.0 min,30%-95%B;26.0-28.0 min,95%B;28.0-28.2 min,95%-5%B;28.2-30.0 min,5%B),流速0.3 ml/min,进样量5 μl。
1.9.2 质谱条件 采用正离子(ESI+)/负离子(ESI-)模式,离子源参数设置:气帘气40 psi;离子化电压为5 500 V(ESI+)/4 500 V(ESI-);喷雾气50 psi;辅助加热气50 psi;温度500 ℃。
1.10 统计学分析
采用MarkerView1.3软件处理数据,导入SIMCA-P13.0软件进行主成分分析(PCA)和正交偏最小二乘方-判别分析(OPLS-DA)。通过VIP>1且P<0.05筛选正常组与PI-IBS组的差异代谢物,将代谢差异物导入MetaboAnalyst数据库进行代谢通路分析。实验数据采用SPSS 22.0处理,组间两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠DAI值和内脏痛阈值的测定
正常组大鼠体质量逐步增加,粪便性状正常,无潜血,平均DAI值偏低;与正常组比较,模型组大鼠在TNBS造模后体质量明显下降,出现稀便且大便潜血严重,平均DAI值明显增加(P<0.05);与模型组比较,SGD组给药后大鼠DAI值明显降低(P<0.05,见图1)。同时,与正常组大鼠相比,模型组大鼠内脏痛阈值明显下降(P<0.05),表明存在内脏高敏感性;与模型组比较,SGD组给药后大鼠内脏痛阈值明显提高(P<0.05,见图1)。以上结果表明PI-IBS大鼠模型制备成功,SGD可明显降低PI-IBS大鼠的DAI值和内脏痛觉高敏感性。

与正常组比较,***P<0.001;与模型组比较,###P<0.001图1 各组大鼠DAI值和内脏痛阈值比较Figure 1 Comparison of DAI and visceral pain threshold of rats between groups
2.2 各组大鼠结肠组织病理学改变及病理损伤评分
正常组大鼠可观察到肠黏膜组织完整、表面光滑,上皮细胞排列整齐有序,未见炎性浸润损伤;模型组大鼠结肠组织明显增厚、充血和肿胀,大部分腺体结构消失,肠黏膜下层表现轻度充血和水肿;与模型组相比,SGD组大鼠结肠损伤明显改善,肠黏膜趋于完整且排列整齐,未见炎症细胞浸润,与正常组结构相似(见图2)。与正常组相比,模型组大鼠结肠组织病理损伤评分明显增加(P<0.05);与模型组比较,SGD组给药后病理损伤评分明显降低(P<0.05,见图2)。
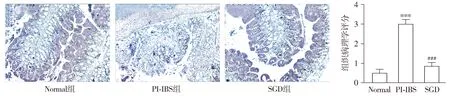
与正常组比较,***P<0.001;与模型组比较,###P<0.001图2 各组大鼠结肠组织病理学改变与病理评分比较 (HE,×100)Figure 2 Comparison of histopathological changes and pathological scores in the colon of rats between groups (HE,×100)
2.3 大鼠血浆代谢物PCA分析
在ESI+或ESI-下对正常组、PI-IBS组及SGD组大鼠血浆代谢物进行PCA分析。在ESI+下,R2X为0.469,Q2为0.0731;在ESI-下,R2X为0.452,Q2为0.101,提示本次研究模型预测性和解释性较好。血浆代谢物空间分布结果显示各组样本区分较好(见图3),表明组间代谢物差异可有效辨别。
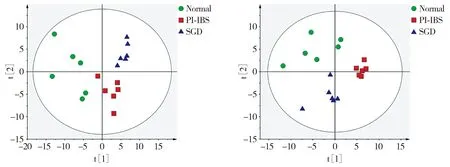
A. ESI+模式下PCA主成分分析图 B. ESI-模式下PCA主成分分析图 图3 各组大鼠血浆代谢物PCA分析Figure 3 PCA analysis of plasma metabolites of rats in each group
2.4 大鼠血浆代谢物OPLS-DA分析
在ESI+或ESI-下对大鼠血浆代谢物进行OPLS-DA分析。结果显示正常组和PI-IBS组,PI-IBS组和SGD组间均明显分离(见图4),可用于进一步寻找和分析组间差异成分。

图4 各组大鼠血浆代谢物OPLS-DA分析Figure 4 OPLS-DA analysis of plasma metabolites of rats in each group
2.5 大鼠血浆差异代谢物的鉴定
采用UPLC-Q/TOF-MS方法对大鼠血浆内源性代谢产物进行检测,结合OPLS-DA分析,正常组和PI-IBS组大鼠血浆共鉴定出30个差异代谢物(VIP>1且P<0.05);经SGD干预后,有14个差异代谢物回调到正常水平(见表1)。
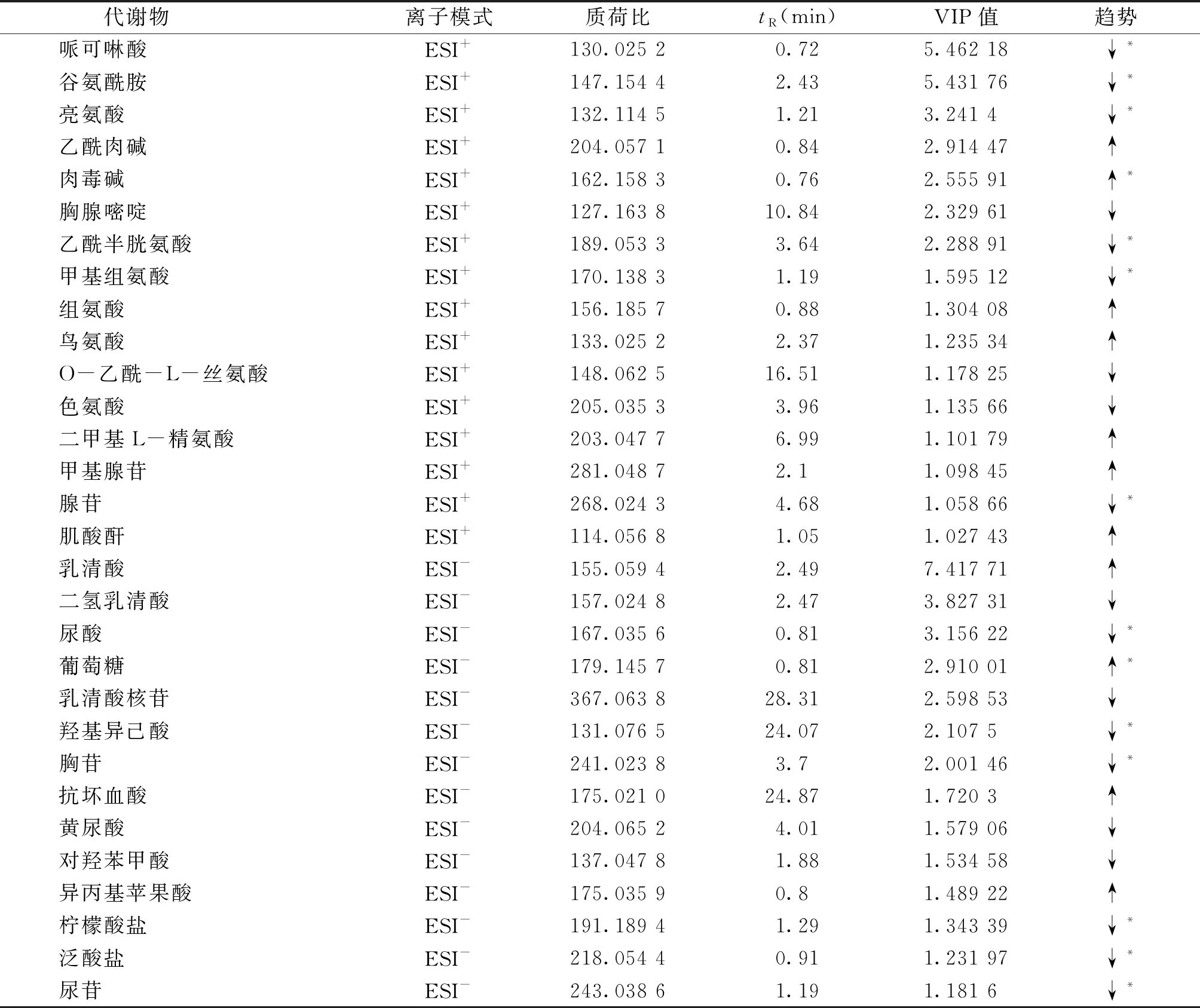
表1 PI-IBS组与正常组大鼠血浆差异代谢物 (未完待续)
2.6 SGD作用于PI-IBS大鼠的代谢通路分析
正常组与PI-IBS组的差异代谢物经MetaboAna-lyst进行通路富集分析,发现PI-IBS大鼠主要有7条代谢通路发生异常改变,SGD干预后能够调节其中的5条代谢通路,包括嘧啶代谢,丙氨酸、天冬氨酸和谷氨酸代谢,嘌呤代谢,乙醛酸和二羧酸的代谢和三羧酸(TCA)循环(见图5)。
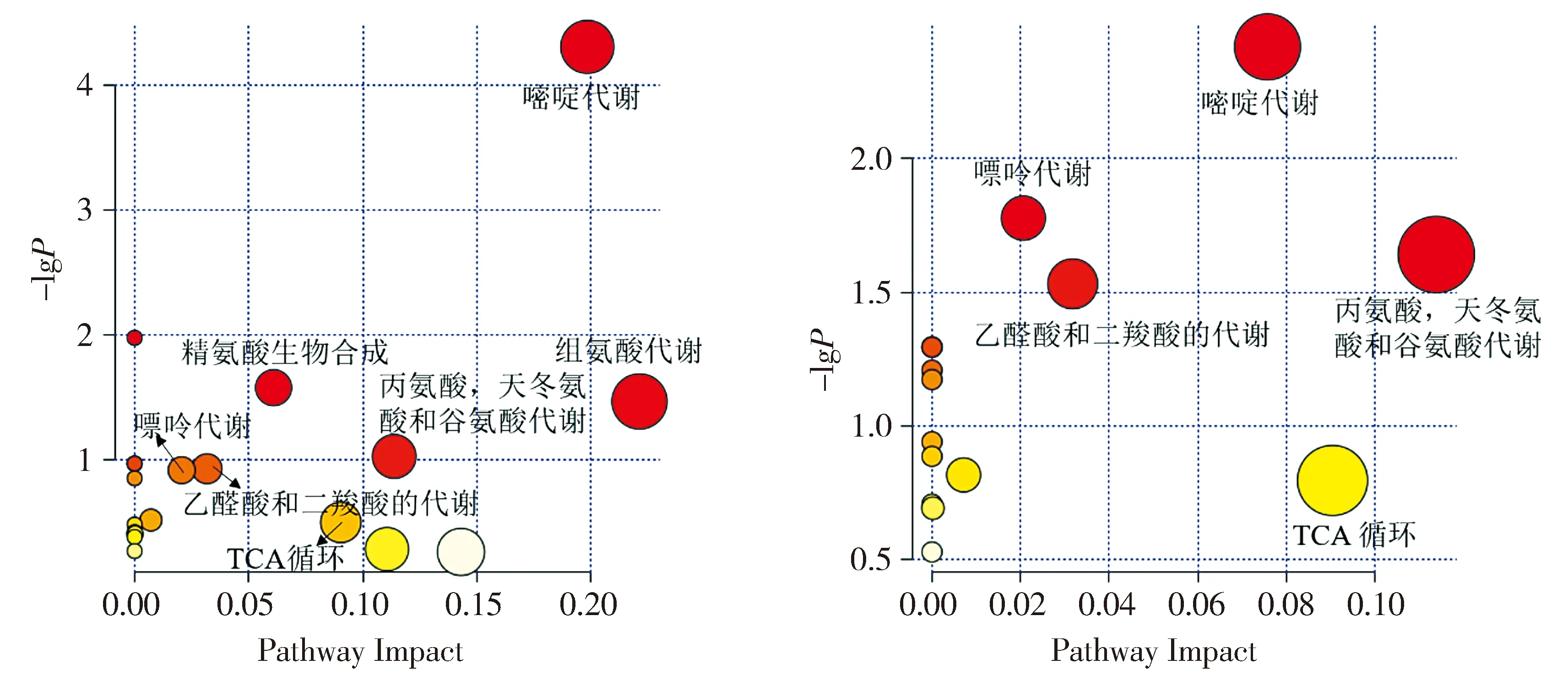
A.PI-IBS大鼠疾病条件下异常的血浆代谢通路分析图 B.SGD干预PI-IBS的血浆代谢通路分析图图5 代谢通路分析Figure 5 Metabolic pathway analysis
3 讨论
PI-IBS是一种常见的功能性胃肠道疾病,病因复杂多样。中医学中,PI-IBS属于“腹痛”“泄泻”等范畴,基本病机为肝郁气滞、脾胃不和、脾虚湿盛,进而引起肠道气机不利,传导失司[11]。调肝脾是治疗该病的关键治法,除湿止泻是治疗该病的必要手段。SGD方中白芍性微寒,归肝、脾经,有柔肝止痛之用,主治血虚腹痛、胁痛、痢疾等;甘草性平,归脾、胃经,有补脾益气之用,主治脾胃气虚、脘腹、挛急疼痛等,与白芍合用,可显著增强治腹痛腹泻的疗效[12]。近年来大量文献报道,SGD对胃肠痉挛性腹痛、IBS等有非常好的疗效[13]。本研究结果也显示SGD可显著改善PI-IBS大鼠排便异常症状,同时降低内脏痛觉高敏感性,减轻结肠黏膜损伤,疗效明显,与本课题组前期研究结果一致[9],但其作用机制尚不完全明确。
代谢组学的整体性思路与中医的系统观、整体观不谋而合,先进的代谢组学分析技术为中药复方多层次、多靶点治疗的作用机制研究提供了新思路与新方法。在本研究中,通过对正常组、PI-IBS组及SGD组大鼠血浆样本进行代谢组学分析,发现PI-IBS大鼠体内有30种代谢物水平发生明显改变,而灌胃给予SGD后,这些差异代谢物中有14种恢复至正常水平,包括哌可啉酸、谷氨酰胺、亮氨酸、肉毒碱、乙酰半胱氨酸、甲基组氨酸、腺苷、尿酸、葡萄糖、羟基异己酸、胸苷、柠檬酸盐、泛酸盐、尿苷,可能涉及嘧啶代谢,丙氨酸、天冬氨酸和谷氨酸代谢,嘌呤代谢,乙醛酸和二羧酸的代谢和TCA循环等多条通路。
嘧啶代谢和嘌呤代谢主要以谷氨酰胺等为原料,腺苷、胸苷、鸟苷等为中间产物,最终合成嘧啶核苷酸和嘌呤核苷酸。这两种代谢过程受一系列因子调控,当某一环节出现问题时会发生代谢紊乱,从而引发免疫系统、神经系统等多种疾病[14]。洪宗超等[15]报道溃疡性结肠炎大鼠体内嘧啶和嘌呤代谢发生异常。此外,孙倩倩[16]研究发现中药半夏泻心汤可通过调节嘧啶和嘌呤代谢恢复血清鸟苷、腺苷等水平进而抑制慢性萎缩性胃炎大鼠炎症反应的发生。本研究结果显示SGD组大鼠血浆腺苷、胸苷、尿苷水平相较于PI-IBS组明显上调,提示SGD也可能通过促进PI-IBS大鼠嘧啶和嘌呤代谢的恢复改善结肠炎症。
本研究还发现SGD治疗PI-IBS与其调节丙氨酸、天冬氨酸和谷氨酸代谢等多种氨基酸代谢有关。氨基酸是肠道细胞生长和分化必要的营养物质,也是肠道微生物合成蛋白质、嘧啶和嘌呤核苷酸及多种信号分子的必需前体和促进剂。肠道氨基酸代谢对维持肠细胞营养、保护肠黏膜屏障、调节肠免疫功能至关重要[17]。因此,SGD可能通过对氨基酸代谢的调控促进肠黏膜修复和减少炎症反应。
TCA循环是糖类、脂类及氨基酸的最终代谢通路,也是此三大营养物质代谢联系的枢纽,对于肠道细胞能量的获取至关重要[15]。本研究结果显示PI-IBS大鼠体内葡萄糖含量明显增加,TCA循环被抑制,其中间代谢产物柠檬酸明显减少,线粒体供能不足,ATP生成减少,导致肠道免疫细胞和屏障细胞抗感染、抗侵袭和抗凋亡能力减弱,造成肠道损伤。有研究表明甘草配伍入药后可通过影响TCA循环改善溃疡性结肠炎大鼠症状[15],故本研究中SGD也可能通过增加PI-IBS大鼠柠檬酸水平促进TCA循环,为肠道细胞正常发挥肠道保护作用提供能量。此外,在能量代谢中,我们还发现SGD影响了PI-IBS大鼠体内乙醛酸和二羧酸的代谢,此为TCA循环的支路,可补充某些中间代谢产物的不足,对于肠道微生物的代谢起着重要的作用。研究显示肠道菌群失调会产生多种有害代谢产物从而损伤肠道黏膜,与IBS的发生发展关系密切[18]。此外,本课题组前期研究结果表明SGD可以通过调节肠道菌群减少LPS的释放,并且降低肠道通透性,提示本研究中SGD可能通过影响肠道菌群代谢平衡进而减轻肠道损伤,改善PI-IBS症状。
综上所述,本研究发现SGD能够明显改善TNBS诱导的PI-IBS大鼠症状。进一步采用UPLC-Q/TOF-MS和代谢组学技术分析,推测SGD干预PI-IBS大鼠的机制涉及嘧啶代谢,丙氨酸、天冬氨酸和谷氨酸代谢,嘌呤代谢,乙醛酸和二羧酸的代谢和TCA循环等多条通路,但其具体作用机制仍需在后续实验中进一步验证。本研究一定程度上为该中药复方有效治疗PI-IBS提供了现代理论基础和科学依据。
