PTEN诱导激酶1在预测胃癌患者预后及化疗疗效中的作用
2021-06-05吴珍珍刘志宏孙丽
吴珍珍 刘志宏 孙丽
南方医科大学南方医院肿瘤内科(广州510515)
胃癌是我国乃至全世界最常见的恶性肿瘤之一,其发病率在世界范围内排第4 位,死亡率则高居世界第二[1]。近年来随着免疫治疗、靶向治疗等新兴治疗手段的兴起,胃癌患者的生存较前有所延长,但目前通过综合治疗,胃癌患者总体生存尚不理想[2]。目前仍需进一步探索新的预后标志物指导胃癌精准个体化治疗。
氧化应激是机体内活性氧生成与抗氧化机制之间相互平衡的适应性反应过程,也是肿瘤发生发展的重要环节之一[3]。研究显示,胃腺癌患者体内存在过高的氧化应激水平及过低的抗氧化水平[4],而过度的氧化应激可诱导细胞内相关信号转导通路的激活,提高胃癌细胞对氧化应激的适应能力,加速其进展[5]。因此,抑制氧化应激及其下游信号通路有望成为胃癌治疗的新方向。
PTEN诱导激酶1(PTEN⁃induced kinas 1,PINK1)是一种参与细胞内多个线粒体相关信号通路的蛋白[6]。研究显示,氧化应激下,PINK1 通过上调Bcl⁃xL等凋亡相关蛋白,调控与肿瘤发生发展密切相关的PI3K/Akt/mTOR 信号通路,促进细胞存活[7-9]。然而,目前PINK1 是否调控氧化应激相关的肿瘤进展尚未明确,PINK1 是否参与胃癌发生发展亦鲜有研究。本研究旨在分析PINK1 在胃癌中的表达情况及其对胃癌患者预后和化疗疗效的预测作用。
1 材料与方法
1.1 组织标本与材料
1.1.1 组织标本3 对新鲜胃癌组织及癌旁组织标本和153 例胃癌石蜡病理标本均取自南方医院。经组织病理明确病理类型为胃腺癌。组织学分类及分级、临床及病理分期参考世界卫生组织(WHO)胃癌病理标准及国际抗癌联盟和美国癌症联合委员会(UICC/AJCC)制定的第七版胃癌分期标准。所有病例随访资料齐全,并已通过南方医科大学伦理委员会的申请。
1.1.2 主要试剂基因引物序列见表1,购自上海生工生物工程股份有限公司。PINK1 蛋白、GAP⁃DH 蛋白抗体均购自Abcam 公司。
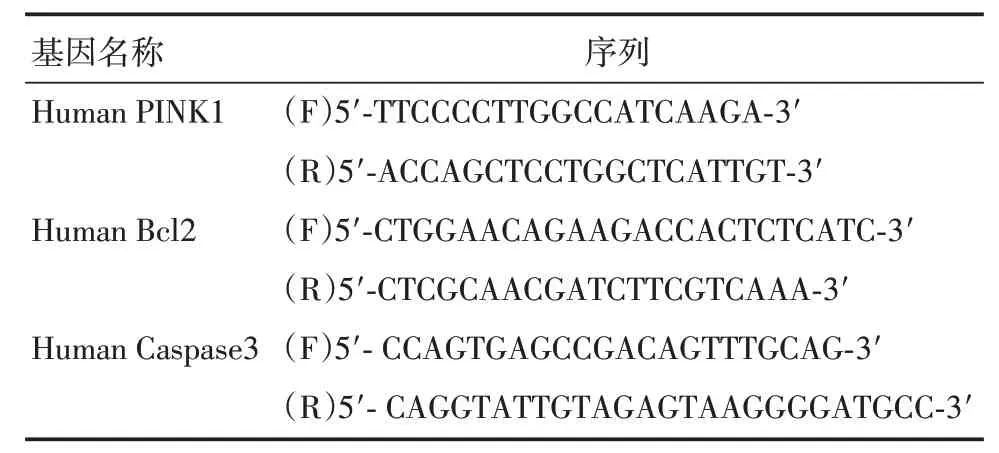
表1 引物序列列表Tab.1 Primer′s sequences
1.2 方法
1.2.1 KM⁃Plotter 网站数据分析登陆KM⁃Plotter在线生存分析网站(http://kmplot.com/analysis/)进行生存分析[10]。共纳入876 例随访资料齐全的胃癌患者测序结果进行分析。以PINK1 基因中位表达作为分界线,定义PINK1 低表达及高表达。
1.2.2 qRT⁃PCR提取细胞总RNA,逆转录成cDNA。定量即时聚合酶链锁反应(quantitative real time polymerase chain reaction,qRT⁃PCR)检测细胞中PINK1 mRNA 表达量,选取GAPDH 作为内参测算相对定量值。
1.2.3 Western blot提取胃癌组织总蛋白后高温变性并上样至聚丙烯酰胺分离凝胶。蛋白电泳分离后进行转膜。转膜后5%脱脂牛奶封闭1 h,4 ℃一抗孵育过夜,洗涤,荧光二抗室温孵育1 h,TBST清洗3 次。红外激光成像分析系统(双色odyssey)下显示PINK1 和GAPDH 的蛋白显影条带。
1.2.4 免疫组化染色石蜡病理标本切片(厚度4 μm)并进行脱蜡至水及抗原修复。PINK1 一抗4 ℃孵育过夜,洗涤。二抗4 ℃孵育1 h 后室温孵育1 h。经过二氨基联苯胺显色、苏木素复染后进行梯度脱水及树胶封片。由3 位不同研究者镜下观察,结合临床病理参数进行PINK1 免疫组化评分,根据其表达强弱分为0~6 分,其中0 分为阴性表达,1~5 分为阳性表达,6 分为强阳性表达。
英语新闻中很多新词的创造是基于隐喻之上的,与此同时,隐喻为很多原有词汇披上了一层面纱,赋予其新的意义。
1.3 统计学方法统计分析及图表绘制使用SPSS 23.0及GraphPad Prism 7 软件。采用两独立样本t检验或Mann⁃WhitneyU检验进行两组间比较,采用单因素方差分析进行两组以上比较。采用χ2检验进行组间比较。绘制受试者工作特征(ROC)曲线并计算曲线下面积,采用最大Youden 指数法计算截断值,以评估预后预测价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 KM⁃Plotter 网站分析PINK1 在胃癌中的表达及与预后、化疗疗效的相关性为明确PINK1 是否在胃癌中高表达并与胃癌患者预后及化疗疗效相关,首先在KM⁃Plotter 网站上进行初步分析。共有876 例随访资料齐全的胃癌患者测序结果纳入分析,患者基线特征见表2。以PINK1 基因中位表达作为分界线,定义PINK1 低表达及高表达。结果显示,对于所有纳入分析的患者,PINK1 基因高表达者的中位生存期为26 个月,短于低表达者的46 个月,生存风险比为0.56,差异有统计学意义(P= 0.000 1,图1A)。进一步分层分析显示,在不同临床分期、是否存在远处转移及不同病理分型亚组中,PINK1 高表达患者的生存期均显著低于低表达患者(图1B⁃D),但不同分化程度亚组中PINK1 高低表达两组胃癌患者预后无显著性差异(图1E)。对于Her2 高表达的这部分患者,PINK1高表达患者虽然有更差的生存期,但数据上差异无统计学意义(P= 0.075,图2A)。对于接受了以5⁃Fu 为基础的辅助治疗的患者中,PINK1 高表达者生存期较低表达者显著延长(P=0.036,图2B)。
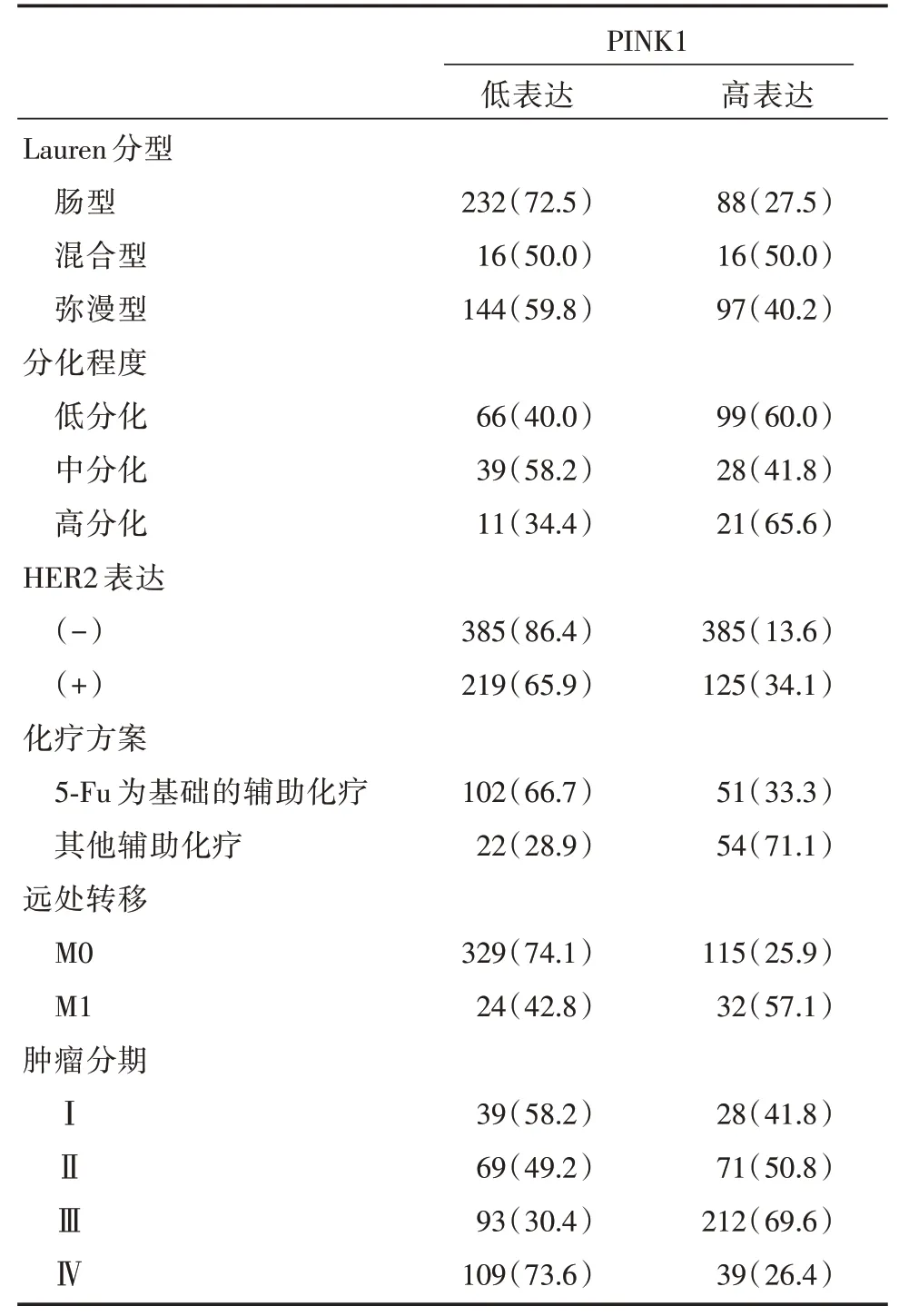
表2 KM⁃Plotter 网站分析中胃癌患者的基线特征Tab.2 Baseline characteristics of gastric cancer patients in KM plotter website analysis 例(%)
2.2 临床资料验证PINK1 在胃癌的表达情况及预后分析首先收集了3 对新鲜胃癌组织及癌旁组织标本,进行PINK1 mRNA qPCR 检测,结果显示,PINK1 的基因表达在胃癌组织中明显升高(P<0.001,图3A)。随后,在3对胃癌及癌旁组织中进行PINK1蛋白表达检测,结果显示,PINK1 蛋白在胃癌组织中显著高表达(P<0.05,图3B-C)。
此外,收集了随访资料齐全的153 例胃癌患者随访资料齐全的胃癌石蜡标本,并进行切片、PINK1免疫组化染色、读片,患者基线特征见表3。结果显示,相较于癌旁组织,胃癌组织的PINK1 表达量显著增加(P<0.05,图4A⁃B),且其表达强度与肿瘤浸润深度及分期呈正相关(图4C,P<0.05);PINK1在发生淋巴结转移(P<0.05,图4D)或远处转移(P<0.05,图4E)的胃癌患者中表达量显著高于未发生远处转移的患者。PINK1蛋白高表达的胃癌患者其总生存期较低表达患者显著缩短(图4F)。接受以5⁃Fu辅助化疗的胃癌患者中,PINK1蛋白高表达患者生存期较低表达患者显著延长(图4G)。

表3 临床资料分析中胃癌患者的基线特征Tab.3 Baseline characteristics of gastric cancer patients in clinical data analysis 例(%)
2.3 临床数据分析PINK1 在预测胃癌患者预后及化疗疗效中的作用PINK1免疫组化评分预测胃癌患者预后ROC 曲线见图5A,截断值为4.50,AUC(曲线下面积)为0.772(95%CI:0.642~0.901),敏感性为69.2%,特异性为76.0%,Youden 指数为0.452(表4)。PINK1 免疫组化评分预测胃癌患者5⁃Fu化疗疗效ROC 曲线如图5B,截断值为5.50,AUC为0.735(95%CI:0.598 ~0.872),敏感性为60.0%,特异性为76.9%,Youden 指数为0.369(表4)。
3 讨论
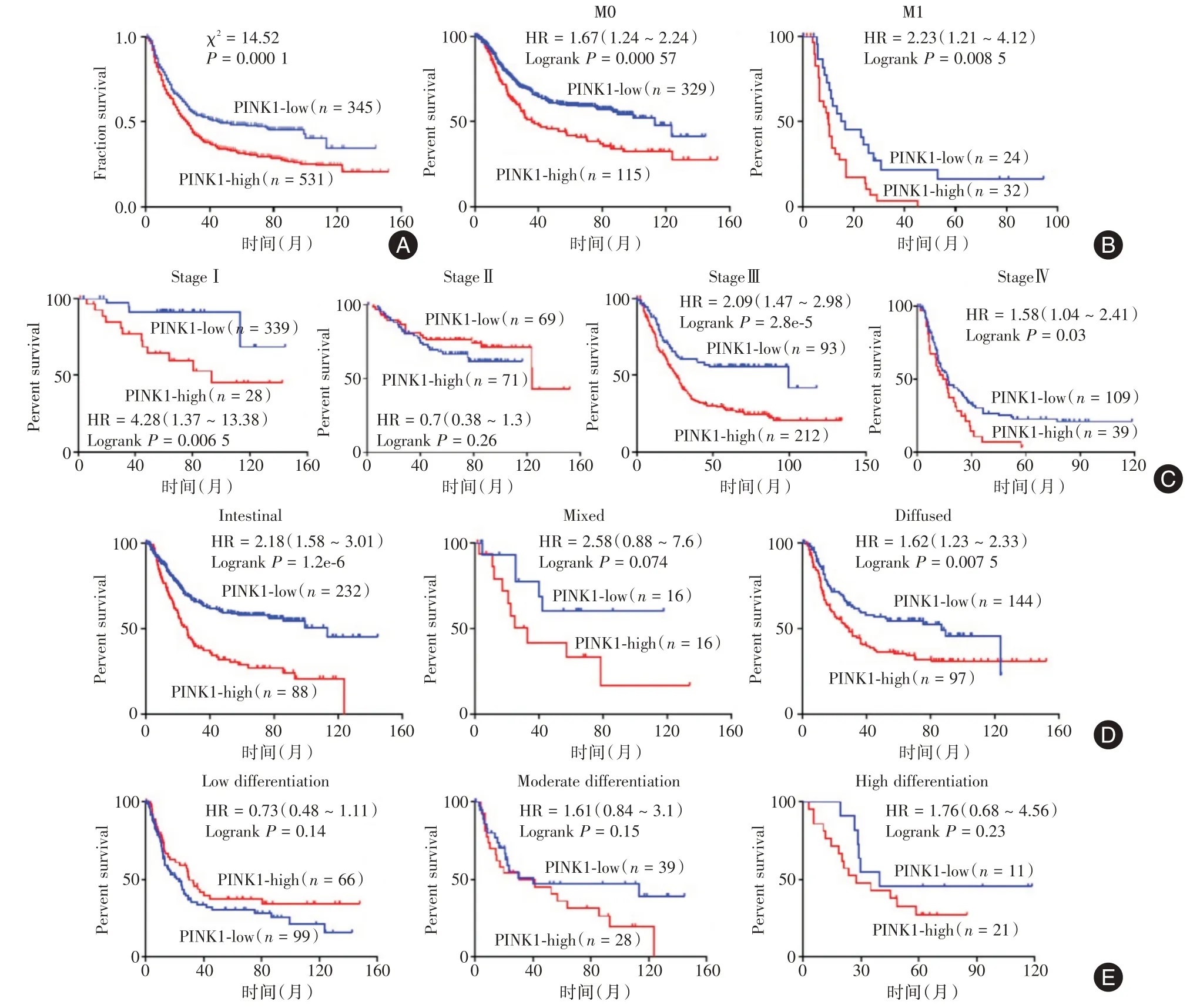
图1 KM⁃Plotter 数据库分析提示PINK1 表达与胃癌患者不良预后相关Fig.1 KM⁃Plotter data analysis indicate that PINK1 is associated with adverse prognosis of gastric cancer patients

表4 PINK1 预测胃癌患者预后及化疗疗效分析Tab.4 PINK1 predicts the prognosis of patients with gastric cancer and the efficacy of chemotherapy

图2 KM⁃Plotter 数据库分析提示PINK1 表达与HER2 表达及5⁃Fu 化疗疗效相关Fig.2 KM⁃Plotter data analysis indicate that PINK1 is associated with HER2 expression and 5⁃Fu chemotherapy effect of gastric cancer patients
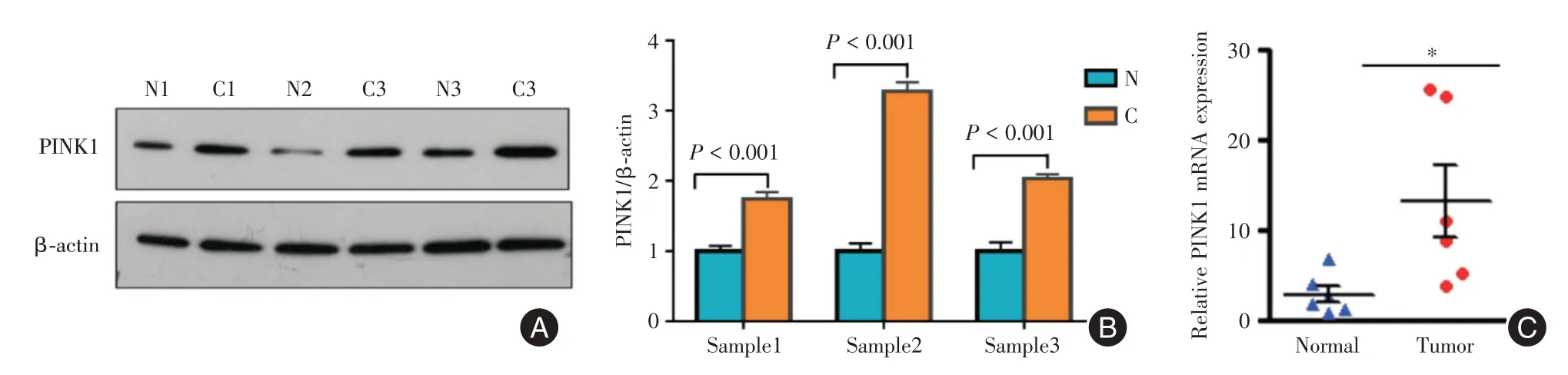
图3 PINK1 在胃癌组织中基因水平和蛋白水平均显著高表达Fig.3 PINK1 is significantly high⁃expressed on gene level and protein level in gastric cancer tissue

图4 临床资料分析显示PINK1 在胃癌中高表达并与患者不良预后相关Fig.4 Clinical data analysis indicate that PINK1 is highly⁃expressed in gastric cancer tissue and correlated to adverse prognosis

图5 PINK1 预测胃癌患者预后及5⁃Fu 辅助化疗疗效的ROC 曲线Fig.5 ROC curves of PINK1 predicting prognosis and 5⁃Fu chemotherapy efficacy
在既往的研究中,PINK1 除了在肿瘤的发生发展中起到一定作用外,与肿瘤药物治疗敏感性相关也有基础研究结果支持[14-15]。临床数据分析显示食管癌患者中PINK1 蛋白高表达与氟尿嘧啶为基础的化疗疗效不佳相关,体外细胞实验也证实PINK1 与食管癌细胞对氟尿嘧啶化疗药物抵抗相关,而抑制线粒体自噬或敲低PINK1可增加食管癌细胞对氟尿嘧啶的化疗敏感性[16]。此外,在非小细胞肺癌中,PINK 通过参与调控NF⁃κB 信号通路,促进肿瘤细胞增殖;而敲低PINK1 则可增加顺铂诱导的细胞凋亡[17]。本研究显示,PINK1 高表达的患者,在接受氟尿嘧啶为基础的辅助化疗后,其生存期反而较低表达患者显著延长,提示PINK1 高表达胃癌患者可能是对氟尿嘧啶治疗敏感的优势人群。对于PINK1 表达与接受氟尿嘧啶辅助治疗患者疗效相关的潜在分子机制,笔者推测可能为PINK1 在胃癌细胞中参与调控氟尿嘧啶药物敏感性。对于接受其他辅助治疗的人群,PINK1 表达量与预后无关,其潜在机制有待进一步研究。
本研究在验证PINK1 在胃癌中高表达且与患者预后不良密切相关后,进一步运用ROC 曲线分析PINK1 在预测胃癌患者预后及化疗疗效中的作用。结果发现,在预测胃癌患者预后方面,当PINK1 免疫组化评分为4.50 时,AUC 为0.772,预后不良的敏感性是69.2%,特异性是76.0%;在预测胃癌患者5⁃Fu 辅助化疗疗效方面,当PINK1 免疫组化评分为5.50 时,AUC 为0.735,疗效良好的敏感性是60.0%,特异性是76.9%。结果表明,PINK1 高表达可在一定程度上预测胃癌患者不良预后和5⁃Fu 辅助化疗疗效,但敏感性及特异性等预测效能相关指标数据不理想。
综上,本研究通过数据库数据分析、临床资料验证等手段首次发现PINK1 在胃癌组织中高表达,其表达量与肿瘤浸润深度、肿瘤淋巴结转移情况及肿瘤病理分级呈正相关;与此同时,生存分析显示,PINK1 低表达患者,无论分期、转移、病理分级情况如何,其生存期均显著延长,并通过临床资料分析在方法学上初步探讨PINK1 对胃癌预后及化疗疗效的预测价值,验证PINK1 在胃癌中高表达,且对胃癌患者预后及化疗疗效有一定的预测作用。然而,本研究结果亦发现PINK1 高表达此单一指标对胃癌患者预后的预测效能不高。目前研究表明单个指标预测效能远远低于多个指标联合的预测效能,国内外有关肿瘤研究已经积累了大量的包括基因组,转录组,表观组等多组学数据,以及相关临床影像和病理信息等数据,未来需要通过集成、整合、分析不同来源、不同层次的相关数据,进一步构建胃癌模型以达到精准的预测效果。
