TRPM2基因敲除通过调控GSK3β改善脂多糖诱导小鼠抑郁样行为
2021-06-05张占琴王辉蒋永泼
张占琴 王辉 蒋永泼
西安交通大学第一附属医院1麻醉手术部&脑科学中心,2疼痛科(西安710061);3浙江大学台州医院重症医学科(浙江台州317000)
抑郁症是一种以对事物失去兴趣或愉快感,持续性情绪低落或悲观等为主要临床特征的精神障碍性疾病[1]。临床上目前常用的抗抑郁药物多通过抑制去甲肾上腺素转运体功能和5⁃羟色胺(5⁃HT)再摄取来改善抑郁症状,然而当前的抗抑郁药物存在起效慢、有效率低、停药易复发等缺点[2]。越来越多的证据表明炎症反应与抑郁的发病密切相关,促炎细胞因子肿瘤坏死因子⁃α(TNF⁃α)、白细胞介素⁃6(IL⁃6)和白细胞介素⁃1β(IL⁃1β)在抑郁症过程中发挥关键作用[3],抑郁症患者外周血促炎因子TNF⁃α、IL⁃6 和IL⁃1β明显升高[4]。另外,约30%左右的脓毒症存活者表现出不同程度的抑郁样症状,严重影响患者的生活质量[5]。瞬时受体电位通道M2(transient receptor potential melastatin 2,TRPM2)是细胞膜上的一种多功能钙离子通透性的非选择性阳离子通道,在中枢神经系统免疫细胞中高表达[6]。生理状态下,TRPM2优先定位于中枢神经系统的小胶质细胞,在星形胶质细胞中较弱表达[7]。它同时又具有ADP 核糖及NAD 结合位点,能够被H2O2及TNF⁃α调控,是体内氧化应激敏感的Ca2+通道[6]。研究发现缺血缺氧损害可以通过激活细胞膜上的TRPM2 通道介导Ca2+的出入胞活动,引起钙超载和细胞凋亡,阻断TRPM2 通道可显著降低细胞凋亡[8]。胶质细胞激活及其介导的神经炎症反应参与脓毒症介导的小鼠抑郁样行为[9],然而目前关于TRPM2是否在脂多糖(lipopolysaccharide,LPS)在诱导小鼠抑郁样行为中的作用及其机制均不明确。本研究通过观察TRPM2基因敲除(TRPM2-/-)对LPS诱导小鼠抑郁样行为的影响,以期为其相关临床应用提供新思路。
1 材料与方法
1.1 实验动物及模型制备雄性C57 小鼠为背景的野生型和TRPM2-/-小鼠饲养于无病原体、12 h 光照循环(8:00 ~20:00)、室温(24±2)℃的动物房,整个动物实验遵从西安交通大学实验动物伦理委员会要求进行。6 ~8 周龄(体质量20 ~25 g)的雄性WT 和TRPM2-/-小鼠共分为野生小鼠对照组(WT)、野生小鼠模型组(WT+LPS)、TRPM2-/-小鼠对照组(TRPM2-/-)和TRPM2-/-小鼠模型组(TRPM2-/-+LPS)四组。其中将60 只TRPM2-/-小鼠,分为TRPM2-/-组和TRPM2-/-+LPS组各30只;另取60只同基因型背景的野生型小鼠,分为WT 组和WT+LPS组各30 只。模型组腹腔注射0.83 mg/kg LPS[10],对照组腹腔注射等量体积的生理盐水。参照文献报道,4 组小鼠造模后24 h 观察行为学(悬尾实验和强迫游泳实验)[10-12],随后处死所有小鼠进行ELISA、免疫荧光和Western blot 等检测。
1.2 主要试剂LPS(血清型:0127:B8,美国Sigma公司);5⁃HT 检测试剂盒(美 国Abcam 公司);TNF⁃α和IL⁃1β酶联免疫吸附(Elisa)试剂盒(欣博盛生物科技有限公司);Iba⁃1、GFAP、NeuN、t⁃GSK⁃3β和GAPDH 抗体(武汉三鹰生物技术有限公司);p⁃GSK⁃3β(美 国cell signaling technology 公司);BCA蛋白浓度测定试剂盒及ECL 发光试剂盒(美国Thermo 公司);荧光二抗(西安壮志生物有限公司);DAPI 和RIPA 裂解液(上海碧云天生物技术有限公司)。
1.3 实验方法
1.3.1 5⁃HT 含量测定处死小鼠后冰上取出脑组织,分离海马和前额叶皮层。按照5⁃HT 检测试剂盒的操作步骤,检测小鼠海马和前额叶皮层5⁃HT的含量。
1.3.2 免疫荧光染色甲醛灌注及固定脑组织后依次用含20%和30%蔗糖的PB 溶液沉底。冰冻切片机进行冠状切片,厚度为6 μm。5 % BSA 室温封闭2 h 后,分别用Iba⁃1(1∶100)、GFAP(1∶200)和NeuN(1∶200)抗体孵育18 h。然后用相应的荧光二抗避光孵育2 h,DAPI(1∶300)核染色5 min。正置显微镜下拍照观察,Image J 软件统计每张脑片Iba⁃1、GFAP 和NeuN 阳性细胞数。
1.3.3 ELISA 法测定海马组织TNF⁃α和IL⁃1β的含量处死小鼠后分离海马组织并加入预冷的PBS,匀浆、4 ℃、8 000×g离心10 min,取上清。按照TNF⁃α和IL⁃1β检测试剂盒的操作步骤,检测小鼠海马TNF⁃α和IL⁃1β的含量。
1.3.4 Western blot检测采用RIPA 裂解液(10 mL/g)、广谱磷酸酶抑制剂(1∶100)和PMSF(1∶100)提取海马组织的总蛋白,冰上超声破碎以及重新裂解后,4 ℃、13 000×g离心10 min,取上清行BCA蛋白定量。按照每孔60 μg 上样量进行SDS⁃PAGE电泳,电泳结束后将蛋白转移至PVDF膜上。加入一抗p⁃GSK⁃3β(1∶1 000)、t⁃GSK⁃3β(1∶1 000)和GAPDH(1∶3 000)后4 ℃过夜后,加入相应的二抗羊抗兔(1∶10 000)或羊抗鼠(1∶5 000)室温孵育1 h,ECL 显影,Bio⁃Rad 凝胶成像系统采集图像并进行灰度值分析。
1.3.5 悬尾实验固定小鼠尾部1 cm 处,将小鼠悬挂于30 cm 的观察箱中,保持小鼠鼻尖距地面约20 ~25 cm。记录6 min 内小鼠的不动时间,并计算不动时间百分比。
1.3.6 强迫游泳实验将小鼠置于高20 cm,直径12 cm,水深10 cm 的圆柱形透明缸中,水温(24 ±2)℃。摄像机采集6 min,记录后4 min 内累计不动时间。
1.4 统计学方法计量资料以均数±标准差表示,使用SPSS 20.0 软件进行分析。多组间均数比较采用单因素方差分析,两两比较方差齐性采用t检验,方差不齐采用非参数秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 TRPM2 基因敲除对LPS 模型前额叶皮层和海马5⁃HT 含量的影响与WT 组比较,TRPM2-/-组小鼠前额叶皮层和海马5⁃HT 含量无明显差异,WT+LPS 组小鼠前额叶皮层和海马5⁃HT 含量显著降低(P<0.01);与WT+LPS 组比较,TRPM2-/-+LPS组小鼠前额叶皮层5⁃HT 含量无明显差异,而海马5⁃HT 含量显著升高。见表1。
2.2 神经元和胶质细胞标志物表达变化与WT组比较,TRPM2-/-组小鼠海马GFAP、Iba⁃1 和NeuN 阳性细胞数无明显差异,WT+LPS 组小鼠海马GFAP和Iba⁃1 阳性细胞数增多(P<0.05),而NeuN 阳性细胞数无明显差异;与WT+LPS 组比较,TRPM2-/-+LPS组小鼠海马GFAP和Iba⁃1阳性细胞数明显减少(P<0.05),而NeuN 阳性细胞数差异无统计学意义。见图1、表2。
表1 四组小鼠前额叶皮层和海马5⁃HT 含量Tab.1 5⁃HT expressions of hippocampus and prefrontal cortex tissues in 4 groups of mice±s,ng/g
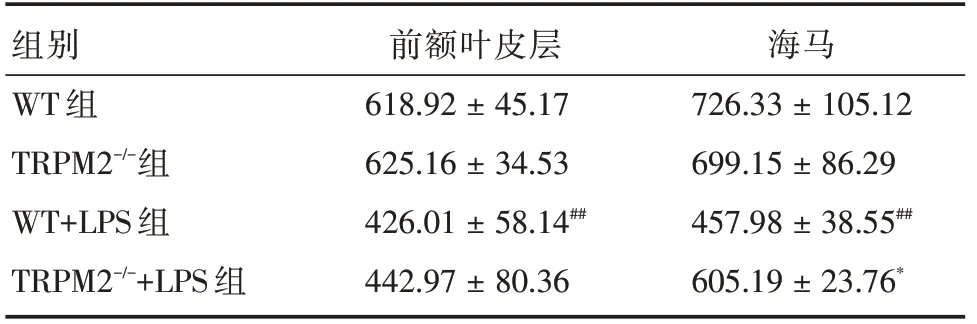
表1 四组小鼠前额叶皮层和海马5⁃HT 含量Tab.1 5⁃HT expressions of hippocampus and prefrontal cortex tissues in 4 groups of mice±s,ng/g
注:与WT 组比较,##P <0.01;与WT+LPS 组比较,*P <0.05
组别 前额叶皮层 海马WT 组618.92±45.17726.33±105.12 TRPM2-/-组625.16±34.53699.15±86.29 WT+LPS 组TRPM2-/-+LPS 组426.01±58.14##442.97±80.36 457.98±38.55##605.19±23.76*
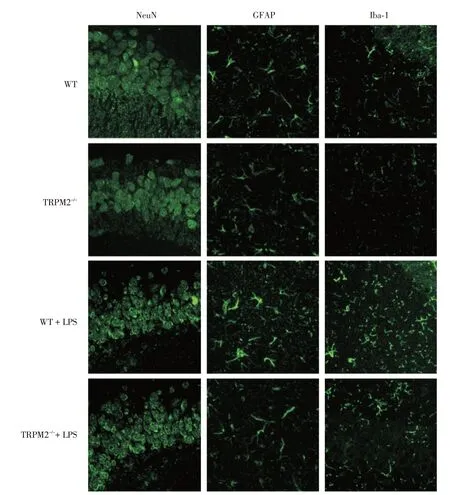
图1 四组小鼠海马CA3 区神经元和胶质细胞标志物表达变化情况Fig.1 Changes of neuronal and glial cell markers of hippocampal CA3 region in 4 groups of mice
2.3 TRPM2 基因敲除对LPS 模型海马TNF⁃α和IL⁃1β水平的影响与WT 组比较,TRPM2-/-组小鼠海马TNF⁃α和IL⁃1β水平无明显差异,WT+LPS 组小鼠海马TNF⁃α和IL⁃1β水平显著升高(P<0.05);与WT+LPS 组比较,TRPM2-/-+LPS 组小鼠海马TNF⁃α和IL⁃1β水平显著降低(P<0.05)。见表3。
2.4 TRPM2基因敲除对LPS 模型海马p⁃GSK⁃3β和t⁃GSK⁃3β蛋白表达的影响Western blot 检测结果显示,四组小鼠海马组织的t⁃GSK⁃3β的相对蛋白表达水平差异无统计学意义,但WT+LPS 组小鼠海马组织p⁃GSK⁃3β的相对表达与WT 组比较明显下降。而TRPM2-/-+LPS 组小鼠海马p⁃GSK⁃3β的相对表达水平较WT+LPS 组升高。见图2、表4。
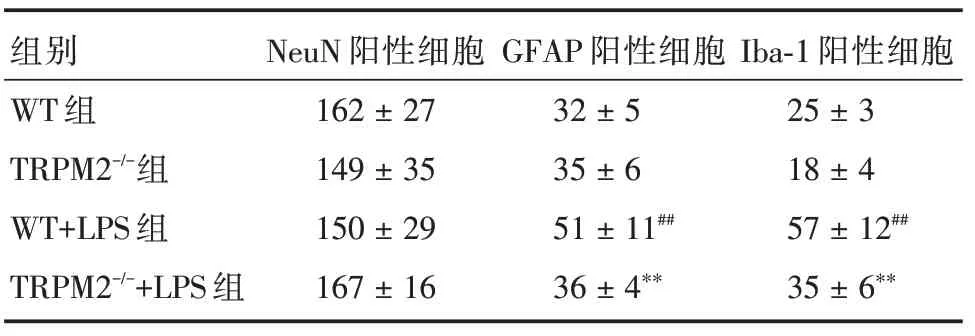
表2 四组小鼠海马神经元和胶质细胞阳性细胞数(40×)Tab.2 The number of NeuN,GFAP and Iba⁃1 positive cells of hippocampus in 4 groups of mice(40×)
表3 四组小鼠海马TNF⁃α和IL⁃1β含量Tab.3 TNF⁃α and IL⁃1β contents of hippocampus in 4 groups of mice ±s
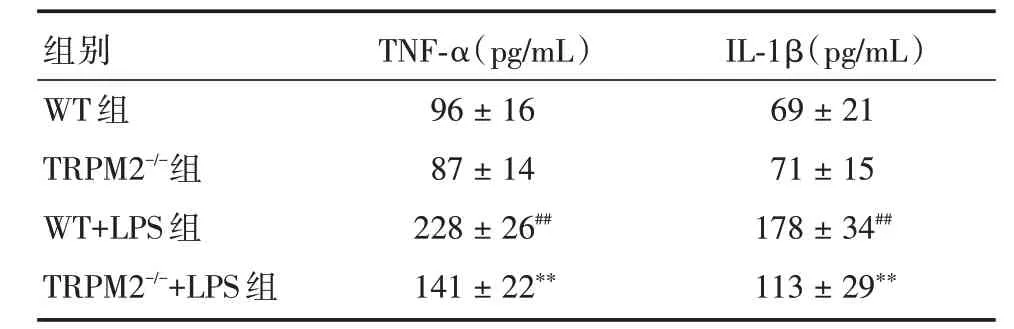
表3 四组小鼠海马TNF⁃α和IL⁃1β含量Tab.3 TNF⁃α and IL⁃1β contents of hippocampus in 4 groups of mice ±s
注:与WT 组比较,##P <0.01;与WT+LPS 组比较,**P <0.01
组别WT 组TRPM2-/-组WT+LPS 组TRPM2-/-+LPS 组TNF⁃α(pg/mL)96±16 87±14 228±26##141±22**IL⁃1β(pg/mL)69±21 71±15 178±34##113±29**
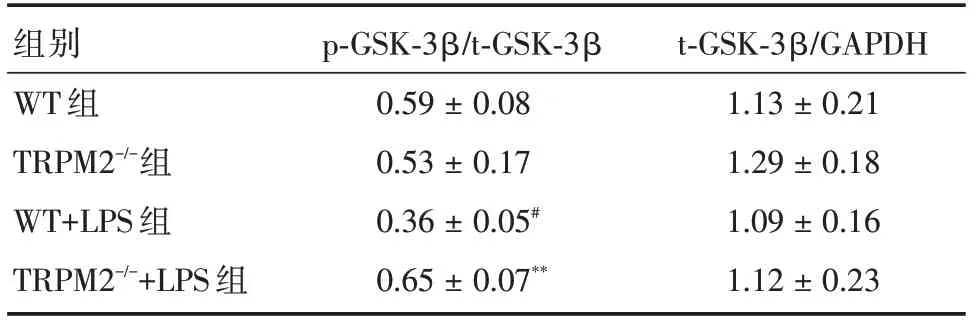
表4 四组小鼠海马区p⁃GSK⁃3β和t⁃GSK⁃3β表达的相对光密度值Tab.4 Relative optical density value of hippocampal p⁃GSK⁃3β and t⁃GSK⁃3β expressions in 4 groups of mice x±s
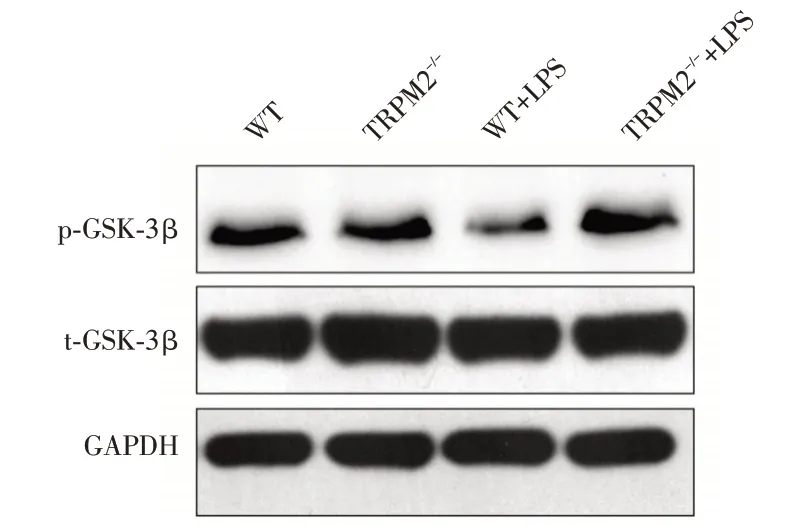
图2 四组小鼠海马区p⁃GSK⁃3β、t⁃GSK⁃3β和GAPDH 的电泳条带图Fig.2 p⁃GSK⁃3β,t⁃GSK⁃3β and GAPDH expressions of hippocampal tissues in 4 groups of mice
2.5 TRPM2基因敲除改善LPS诱导的小鼠抑郁样行为与WT组比较,TRPM2-/-组小鼠在悬尾和强迫游泳实验中的不动时间差异无统计学意义,WT+LPS 组小鼠在2 个实验中不动时间显著延长(P<0.05);与WT+LPS 组比较,TRPM2-/-+LPS 组小鼠在2 个实验中不动时间显著缩短(P<0.05)。见表5。
表5 四组小鼠在悬尾和强迫游泳实验中的不动时间Tab.5 The mobility time of tail suspension test and forced swim test in 4 groups of mice ±s,s
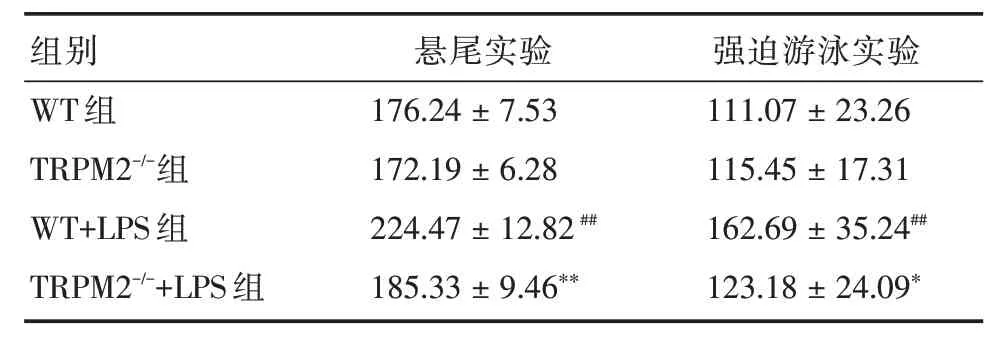
表5 四组小鼠在悬尾和强迫游泳实验中的不动时间Tab.5 The mobility time of tail suspension test and forced swim test in 4 groups of mice ±s,s
注:与WT 组比较,##P <0.01;与WT+LPS 组比较,*P <0.05,**P <0.01
组别WT 组TRPM2-/-组WT+LPS 组TRPM2-/-+LPS 组悬尾实验176.24±7.53 172.19±6.28 224.47±12.82##185.33±9.46**强迫游泳实验111.07±23.26 115.45±17.31 162.69±35.24##123.18±24.09*
3 讨论
抑郁症的病因和发病机制目前尚不清楚,研究发现抑郁症患者外周血炎性细胞因子浓度升高[4],各种动物抑郁模型显示脑内炎症因子表达升高[13],说明抑郁的发病与炎症的发生密切相关。TRPM2 是一种非选择性的钙离子通道,广泛表达于脑内的免疫细胞上。近年来发现TRPM2 基因敲除对神经系统疾病如阿尔茨海默病、癫痫及缺血性脑血管病均具有良好的保护作用,其机制可能与其抗炎、抗氧化和抗凋亡等作用有关[14]。本研究结果显示,TRPM2 基因敲除显著逆转LPS 诱导的海马5⁃HT 含量降低和不动时间延长,同时海马异常升高的炎症细胞因子TNF⁃α和IL⁃1β水平也明显下降,说明TRPM2 基因敲除能够改善LPS 诱导的小鼠抑郁样行为,而且这种作用可能和降低海马炎症反应有关。
LPS 是一种常用的促炎内毒素,可触发小胶质细胞激活,诱导免疫激活和行为改变,类似于人类抑郁的临床症状[15],因此常经小鼠中枢或者外周给予LPS 诱导抑郁动物模型。研究证实LPS 诱导的抑郁行为包括悬尾和强迫游泳实验不动时间增加[10],这与本研究结果一致。LPS 引起的小鼠病态行为(竖毛、眼睑下垂和嗜睡等)通常在给药后6 h 达峰值时进行测量,24 h 后小鼠自主活动便可恢复正常,此时LPS 诱导的抑郁样行为可与LPS 诱导的病态行为分离[16],对抑郁样行为的观察多在24 h 这一时间点进行[10]。在本实验中,0.83 mg/kg LPS 腹腔注射24 h 后,小鼠自发活动恢复正常,强迫游泳实验中不动时间增多,与既往文献报道一致[10]。先前的研究证实外周LPS 刺激诱导产生的炎性细胞因子能激活吲哚胺2,3-双加氧酶(indole⁃amine2,3⁃dioxygenase,IDO),引起色氨酸代谢异常,最终导致5⁃HT 合成水平下降,并出现抑郁样行为[17],给予小胶质细胞删除剂米诺环素后可间接阻断IDO 激活,阻止抑郁症的发展[18]。炎性细胞因子可直接或/和间接损伤神经细胞,导致额叶皮层、海马、杏仁核和基底核等与情绪有关脑区的神经细胞功能受损[19]。本研究结果显示LPS 诱导小鼠海马和前额叶皮层5⁃HT 含量显著降低,而TNF⁃α和IL⁃1β水平升高,并出现抑郁样行为,进一步说明炎症反应在抑郁症发病中发挥重要作用。
在新生儿缺血缺氧性脑损伤模型中,TRPM2基因敲除可以降低星形胶质细胞和小胶质细胞激活,其机制可能与促进GSK3β磷酸化有关[8]。本研究在LPS 模型中证实了TRPM2 基因敲除可以减轻小鼠抑郁样行为,同时与抑郁发病密切相关的脑区海马的TNF⁃α和IL⁃1β水平明显下降,进一步揭示了TRPM2 基因敲除改善抑郁样行为可能和降低脑内炎症反应程度有关。GSK3β的活性受到5⁃HT 信号的影响,GSK3 是5⁃HT1B 受体调控的Giα信号的功能选择性调制器,刺激5⁃HT1 和5⁃HT7 激活PI3K/AKT 通路,增加GSK3β的磷酸化[20-21]。细胞中GSK3β的活性和表达受到神经递质、神经调质和神经营养因子等的调节,这其中有许多被作为抗抑郁的靶标,GSK3β蛋白激酶活性异常、表达改变和基因多态性与重度抑郁症的发病机制、发病年龄和严重程度相关[22]。然而,GSK3β活性增强是情绪障碍的因还是果,仍需进一步的研究来充分阐明。脑内过度的氧化应激也是导致抑郁的原因[23],TRPM2 介导ROS 依赖的NLRP3 炎性体激活,TRPM2 基因敲除可以降低脑内氧化应激程度[6]。
综上所述,TRPM2 基因敲除可以改善LPS 诱导的小鼠抑郁样行为,可能与上调海马p⁃GSK3β的蛋白表达有关,但确切的抗抑郁机制有待进一步研究。因此,仍需深入研究TRPM2 与GSK3β的联系以及TRPM2 在抑郁等情绪调控中的作用,为抑郁症的发病机制和治疗提供新途径。
