G蛋白偶联雌激素受体通过减轻大鼠肾小管上皮细胞凋亡保护肾脏缺血再灌注损伤
2021-06-05闫林轩梅霄阳章林明常越辰马克涛李丽王勤章李应龙
闫林轩 梅霄阳 章林明 常越辰 马克涛 李丽 王勤章 李应龙,3
1石河子大学医学院(新疆石河子832000);2石河子大学医学院第一附属医院(新疆石河子832000);3成都中医药大学附属第五人民医院(成都610000)
肾脏缺血再灌注损伤(renal ischemia⁃reperfu⁃ sion injury,RIRI)是泌尿外科临床工作中常见的病理过程。RIRI 会造成肾小管上皮细胞极性丧失及离子进出胞膜功能障碍,细胞与细胞以及和细胞基质的粘附能力降低,细胞凋亡程序的启动,最终导致肾小管上皮细胞脱落凋亡[1],严重影响肾功能。肾小管上皮细胞的凋亡是RIRI 的显著特征,如何在RIRI 中减少肾小管上皮细胞凋亡具有重要的临床意义。药物预处理已成为其损伤预防和治疗的关键切入点[2]。本课题组前期研究及相关文献报道显示,雌激素可通过抗凋亡、抑制炎症反应、调节细胞免疫平衡及动脉舒缩功能等对RIRI 起到保护作用[3-6]。如何有效提高雌激素作用的靶向性,避免雌激素的特殊性质[7]将成为研究的重点。GPER 是近年来发现的雌激素的一种G 蛋白耦联受体[8],这类受体定位于细胞膜上,可发挥雌激素的快速非基因组效应[9]。有研究[10-12]表明GPER 可通过减轻细胞凋亡来发挥对心肌、脑、小肠等I/R损伤后的保护作用。因此,本研究通过建立OVX 大鼠肾脏I/R损伤模型来研究GPER 对RIRI 后肾小管上皮细胞凋亡的影响,探讨其相关机制,为今后临床治疗RIRI 提供新的视角。
1 材料与方法
1.1 实验材料选取SPF 级雌性Sprague⁃Dawley(SD)大鼠(10 ~12 周龄,220 ~280 g)32 只,从新疆医科大学动物中心获得(许可证编号SCXK 新2018⁃0001)。经石河子大学医学院动物管理和使用委员会(IACUC)批准(A2046⁃047⁃02)。购进SD大鼠后适应性饲养1 周,动物房控制温度在24 ~28 ℃和湿度45% ~55%,给予标准化饲养,水和食物均可自由获得。
1.2 主要试剂与仪器GPER 受体特异性激动剂G1、特异性阻断剂G15(ApexBio,美国),兔抗Bcl⁃2、Caspase⁃3 抗体(Abcam,美国),小鼠抗GAPDH、山羊抗兔/小鼠抗体(北京中杉金桥),全自动生化分析仪(瑞士Roche 公司),低温高速离心机(德国Eppendorf 公司),DYY⁃6D 型电泳仪(北京六一生物科技有限公司)。
1.3 方法
1.3.1 雌性去卵巢(OVX)模型和I/R模型的制备将雌性SD 大鼠禁食水后腹腔注射3%戊巴比妥钠(50 mg/kg)麻醉,切除双侧卵巢。自术后14 d,按照随机数字表法分为4 组,每组8 只。(1)OVX 组;(2)缺血再灌注损伤(OVX+I/R)组;(3)G1 干预(OVX+I/R+G1)组;(4)G15 阻断剂(OVX+I/R+G15+G1)组。经腹腔注射给予G1 干预(120 μg/kg·d),连续3 d;G15 阻断剂(300 μg/kg·d),30 min 后给予腹腔注射G1 干预(120 μg/kg·d),连续3 d;其余两组给予等量DMSO[13-14]。再次麻醉后切除右肾,分离左肾动脉并用无创动脉夹夹闭,观察肾脏颜色逐渐变为暗红色,说明缺血成功,45 min 后去除无创动脉夹,恢复肾脏灌流,再灌注24 h。
1.3.2 血肌酐(SCr)、血尿素氮(BUN)、乳酸脱氢酶(LDH)的检测再灌注24 h 后,各组大鼠行腹主动脉采全血,低温高速离心机4 000 r/min 离心10 min,取上清测定SCr、BUN、LDH,评价各组大鼠肾功能。
1.3.3 HE 染色和Paller 评分取左肾常规石蜡包埋,HE 染色,200 倍光镜下观察肾脏组织病理形态的改变。并由两名专业的病理科医师对其进行Paller 评分[15]。400 倍镜下,随机选取肾皮髓交界区10 个连续的视野,每高倍镜视野随机选取10 个肾小管,按100 个肾小管记分。标准:肾小管上皮细胞形态改变1 分,刷状缘损伤1 分,刷状缘脱落2 分,管型2 分,管腔内有脱落坏死的细胞(未成管型或细胞碎片)1 分,管径变形增宽明显1 分[16]。
1.3.4 免疫组化检测各组大鼠Bcl⁃2、Caspase⁃3 蛋白的表达制备4 μm 厚石蜡切片,二甲苯、乙醇梯度脱蜡水化,蒸馏水清洗3 次,行抗原修复后用PBS 漂洗3 次,加入一抗4 ℃孵育过夜,复温后加入二抗,DAB 染色,在显微镜下观察。
1.3.5 Western blot 法检测肾脏组织凋亡相关蛋白表达水平提取肾脏组织总蛋白,BCA 法测定蛋白浓度后于SDS⁃聚丙烯酰胺凝胶进行电泳,湿转至PVDF 膜,室温封闭2 h。TBST 漂洗后滴加一抗(抗Bcl⁃2、Caspase⁃3 和抗GAPDH 抗体均以1∶1 000稀释),摇床上4 ℃孵育过夜。TBST 洗膜,加入二抗(二抗均以1∶10 000 稀释)室温孵育2 h,暗室曝光。测定蛋白条带灰度值,以GAPDH 蛋白为内参,计算凋亡相关蛋白的相对表达量。
1.4 统计学方法采用SPSS 21.0 软件对数据进行统计学分析。以均数±标准差表示,若服从正态分布,多组间比较采用单因素方差分析;两两比较采用t检验;若方差不齐,则采用t′检验。P<0.05认为差异有统计学意义。
2 结果
2.1 肾功能检测结果与OVX 组相比,OVX+I/R组的SCr、BUN 和LDH 水平显著升高(P<0.01)。G1 干预组较OVX+I/R 组明显降低(P<0.01)。G15阻断剂组均高于G1 干预组(P<0.01)。见图1。
2.2 肾组织HE 染色及Paller 评分HE 染色200倍光镜下观察,与OVX 组相比,OVX+I/R 组肾小管显著扩张其形态也发生改变,部分肾小管结构不清,上皮细胞水肿且核脱落明显,有管腔阻塞及管型的出现,刷状缘损伤脱落。G1干预后可见肾小管轻度扩张,细胞形态较I/R 组坏死脱落减少。G15阻断剂组逆转了G1 激动GPER 后的保护作用。Paller 评分显示与OVX 组相比,OVX+I/R 组肾小管结构损伤严重[(44.38 ± 3.46)vs.(9.63 ± 2.33),P<0.01],G1干预组比OVX+I/R组肾小管损害明显减轻[(30.38±3.67)vs.(44.38±3.46),P<0.01],阻断剂组可部分逆转G1 激活GPER 后的作用[(38.00±3.21)vs.(30.38±3.67),P<0.01]。见图2。
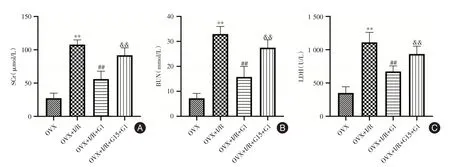
图1 各组大鼠SCr(A),BUN(B)和LDH(C)的水平Fig.1 The levels of SCr(A),BUN(B)and LDH(C)in rats from each group
2.3 Bcl⁃2、Caspase⁃3 蛋白在大鼠肾脏上的表达免疫组化结果显示Bcl⁃2 蛋白主要分布于肾小管上皮细胞胞膜上,胞浆内有少量分布,阳性表达呈棕褐色。Caspase⁃3 蛋白表达主要分布于肾小管上皮细胞胞浆内,阳性表达呈棕褐色,与OVX 组相比,OVX+I/R 组Bcl⁃2 蛋白阳性表达减少,而Cas⁃pase⁃3 蛋白阳性表达明显增加;G1 干预组较OVX+I/R 组Bcl⁃2 蛋白阳性表达明显增加,Caspase⁃3 蛋白阳性表达减少;同时阻断剂能够逆转这种状况。见图3。
2.4 凋亡相关蛋白Bcl⁃2、Cleaved Caspase⁃3 的表达比较OVX+I/R 组与OVX 组相比Bcl⁃2 蛋白的表达量降低(P<0.01),Cleaved Caspase⁃3 蛋白表达量则明显升高(P<0.01)。G1 干预组较OVX+I/R 组Bcl⁃2 蛋白的表达量升高(P<0.01),Cleaved Caspase⁃3 蛋白表达量降低(P<0.01)。G15 阻断剂组可部分逆转G1 的干预作用(P<0.01)。见图4。
3 讨论
RIRI 后会导致SCr、BUN 水平升高,甚至可造成急性肾小管坏死而发生肾小球滤过率急剧下降[17],最终导致肾功能障碍。本研究首先构建雌性SD 大鼠去卵巢模型,去卵巢两周后雌激素水平明显降低[18],排除内源性雌激素对实验的影响;构建I/R 损伤模型来观察GPER 在肾脏缺血再灌注损伤中产生的作用,结果发现OVX+I/R 组大鼠SCr、BUN 及LDH 水平显著升高,这都提示肾功能有明显损害。Paller 评分升高,肾小管上皮细胞凋亡明显,提示大鼠出现明显的肾组织损害,与既往研究一致[13,18-19]。G1 激活GPER 后,肾功能及肾组织损害均减轻,Bcl⁃2 蛋白的表达量上升,而Caspase⁃3蛋白表达量均下降。
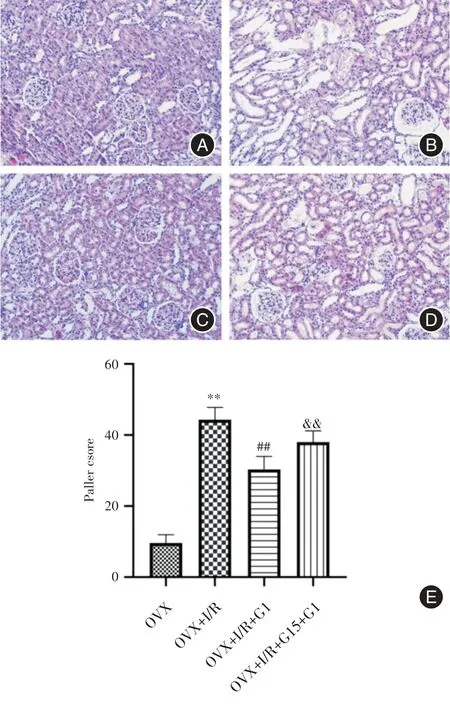
图2 各组大鼠肾组织病理学改变(HE 染色,×200)和Paller 评分Fig.2 Histopathological changes(HE staining,×200)and Paller score of rats in each group
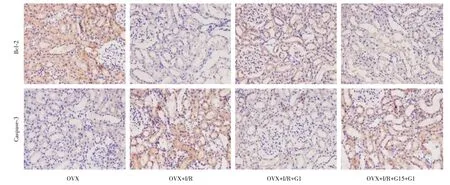
图3 免疫组化法检测各组大鼠肾组织Bcl⁃2 与Caspase⁃3 的表达(DAB,×200)Fig.3 The expression of Bcl⁃2 and Caspase⁃3 in kidney tissues of rats in each group was detected by immunohistochemistry(DAB,×200)
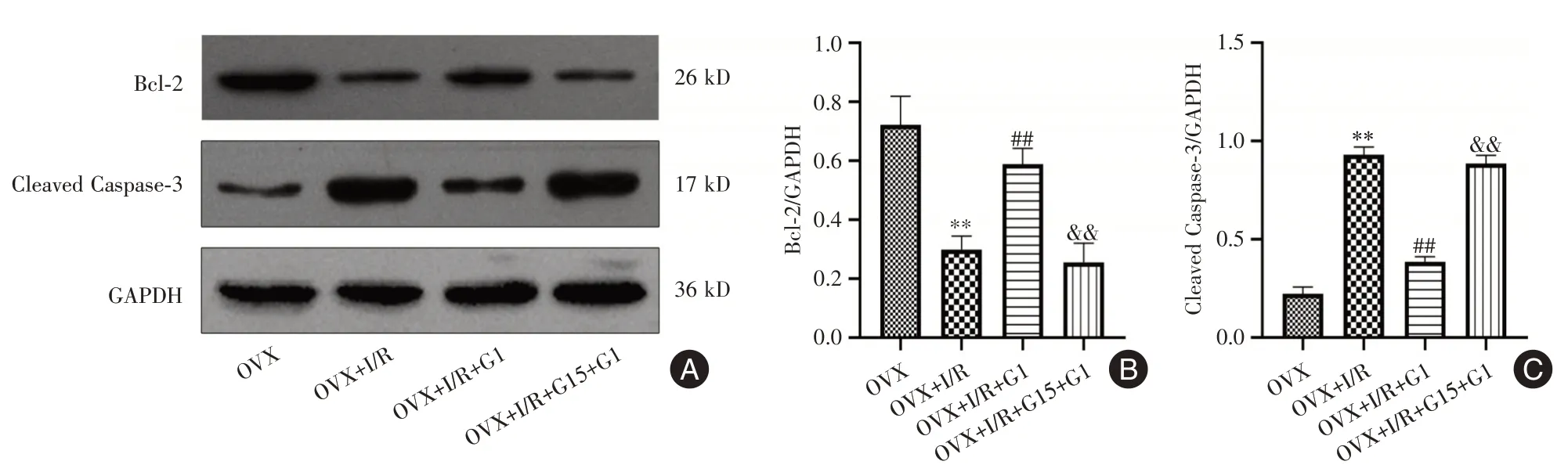
图4 各组大鼠肾组织Bcl⁃2 与Cleaved Caspase⁃3 蛋白表达的比较Fig.4 Comparison of Bcl⁃2 and Cleaved Caspase⁃3 protein expression in kidney tissue of rats in each group
RIRI 后细胞由于炎症、氧化应激、胞内钙的超载、NO 损伤、兴奋毒性等诸多因素[20],最终导致肾小管上皮细胞凋亡,而肾小管上皮细胞凋亡是急性肾损伤的重要机制之一。本研究结果显示,于肾脏缺血再灌注前连续3 d 给予GPER 激动剂G1干预,与OVX+I/R 组相比能够明显降低SCr、BUN及LDH 水平,改善了肾脏功能。肾脏HE 染色及Paller 评分结果显示,G1 激活GPER 后肾小管损伤减轻,肾小管上皮细胞核脱落减少,肾小管管型形成减少,Paller 评分降低,减轻OVX 大鼠肾脏组织损伤。且CHANG 等[13]研究显示G1 激活GPER 后可减轻OVX 大鼠肾脏I/R 后的损伤,与本研究结果相一致。这提示GPER 可减少肾脏缺血再灌注损伤后大鼠肾小管上皮细胞的凋亡。
GPER 的保护机制与凋亡相关蛋白的表达水平密切相关。RIRI 后肾小管上皮细胞凋亡是由多种凋亡相关基因参与的调控过程。在调控细胞凋亡的过程中,Bcl⁃2 蛋白[21]起重要作用,它是线粒体凋亡通路中的一种抗凋亡蛋白,它可以抑制线粒体释放细胞色素C、凋亡诱导因子(AIF),维持BAX/BAK 结构稳定性,阻止二聚化反应以及维持细胞钙稳态等作用。细胞凋亡主要有三条途径:死亡受体途径、线粒体途径以及内质网途径[22]。三条凋亡途径的最后通路都将经历Caspase 级联反应的发生以及Caspase⁃3 蛋白的表达,Caspase⁃3作为核心关键酶参与细胞凋亡级联反应,活化的Cleaved Caspase⁃3 的水解活性作用可直接诱导细胞凋亡,并能损伤DNA 加速细胞凋亡[23]。从免疫组化和Western blot 结果看,与OVX+I/R 组相比,在G1 激动GPER 后能够明显增加肾脏组织及肾小管上皮细胞中Bcl⁃2 蛋白表达,减少由I/R 损伤引起的Caspase⁃3 蛋白的表达。这提示肾脏I/R 损伤可导致肾小管上皮细胞凋亡,而GPER 可以通过增加Bcl⁃2 蛋白的表达,抑制Caspase⁃3 蛋白的表达来减轻细胞凋亡,与以往文献报道结果类似[24]。结合上文结果来看,GPER 发挥肾脏I/R 损伤的保护作用可能是通过抑制凋亡通路的激活来实现的。
综上所述,本研究证实了GPER 可以通过抑制肾小管上皮细胞凋亡减轻RIRI 后的肾损伤,进一步验证了G1 激活GPER 后对RIRI 的保护作用,为临床治疗RIRI 提供了新思路。但GPER 通过调控何种信号通路来抑制细胞凋亡尚不明确,其相关的分子机制还需要课题组进一步研究。
