全国7所儿童医院临床分离真菌耐药性监测
2021-05-31于文文王传清陈学军赵瑞珍杨锦红余建华张春艳寇琳娜王世富
于文文, 李 政, 王传清, 陈学军, 赵瑞珍, 杨锦红, 余建华, 高 巍, 李 静,张春艳, 寇琳娜, 王世富
近年来由于广谱抗生素、激素和免疫抑制剂的广泛应用,以及侵袭性治疗的增加,侵袭性真菌感染的发病率不断上升[1-2],其中常见致病真菌念珠菌属、隐球菌属和曲霉属感染的年发病率已经达到万分之一以上,侵袭性念珠菌感染的发生率已经升至医院感染的第4位[3-4]。随着抗真菌药物特别是唑类抗真菌药物如氟康唑、伊曲康唑、伏立康唑等在临床上的大量使用,真菌耐药现象日趋严重。真菌有高适应性特点,在体内形成生物被膜、转变成菌丝后可高度耐药,耐药性成为侵袭性真菌感染治疗失败的主要原因之一[5]。国内有关儿童真菌感染的菌株分布及耐药性的研究较少。本研究对全国的儿童感染性疾病病原学及细菌耐药监测协作 组(Infectious Disease Surveillance of Pediatric,ISPED)中7所医院2016—2018年分离的真菌进行了分离鉴定和耐药性监测分析,了解临床分离真菌谱的变化趋势,监测其对常用抗真菌药物的敏感率和耐药率,以引起临床医师对临床分离真菌及抗真菌药物合理应用的重视,为临床儿童侵袭性真菌感染的有效诊断、治疗提供理论和数据依据。
1 材料与方法
1.1 材料
1.1.1 菌株收集 本研究依托于ISPED中山东大学齐鲁儿童医院、复旦大学附属儿科医院、浙江大学医学院附属儿童医院、深圳市儿童医院、温州医学院附属育英儿童医院、西安市儿童医院、河南省开封市儿童医院7所三级甲等儿童教学医院,收集患儿无菌体液,包括血液、脑脊液的相关真菌数据资料。收集2016年1月1日—2018年12月 31日真菌330株,剔除同一患儿不同标本分离出的重复菌株后为199株。同一患儿不同时间同类标本,只对初次分离菌株进行分析。
1.1.2 试剂和仪器 沙氏葡萄糖蛋白胨琼脂平皿、真菌药敏接种肉汤、去离子水、0.5 麦氏浊度标准品、比浊仪、加样器均为Thermo Fisher公司商品,药敏板(ATB FUNGUS 3 板)由各参与单位购自法国生物梅里埃公司。
1.2 方法
1.2.1 菌株鉴定 严格按照《全国临床检验操作规程》(第4版)进行,分离的真菌菌株接种至科玛嘉显色培养基或沙堡弱真菌培养基,根据生长菌落的颜色,结合VITEK 2-Compact YST卡或质谱进行初步鉴定和复核。
1.2.2 药敏试验及判断标准 采用梅里埃酵母样真菌药敏试剂盒ATB FUNGUS 3微量稀释法,将待测酵母样真菌的悬浮液转移到培养基中,并接种到试条上。将药敏检测板在35℃真菌培养箱内孵育24~25 h,孵育后通过肉眼判读,或者应用ATB 仪器或 mini API(自动判读软件稍后提供)判读杯状凹中菌液的生长情况,及其抗真菌药物的最低抑菌浓度(MIC)。氟康唑、伊曲康唑、伏立康唑和5-氟胞嘧啶药敏参照2017年美国临床和实验室标准化协会(CLSI)M60-S1文件[6]和2020年欧洲共同体药敏试验委员会(EUCAST)10.0标准[7],流行病学界值(epidemiological cutoff value,ECV)参照CLSI M59-S2等折点的标准判断[8-10]。各参与单位真菌药敏结果复核采用E试验法:氟康唑、伏立康唑、氟胞嘧啶、伊曲康唑(安图生物公司),质控菌株为近平滑念珠菌 ATCC 22019和克柔念珠菌ATCC 6258。
1.2.3 统计学分析 采用WHONET 5.6统计分析软件进行比较分析。采用SPSS 22.0版对数据进行统计学分析。P<0.05为差异有统计学意义。
2 结果
2.1 菌株分布
纳入研究的199株临床分离真菌,其中血液标本占比97.0%(193份)、脑脊液占3.0%(6份)。来自男孩110株,女孩89株,男孩略多于女孩,但菌种构成差异不大。年龄分布为1 d~15岁,中位年龄1.6岁。菌株主要来自于重症医学科(62株)、新生儿科(43株)、血液肿瘤科(15株)等。前三位的真菌为近平滑念珠菌36.2%(72株)、白念珠菌28.1%(56株)、热带念珠菌13.6%(27株),光滑念珠菌4.0%(8株),新型隐球菌2.5%(5株)。见表1。
2.2 药敏试验
近平滑念珠菌对氟康唑、伏立康唑、伊曲康唑的敏感率分别为92.0%、96.0%、92.0%。白念珠菌对氟康唑、伏立康唑、伊曲康唑的耐药率分别为8.7%、11.4%、47.8%。热带念珠菌对氟康唑、伏立康唑、伊曲康唑的耐药率均较高,分别为37.5%、37.5%、60.0%。由于部分真菌药敏没有CLSI和EUCAST标准而采用ECV折点,统计时不做敏感耐药分析,仅进行野生型菌株的报告。见表2。
2.32016 —2018年主要真菌菌株构成变化
2016、2017 年以近平滑念珠菌为主,其次为白念珠菌。2018年真菌谱构成以白念珠菌为主,其次为近平滑念珠菌、热带念珠菌,其中近平滑念珠菌占比由2016年的52.9%减少到2018年的26.4%,热带念珠菌占比由2016年的9.8%增加到2018年的24.5%。见表3。
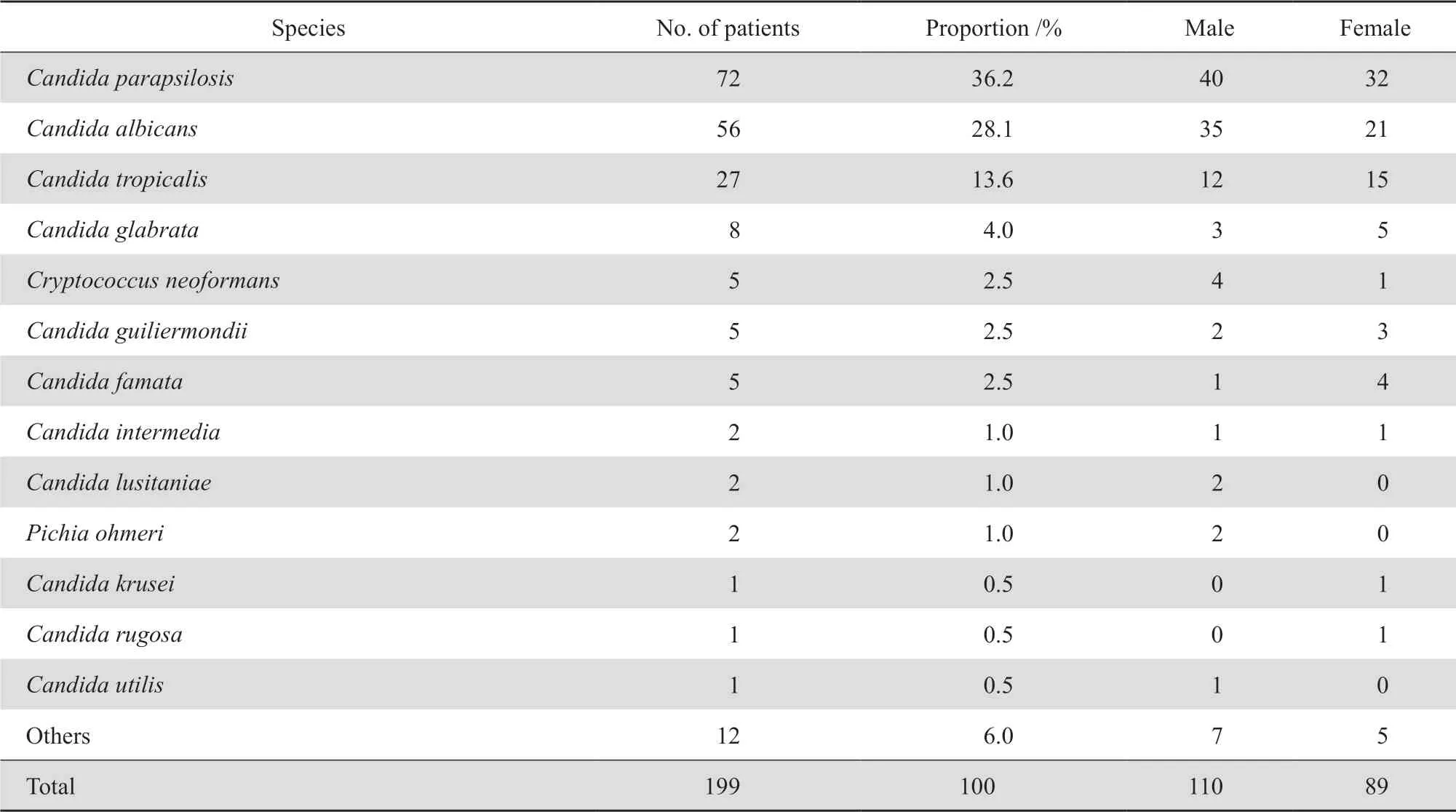
表1 临床无菌体液分离真菌菌种分布及患者性别构成Table 1 Distribution of the fungal strains isolated from sterile body fluids and the sex composition of patients

表2 真菌对抗真菌药物的敏感率和耐药率Table 2 Susceptibility of fungal strains to the commonly used antifungal agents

表2(续)Table 2(continued)

表3 2016—2018年临床分离的主要真菌菌株构成变化Table 3 Distribution of fungal strains isolated from 2016 to 2018
3 讨论
本研究收集2016—2018年来自全国7所儿童医院的199株无菌体液中的真菌数据,以华东地区为主,以及深圳、西安、开封儿童医院,因此能基本反映中国儿童无菌体液中的真菌病原谱和耐药率。病原菌中近平滑念珠菌居首,其次为白念珠菌、热带念珠菌、光滑念珠菌,与Xiao等[12]报道的2015—2017年CHIF-NET 0~17岁年龄组近平滑念珠菌(31.8%)的占比高于白念珠菌(31.0%)一致。热带念珠菌分离率显著增加,由2016年的9.8%增加到2018年的24.5%,可能与其黏附力强,易污染含葡萄糖溶液(如静脉营养液),容易导致暴发流行有关[12-13]。近年来相关文献报道,非白念珠菌分离率有上升趋势,应该引起临床医师的高度重视[1-2]。
近几年随着广谱抗生素、肾上腺皮质激素、免疫抑制剂的使用,真菌感染发病率逐年增加,其中尤其以儿童真菌感染发病率最高,占每年全球真菌感染发病率的31.2%[5]。已研究证实医院内重症监护患者使用呼吸机和中心静脉导管可能是侵袭性真菌感染的主要危险因素;肿瘤化疗患者存在免疫功能低下和肠黏膜损伤,可导致肠道内共生的念珠菌跨过肠黏膜屏障,形成侵袭性感染;胃肠道手术后使得肠壁损伤,也可导致肠道内共生的念珠菌跨过肠黏膜屏障,形成侵袭性感染[14-15]。本研究中菌株多来自于重症医学科、新生儿科和血液肿瘤科,亦证实侵袭性操作、免疫抑制和肠道微生态失衡导致肠黏膜屏障的破坏、病毒引起的继发感染都是侵袭性无菌体液真菌感染的高危因素。
临床常用的抗真菌药物主要有两性霉素B、三唑类(氟康唑、伊曲康唑、伏立康唑)、棘白菌素类(卡泊芬净)、氟胞嘧啶(5-氟胞嘧啶)[16]。本研究分析了氟康唑、伊曲康唑、伏立康唑、5-氟胞嘧啶四种抗真菌药物对临床常见真菌菌株的抗菌情况,其中白念珠菌对氟康唑的耐药率高达8.7%,高于以前文献报道的数据,可能与儿童氟康唑的临床广泛预防应用和本研究全部选择的是无菌体液标本有关;热带念珠菌对氟康唑的耐药率高达37.5%,与2010—2017年CHIF-NET报道热带念珠菌对氟康唑的耐药率由低于6%增加到高于30%的一致[12],并且耐药率呈现出进一步逐年增加的趋势。结合热带念珠菌分离率占比由2016年的9.8%显著增加至2018年的24.5%,故国内儿童临床念珠菌血症预防和经验选择抗真菌药物,应与IDSA 2016版成人指南一致,首选卡泊芬净等棘白菌素类药物[17]。
新型隐球菌和曲霉的CLSI标准中仅有ECV值,大多数医院限于实验室条件和菌株量少等因素,没有进行药敏试验,造成了本监测数据中新型隐球菌和曲霉药敏监测数据较少,需要在下一步的监测中进一步完善对这两种菌的监测技术培训。另因Yeast One检测板收费标准等问题,念珠菌的药敏检测板实验室应用的是FUNGUS 3 鉴定药敏板,导致了本研究中的念珠菌药敏监测数据中未含有棘白菌素类抗真菌药物的数据,同时因为CLSI-M100 (M27-S4)和EUCAST 10.0标准中部分抗真菌药判断标准差别较大,需要进一步在国内统一标准,形成专家共识[18]。
综上所述,通过研究临床儿童患者常见真菌的菌株构成和药敏结果,不断完善儿童群体真菌耐药监测分析数据,重视基于大数据监测下的真菌药敏监测,促进临床医师对抗真菌药物合理应用。本监测结果为临床有效诊断、预防和经验治疗侵袭性真菌病提供更为准确的依据,减少抗真菌药物选择压力,提高儿童侵袭性真菌感染的救治成功率。
