成人患者体内伏立康唑代谢的影响因素分析 Δ
2023-02-27程林梁再明喻明洁孙凤军戴青陆军军医大学第一附属医院药学部重庆400038
程林,梁再明,喻明洁,孙凤军,戴青 (陆军军医大学第一附属医院药学部,重庆 400038)
伏立康唑属于第二代三唑类广谱抗真菌药,临床除可广泛用于侵袭性曲霉菌和念珠菌感染的治疗外,还可用于免疫抑制患者(如血液恶性肿瘤患者和器官移植患者)真菌感染的预防[1]。伏立康唑主要在肝脏由细胞色素 P450酶(cytochrome P450 enzyme,CYP)中 的CYP2C19、CYP3A4和CYP2C9代谢,由于该药的代谢呈非线性药动学特征,故其血药浓度个体差异大[2―4]。有研究显示,伏立康唑治疗窗窄,中国人群伏立康唑的有效治疗浓度为0.5~5.0 μg/mL[5]。伏立康唑的疗效和不良反应与其谷浓度(c0)密切相关,许多因素可影响伏立康唑的c0,包括患者性别、年龄、肝功能、CYP2C19基因多态性、合并使用质子泵抑制剂(proton pump inhibitors,PPI)、炎症状态等[6―8]。因此,确定伏立康唑c0的独立影响因素,将有利于伏立康唑初始给药剂量的确定。
伏立康唑在血液中的主要代谢产物为伏立康唑氮氧化物,约占所有代谢产物的72%[9]。研究显示,伏立康唑氮氧化物几乎没有活性,但不同代谢型(慢代谢型、中间代谢型、快代谢型)患者的伏立康唑c0/伏立康唑氮氧化物浓度(cN)值有明显差异[6]。因此研究c0/cN值能更准确地反映其代谢情况。最新研究显示,在肝功能障碍患者中,伏立康唑的清除与总胆红素(total bilirubin,TBIL)和血小板计数明显相关[10];在肾移植患者中,血红蛋白和血小板计数是影响伏立康唑c0的决定因素[11]。有研究认为,肾功能恶化与静脉内伏立康唑的累积剂量(≥400 mg/kg)显著相关[12]。但血小板计数、血红蛋白和肾功能对c0/cN值的影响,尚鲜见报道。同时在炎症对伏立康唑c0影响的研究中,以C反应蛋白(C-reactive protein,CRP)研究较多[13―15]。基于此,本研究综合分析了成人患者基本临床特征、伏立康唑给药方式和剂量、CRP、血红蛋白、血小板计数、肝功能、肾功能对成人患者伏立康唑c0、c0/cN值的影响,以期为伏立康唑的临床合理应用提供参考。
1 资料与方法
1.1 纳入与排除标准
本研究的纳入标准为:(1)年龄≥18岁且<60岁者;(2)接受伏立康唑治疗的住院患者;(3)接受伏立康唑治疗药物监测,所测伏立康唑c0为稳态c0;(4)具有与伏立康唑c0检测同一时间点的CRP、肝功能指标、肾功能指标和血常规指标结果;(5)同意将其检测伏立康唑c0后的废弃血浆用于伏立康唑cN的测定,并签署知情同意书者。
本研究的排除标准为:(1)妊娠期妇女;(2)使用CYP代谢酶强抑制剂或强诱导剂者。
1.2 资料来源
回顾性分析我院2021年4月-2022年3月使用伏立康唑并进行治疗药物监测的患者资料,具体包括:(1)基本资料,如性别、年龄、体质量;(2)病例资料,如基础疾病、感染真菌类型、伏立康唑给药剂量和方式以及联用PPI情况;(3)实验室检查指标,如CRP、血红蛋白、血小板计数、肝功能指标[碱性磷酸酶(alkaline phosphatase,ALP)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(gamma-glutamyltranspeptidase,γ-GT)、TBIL、直接胆红素(direct bilirubin,DBIL)、间接胆红素(indirect bilirubin,IBIL)、白蛋白]、肾功能指标(尿素氮、肌酐、肾小球滤过率)。本研究方案经医院医学伦理委员会批准,批件号为KY2021134。
1.3 伏立康唑c0与伏立康唑cN测定
所有患者使用伏立康唑[在给予负荷剂量(静脉滴注6 mg/kg或口服400 mg)的情况下,伏立康唑血药浓度达稳时间分别为给药第2天末和第5次给药前(第3天);在不给予负荷剂量(静脉滴注4 mg/kg或口服200 mg)的情况下,对于一般状况的成人患者,伏立康唑血药浓度在第4~7天达稳[5]],待患者体内的伏立康唑c0达稳后[5],于下次给药前采集患者静脉血,采用本课题组前期建立的液相色谱-串联质谱法测定患者体内的伏立康唑c0和伏立康唑cN[16],并计算c0/cN值。
1.4 统计学方法
采用SPSS 19.0统计软件进行分析。计数资料以率表示,符合正态分布的计量资料以±s表示,不符合正态分布的计量资料以M(P25,P75)表示。采用Pearson’s相关性分析影响伏立康唑c0、c0/cN值的因素;采用多元线性回归模型分析伏立康唑c0、c0/cN值的独立影响因素[数据以比值比(odds ratio,OR)及其95%置信区间(confidence interval,CI)表示]。检验水准α=0.05。
2 结果
2.1 纳入患者的基本资料
共纳入103例患者,其中男性61例,女性42例;年龄为20~59岁,平均(42.00±12.03)岁;体质量为40~81 kg,平均(59.69±10.41)kg;基础疾病以肺炎、肾脏疾病和白血病为主;未感染真菌患者占52.43%,感染真菌以曲霉菌、念珠菌和酵母样真菌为主;伏立康唑给药方式以静脉滴注为主,联用PPI的患者占55.34%;伏立康唑给药剂量为(3.73±0.86)mg/kg。结果见表1。
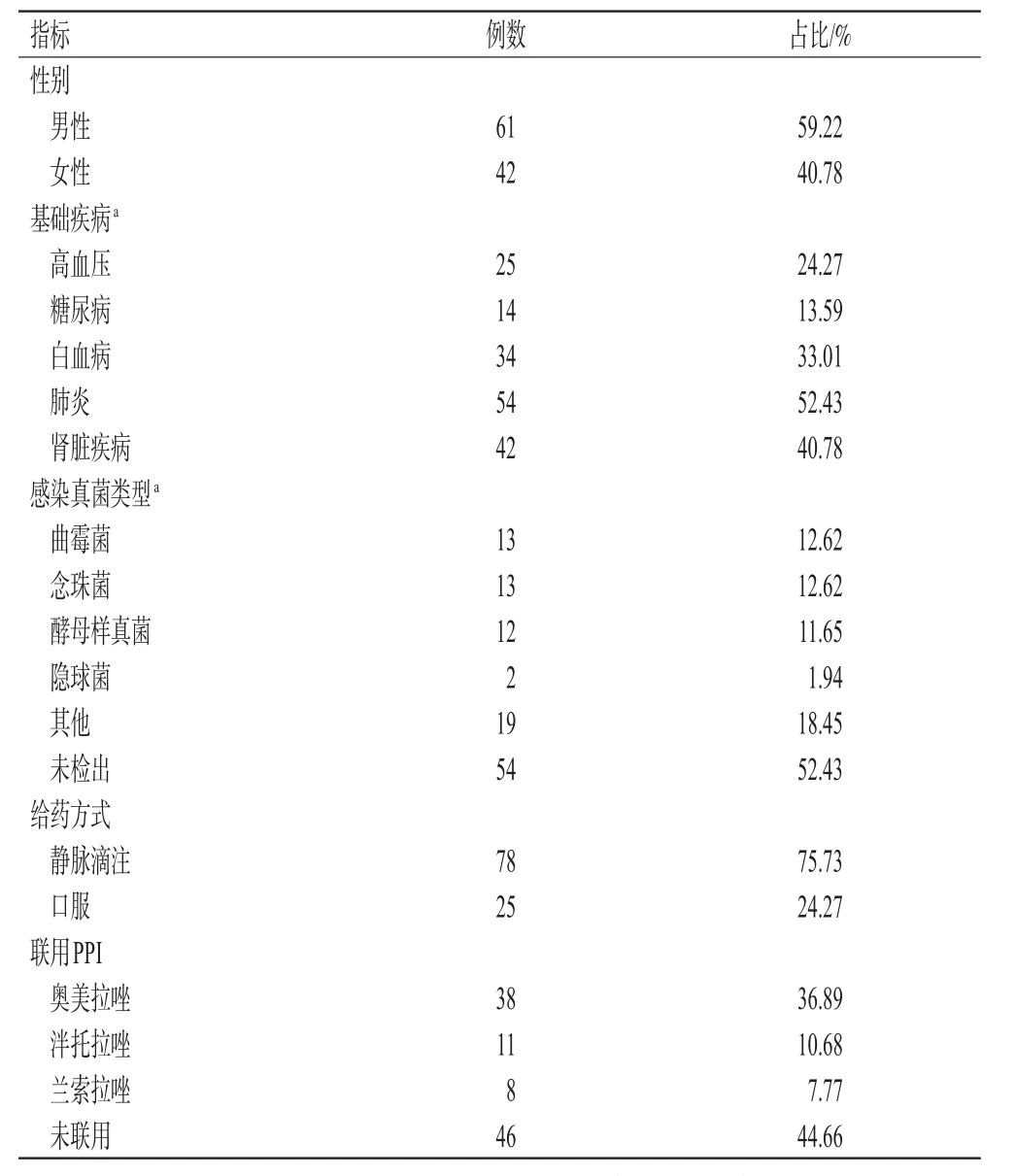
表1 纳入患者的基本资料
2.2 伏立康唑c0与c0/cN值测定结果
共得到伏立康唑c0值204个,c0/cN值107个。伏立康唑c0为 0.40~15.50[2.80(1.41,5.20)]μg/mL,伏立康唑c0/cN值为0.11~22.98[1.20(0.59,2.42)]。
2.3 患者的实验室指标检查结果
患者实验室检查指标CRP、血小板计数、血红蛋白、肝功能指标、肾功能指标的结果见表2。

表2 患者的实验室指标检查结果
2.4 伏立康唑c0、c0/cN值影响因素的相关性分析结果
CRP、TBIL、DBIL和IBIL水平与伏立康唑c0呈正相关,血小板计数和白蛋白水平与伏立康唑c0呈负相关;CRP、TBIL、DBIL水平与c0/cN值呈正相关,白蛋白水平与c0/cN值呈负相关。结果见表3。

表3 伏立康唑c0、c0/cN值影响因素的相关性分析结果
2.5 伏立康唑c0、c0/cN值的独立影响因素分析结果
多元线性回归模型分析结果显示,影响伏立康唑c0的独立因素有CRP、IBIL、伏立康唑给药方式和给药剂量,影响c0/cN值的独立因素有CRP、DBIL和年龄。结果见表4、表5。
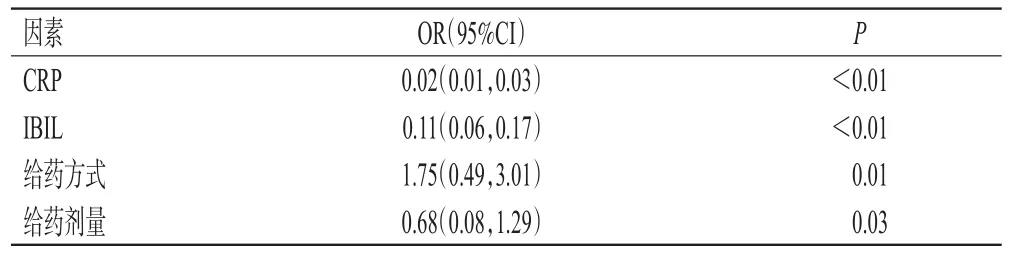
表4 伏立康唑c0的独立影响因素分析结果
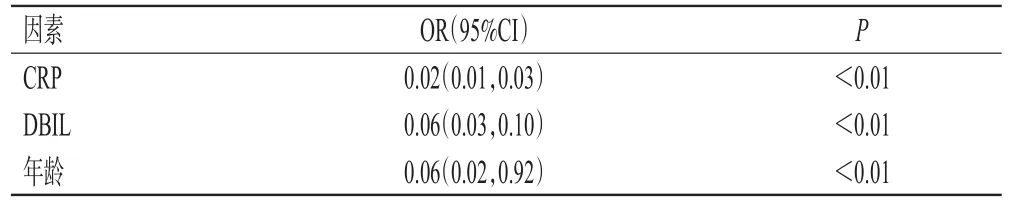
表5 伏立康唑c0/cN值的独立影响因素分析结果
3 讨论
伏立康唑常见的不良反应包括肝功能损伤、神经系统毒性和视力损害等,均与伏立康唑c0有一定的相关性[17―18]。在异基因造血干细胞移植受者中,移植术后2周内的肝功能损伤是早期伏立康唑停药的重要预测因素[19]。伏立康唑代谢呈非线性药动学特征,且其c0的影响因素复杂,患者个体间和患者体内差异均较大,因此分析伏立康唑代谢的影响因素,有利于在初始给药时确定伏立康唑的适宜给药剂量,以提高其疗效和降低不良反应发生率。c0/cN值能准确地反映伏立康唑在体内的代谢情况,但现有的关于c0/cN值影响因素的研究有限。因此,本研究在充分考察伏立康唑c0影响因素的基础上,除纳入文献报道较多的影响因素(患者性别、年龄、伏立康唑给药方式和剂量、联用PPI情况、肝功能、CRP)[6―8]外,还纳入了血小板计数、血红蛋白和肾功能,以确定影响伏立康唑c0、c0/cN值的独立因素,为伏立康唑的临床合理应用提供参考。
本课题组前期研究结果显示,老年患者相较于年轻的成人患者,肝功能减弱[20],加之老年患者的炎症指标CRP检测较少,因此,本研究未纳入老年患者作为研究对象。CYP2C19和CYP3A4是伏立康唑的主要代谢酶,在炎症状态下,CYP2C19和CYP3A4酶表达下调[21],从而导致伏立康唑代谢减弱,浓度升高。在血液恶性肿瘤患者和实体器官移植患者中,伏立康唑c0与CRP明显相关[13]。在血液病患者中,当CRP浓度为96 mg/L时,是伏立康唑过量的独立危险因素[14];且CRP浓度每增加1 mg/L,伏立康唑c0将提高0.015 mg/L[15]。本研究中,CRP是影响伏立康唑c0的独立因素,也是影响c0/cN值的独立因素,且CRP与伏立康唑c0、c0/cN值均呈正相关,这提示CRP可作为调整伏立康唑给药剂量的重要参考指标。
肝功能是影响伏立康唑代谢的主要因素[3]。伏立康唑的血浆蛋白结合率为50%左右,白蛋白也是伏立康唑的结合蛋白[8]。白蛋白下降会导致未结合的伏立康唑浓度升高,从而影响伏立康唑的清除率[22]。本研究中,白蛋白不是影响伏立康唑c0、c0/cN值的独立因素,但与伏立康唑c0、c0/cN值均呈负相关,这提示临床在使用伏立康唑时,需要考虑白蛋白,当白蛋白下降时,伏立康唑c0升高,应适当减少伏立康唑的给药剂量。有研究显示,TBIL会明显影响伏立康唑的蛋白-蛋白结合[11],是影响伏立康唑c0的独立因素[23]。本研究结果显示,IBIL是影响伏立康唑c0的独立因素,DBIL是影响c0/cN值的独立因素;且DBIL、IBIL与伏立康唑c0、c0/cN均呈正相关。IBIL、DBIL的升高反映了肝功能损伤,从而导致伏立康唑代谢减弱,使得伏立康唑c0、c0/cN值均升高。
奥美拉唑、兰索拉唑、泮托拉唑是CYP2C19和CYP3A4酶的底物,可抑制伏立康唑的代谢。本研究结果发现,联用PPI不是影响伏立康唑c0、c0/cN值的独立因素。一项多中心前瞻性研究了奥美拉唑和泮托拉唑对伏立康唑c0的影响,结果显示,使用PPI组和未使用PPI组患者伏立康唑c0并无明显差异[24]。伏立康唑c0与年龄有明显的相关性[25―26]。高龄的日本患者具有更高的c0/cN值[6];且年龄是伏立康唑c0>5.0 μg/mL的预测因素[25]。本课题组前期研究结果也显示,老年患者较年轻的成人患者伏立康唑c0更高,且c0>5.0 μg/mL患者所占比例也更高[20]。本研究中,年龄是影响伏立康唑c0/cN值的独立因素;但相关性分析中年龄与c0/cN值无明显相关性,这可能与本研究纳入的患者年龄跨度较小有关。
本研究结果还显示,给药方式和给药剂量是影响伏立康唑c0的独立因素,这提示当临床中出现伏立康唑c0高于正常值上限时,可通过改变伏立康唑给药方式(如将静脉滴注给药改为口服给药)和减少给药剂量来维持其c0在治疗窗内。本研究未观察到血红蛋白、血小板计数、肾功能与伏立康唑c0、c0/cN值的相关性,这可能与本研究纳入患者的基础疾病多样和基础肾功能大多在正常范围内有关。
综上所述,CRP、IBIL、伏立康唑给药方式和给药剂量是影响伏立康唑c0的独立因素,CRP、DBIL和年龄是影响c0/cN值的独立因素;临床使用伏立康唑时,应考虑上述指标对伏立康唑代谢的影响,合理调整伏立康唑的给药方式和剂量。本研究的局限性为:(1)CYP2C19基因多态性可影响成人患者伏立康唑c0、c0/cN值[27],但本研究未纳入这一变量;(2)本研究的样本量相对较小,故所得结论尚有待后续研究进一步证实。
