肝损伤患者利奈唑胺的治疗药物监测
2021-05-31孟丹丹陈利红董亚琳韩欣妍窦林杰董海燕
孟丹丹, 陈利红, 董亚琳, 韩欣妍, 窦林杰, 张 迪, 董海燕
肝损伤患者往往伴随着肠道微生物菌群的变化,肠道通透性的增加和免疫功能的异常,进而面临着微生态环境的失衡。在医院感染中,肝损伤患者的治疗难度随着革兰阳性菌,尤其是耐甲氧西林金黄色葡萄球菌(MRSA)等多重耐药菌感染率的增加而增加[1-2]。利奈唑胺通过与细菌50S亚基上核糖体RNA的23S位点结合,阻碍fMet-RNA与核糖体连接,从而抑制70S复合物的形成,进而抑制细菌蛋白的合成发挥抗菌作用[3],其作用模式独特,生物利用度高,不易产生交叉耐药,对包括MRSA、耐万古霉素肠球菌(VRE)和耐万古霉素葡萄球菌(VRSA)等多重耐药革兰阳性菌都有活性[4-5],广泛应用于临床。随着利奈唑胺的广泛应用,已有研究发现患者使用利奈唑胺≥14 d时或用药后利奈唑胺的血药谷浓度(Cmin)过高时,容易发生血小板减少,特别是重症患者[6-8],进而导致被迫停药、治疗中断,感染加重,需要对患者进行治疗药物监测(TDM)以达到安全有效的治疗浓度。利奈唑胺对MRSA等绝大多数耐药革兰阳性菌的MIC为2 mg/L[7-9],因此利奈唑胺Cmin宜大于2 mg/L。有研究表明利奈唑胺Cmin>8.2 mg/L时,重症患者发生血小板减少的可能性为50%[10],也有研究显示利奈唑胺Cmin>7.5或 6.3 mg/L[11-12],就能达到这一血小板减少发生率。为保证临床用药的疗效及安全,利奈唑胺阈值虽未确定,但目前多推荐将其Cmin控制2~8 mg/L。利奈唑胺以内酯和内酰胺途径经非酶促和酶促代谢,其中约65%不经肾清除,主要是通过肝脏中吗啉环的氧化进行代谢[13],在肝损伤患者(尤其是肝损伤终末期患者)中,药物的药动学已经发生了变化,进而导致治疗结果的改变,可出现治疗不足或因体内药物过量导致的不良反应[14]。尽管利奈唑胺的具体代谢途径仍不清楚,但肝功能损伤可能会降低利奈唑胺的清除率[15],有研究表明使用利奈唑胺后肝损伤患者血小板减少的发生率显著高于非肝损伤患者(20/35对9/72,P<0.001)和未使用利奈唑胺的肝损伤患者(20/35对24/70,P=0.025)[16]。在肝损伤患者中的利奈唑胺相关研究较少,基于利奈唑胺TDM安全有效的治疗策略分析更是缺乏。本研究拟对肝损伤患者使用利奈唑胺后的体内药物浓度、疗效及其诱导的血小板减少进行研究,以期为此类患者安全、有效地使用利奈唑胺提供参考。
1 材料与方法
1.1 患者来源
收集2017年12月—2019年5月西安交通大学附属第一医院利奈唑胺标准给剂量(600 mg,1次/12 h)下进行血药浓度监测的肝损伤患者。纳入标准:①年龄>18 岁;②根据Child-Pugh-Turcotte评分诊断为肝损伤的患者;③连续使用利奈唑胺超过72 h;④利奈唑胺达稳态后,具有Cmin监测点;⑤患者标本经细菌培养及药敏试验,结果为MRSA、VRSA和VRE等革兰阳性菌。排除标准:①哺乳期妇女和妊娠妇女;②血药浓度未达稳态或低于检测下限。本研究得到医院伦理委员会批准。研究中根据Child-Pugh-Turcotte评分等级将使用利奈唑胺的肝损伤患者分为3组:轻度肝损伤组,Child-Pugh-Turcotte评分等级为A(总分值为5~6分);中度肝损伤组,Child-Pugh-Turcotte评分等级为B(总分值为7~9分);重度肝损伤组,Child-Pugh-Turcotte评分等级为C(总分值≥10分)。评分标准见表1。
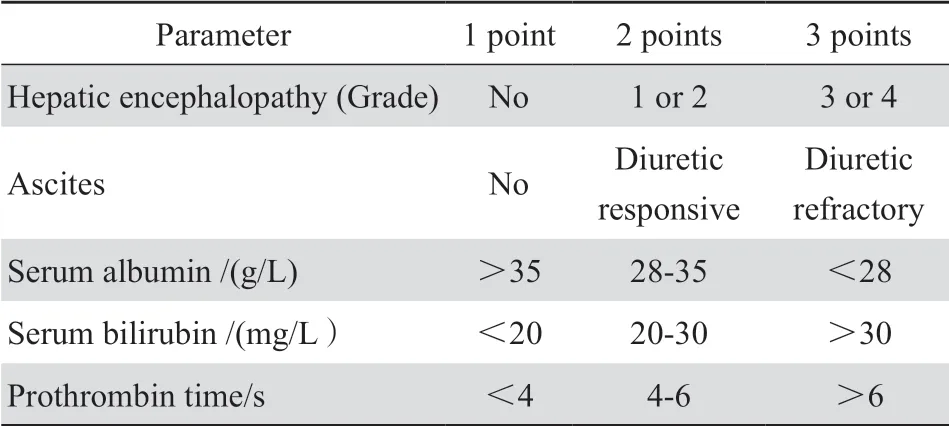
表1 Child-Pugh-Turcotte评分Table 1 Child-Pugh-Turcotte scoring criteria
1.2 血药浓度测定
连续使用利奈唑胺3 d后于下次给药前采集患者静脉血样1 mL,在4 000 r/min的转速下,离心10 min,收集上清液并保存在-80℃备用。按前期研究方法[17],使用高效液相色谱(HPLC)测定利奈唑胺的Cmin。采用紫外吸收检测器,检测波长是254 nm。利奈唑胺的血浆样品处理方法:将样品与甲醇(1∶1)混合,并在室温下静置20 min,然后以10 000 r/min 的转速离心10 min,取50 μL上清液进样分析。固定相为Hypersil C18色谱柱(150 mm×4.6 mm,5 μm)。流动相由乙腈与水(体积比23∶77)的混合物组成,用磷酸调节pH至 5.0。流速为 1.0 mL/min。该方法的线性范围为0.31~20.0 mg/L(R2=0.9996),最低定量限为0.31 mg/L,绝对回收率为47.2%, 相对回收率为102.1%,日内和日间变异系数分别为 4.0%和3.5%。我们前期的研究较为详细地描述了样品在室温放置、冰冻、冻融时的稳定性[17]。
1.3 数据采集
采集资料包括①患者人口学资料:性别、年龄、体重等;②合并用药:患者在采血前是否服用奥美拉唑、氨氯地平及胺碘酮等;③患者基础疾病:查尔森合并症评分;④实验室检查项目:肌酐清除率(CLcr)、细菌清除情况;⑤肝损伤程度:Child-Pugh-Turcotte评分等级;⑥利奈唑胺不良反应:血小板减少。参考相关文献[18-20],利奈唑胺诱导血小板减少的判定标准为用药后血小板计数较基线值下降≥30%。微生物学疗效以肝损伤患者使用利奈唑胺治疗后细菌是否清除作为判定标准。患者经利奈唑胺治疗后,采集病原学标本,应用自动化微生物鉴定及药敏测试系统,治疗后检测病原菌消失,判定为已被清除;治疗后细菌培养结果仍为阳性,则判定为未被清除。
1.4 统计分析
参考相关研究报道[9-12,21-23],利奈唑胺的治疗窗定义为血浆Cmin2~8 mg/L。数据呈正态分布的以平均数±标准差表示,呈偏态分布的均以中位数(四分位数)表示。计量资料间的统计分析采用t检验,计数资料间的统计分析采用χ2检验,采用多元线性回归探讨影响利奈唑胺Cmin的因素。采用 SPSS 23.0 软件进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床资料
本研究共纳入30例肝损伤患者,年龄为(51.2 ±15.4)岁,男23例(76.7%)。其中轻度肝损伤组11例、中度肝损伤组13例、重度肝损伤组6例。对三组患者中利奈唑胺Cmin进行统计,轻度、中度和重度肝损伤组中Cmin分别为(7.5 ± 3.2 )mg/L、(11.6 ± 3.2) mg/L和(19.3 ± 6.5)mg/L,组间差异有统计学意义(P<0.05);另外,轻度、中度和重度肝损伤组患者的查尔森合并症评分分别为1.7 ±0.4、4.6 ± 0.3和4.0 ± 0.3,组间差异有统计学意义(P<0.001)。患者的临床资料见表2。

表2 患者的基本特征Table 2 Baseline characteristics of patients
2.2 血药Cmin 分布
据上述结果,进一步对利奈唑胺Cmin进行分析:轻度肝损伤组11例患者共监测19个Cmin,中度肝损伤组13例患者共监测17个Cmin,重度肝损伤组6例患者共监测6个Cmin,分布特征见图1。重度肝损伤组利奈唑胺的Cmin显著高于轻、中度肝损伤组(P<0.05)。轻度、中度和重度肝损组中分别有11.8%、42.1%和66.7%的Cmin高于治疗窗上限。
2.3 血药Cmin 影响因素分析
采用线性回归分析研究肝损伤患者中利奈唑胺血药浓度的影响因素。结果表明,肝损伤患者中利奈唑胺Cmin与患者年龄、查尔森合并症评分和重度肝损伤具有相关性(P<0.05),且皆为正相关(见表3、4,图2)。进一步的分析结果表明年龄≥65岁与年龄<65岁的肝损伤患者中利奈唑胺Cmin分别为10.0(6.6,34.5)mg/L与3.2(1.9,7.7)mg/L(P=0.009)。另外,与查尔森合并症评分<4的患者相比,当查尔森合并症评分≥4时,利奈唑胺的Cmin高于治疗窗的患者比例明显增加(图2),分别为9.1(2.1,24.6)mg/L与3.2(2.5,5.4)mg/L(P=0.002)。

图1 利奈唑胺在肝损伤患者中的谷浓度分布Figure 1 The distribution profile of linezolid Cmin in patients with hepatic impairment
2.4 使用利奈唑胺后的细菌清除情况
30例患者中有21例(70.0%)使用利奈唑胺后细菌最后被清除,其中轻度、中度和重度肝损伤患者分别为7例、9例和5例。细菌清除患者中利奈唑胺Cmin为5.8(3.2,11.6)mg/L,细菌未清除患者中利奈唑胺Cmin为2.2(1.3,9.9)mg/L。虽然细菌清除组患者利奈唑胺的Cmin高于细菌非清除组,但两组间差异无统计学意义。

表3 影响利奈唑胺谷浓度的单因素分析结果Table 3 Univariate analysis of the variables associated with trough level of linezolid

表4 影响利奈唑胺谷浓度的多因素分析结果Table 4 Multivariate analysis of the variables associated with trough level of linezolid
2.5 利奈唑胺致血小板减少的发生情况
有9例(30.0%)患者使用利奈唑胺后发生了相关血小板减少(图3),分别为:轻度肝损伤组2例,血小板减少的发生时间为(11.0±2.0)d;中度肝损伤组4例,血小板减少的发生时间为(10.5±5.7) d;重度肝损伤组3例,血小板减少的发生时间为(9.3±2.9)d。发生血小板减少患者中利奈唑胺Cmin为6.6(1.3,20.0)mg/L,未发生血小板减少的患者中利奈唑胺Cmin为4.4 (2.9,8.8)mg/L,且两组间的差异有统计学意义(P<0.05)。

图2 利奈唑胺谷浓度与患者年龄及查尔森合并症评分的关系Figure 2 Relationship between linezolid plasma trough concentration and patient age and Charlson comorbidity score

图3 肝损伤患者中利奈唑胺致血小板减少的情况Figure 3 Linezolid-induced thrombocytopenia in patients with hepatic impairment
3 讨论
利奈唑胺药品说明书中对轻、中度肝损伤患者无需调整的给药策略仅来源于少数病例(n=7),并且未评价在重度肝损伤患者利奈唑胺的体内药动学特性及给药策略。然而,随着利奈唑胺临床应用的增加,Zhang等[25]对45例肝功能不全患者(凝血酶原活性≤40%)使用标准剂量(600 mg,1次/12 h)的利奈唑胺研究发现存在利奈唑胺体内过暴露情况,特别是在重度肝功能不全患者(凝血酶原活性≤20%)使用利奈唑胺后的血药Cmin>8 mg/L的概率为64.4%。Sasaki等[15]对4例严重肝损伤患者(Child-Pugh-Turcotte C级)的研究中也发现4例患者中利奈唑胺Cmin均明显升高。因而,肝损伤患者使用利奈唑胺后的潜在过暴露及治疗有效性与安全性需要深入评估,研究人员也建议对于肝损伤患者开展利奈唑胺TDM,以期达到良好临床疗效的同时确保用药安全,但上述研究并未对影响利奈唑胺血药Cmin的因素和不同程度肝损伤患者中利奈唑胺血药Cmin分布特征进行分析。因此,本研究基于TDM对肝损伤患者中利奈唑胺的应用进行了分析,在中度和重度肝损伤患者中利奈唑胺标准给药方案的血药Cmin较高,均值分别达(11.6 ± 3.2) mg/L和(19.3 ± 6.5) mg/L,并且分别有42.1%和66.7%的Cmin高于治疗窗上限(8 mg/L),尽管在这些患者中细菌清除率分别达到了9/13和5/6,但血小板减少的发生率也偏高,分别为4/13和3/6。因此,对于中、重度肝损伤患者使用利奈唑胺抗感染治疗中,在关注疗效的同时也应密切关注血小板减少的发生,TDM作为一种便捷的措施可以有助于及时调整给药方案,达到最佳的疗效与最低的不良反应发生率。
本研究中,多因素回归分析结果显示在肝损伤患者中利奈唑胺Cmin与患者年龄、查尔森合并症评分及重度肝损伤具有显著正相关性。结果表明≥65岁的患者利奈唑胺Cmin是<65岁患者的3.1倍,这与Abe等[26]对455例患者研究发现年龄与利奈唑胺暴露之间存在显著的正相关关系是一致的。另外,本研究发现查尔森合并症评分≥4的肝损伤患者中利奈唑胺Cmin是查尔森合并症评分<4的肝损伤患者的2.8倍,这与之前Apodaca等[27]发现高查尔森合并症评分患者利奈唑胺Cmin更高是一致的。此外,本研究发现在肝损伤患者中尤其是重度肝损伤患者中存在药物过暴露的现象。虽然利奈唑胺的具体代谢途径尚不清楚,但是有研究表明肝损伤抑制利奈唑胺的代谢[16],进而导致利奈唑胺过暴露。
本研究仍存在一定的不足,即本研究为单中心、回顾性研究,其样本量有限,研究结果仍需在后续的研究中加以证实。同时,本研究并未对肝损伤患者中利奈唑胺的药动学特征进行评价。考虑到利奈唑胺在肝损伤患者中存在药物过暴露,肝损伤对利奈唑胺体内过程的影响仍需进一步研究。
综上所述,本研究通过监测利奈唑胺在肝损伤患者中的血药浓度,探究了影响其Cmin的因素,并且评估利奈唑胺在该类患者中的细菌清除率及其相关血小板减少发生情况,发现在肝损伤患者使用标准给药方案后利奈唑胺仍具有较高的血药浓度,特别是中度和重度肝损伤患者,并且相关血小板减少发生率高。年龄、查尔森合并症评分和重度肝损伤是利奈唑胺体内浓度的影响因素。临床需要进行TDM并及时调整给药方案,达到最佳的疗效及最低的不良反应发生率。
