血液肿瘤相关性高钙血症的临床特点及预后因素分析
2021-05-25邱小亮姚晨姣
邱小亮, 姚晨姣
(中南大学 湘雅三医院 血液科, 湖南 长沙 410013)
恶性肿瘤相关性高钙血症(malignancy associated hypercalcemia, MAH)是晚期肿瘤的常见并发症,几乎与所有恶性肿瘤亚型有关,近四分之一的恶性肿瘤患者可在病程中出现不同程度的血钙升高[1-2].实体肿瘤中最常见于肺癌、乳腺癌、肾癌[3],血液肿瘤中最常见于多发性骨髓瘤(multiple myeloma,MM)[4],成人T细胞白血病/淋巴瘤也较常见[5].MAH是恶性肿瘤患者的不良预后因素,可能成为直接死亡原因[6].降低血清钙水平可延长生存期,并缓解症状,无论是否达到正常血钙,治疗都会使大量MAH患者的症状得到改善[7],因此有必要对此类患者进行早期识别和适当管理.以往多为实体肿瘤相关性高钙血症的研究,单独研究血液肿瘤相关性高钙血症的文章较少.本研究将回顾性分析我院153例血液肿瘤相关性高钙血症患者的临床资料,分析血液肿瘤相关性高钙血症的临床特点,探讨其预后的影响因素,加强临床医师对该并发症的认识,为临床医生对于该并发症的及时诊断、治疗及预后判断提供数据参考及理论依据,改善患者的生活质量,延长患者的生存时间.
1 资料和方法
1.1 一般资料
以中南大学湘雅三医院血液科2007年3月至2014年9月住院治疗的153例血液肿瘤相关性高钙血症患者为研究对象,诊断均符合各血液肿瘤指南诊断标准且校正血清钙浓度大于2.75 mmol/L,计算公式为c校正血清钙=c总血清钙+(40-ρ血清白蛋白)×0.025[8],收集资料前均未使用钙、维生素D、噻嗪类利尿剂、锂、降钙素及双膦酸盐等能引起血钙变化的药物,未合并原发性甲状旁腺功能亢进症、甲状旁腺癌、家族性低尿钙性高钙血症、甲状腺功能亢进、肝硬化、肾上腺功能减退症、嗜铬细胞瘤、长期制动、肉芽肿性疾病或其他系统恶性肿瘤等影响钙代谢的疾病.
1.2 观察指标
观察指标包括性别、年龄、病理类型、分期、临床症状、确诊肿瘤至高钙血症时间、高钙血症复发情况、骨质破坏情况、血清钙浓度、病程中血清钙最高浓度、血清白蛋白(serum albumin,ALB)质量浓度、血清球蛋白(serum globulin,GLB)质量浓度、肌酐(creatinine,Cr)浓度、尿酸(uric acid,UA)浓度、尿素氮(blood urea nitrogen,BUN)浓度、白细胞(white blood cell,WBC)计数、血红蛋白(hemoglobin,Hb)质量浓度、血小板(platelet,PLT)计数等.
1.3 随访
随访方式为电话随访,随访截止日期为2019年9月30日,院外死亡患者通过联系家属获得准确信息.153例血液肿瘤相关性高钙血症病例中,有136例得到完整病例资料,17例患者出现失访.
1.4 统计学处理
应用SPSS Statistics 24统计软件统计分析,通过相关性分析及多元线性回归分析各临床特点与血钙水平的相关性.绘制Kaplan-Meier生存曲线,采用log-rank检验对可能影响预后的相关因素进行单因素分析.建立COX比例风险模型,单因素分析有显著意义的进行多因素COX回归分析,P<0.05为差异有统计学意义.根据多因素分析中的独立预后影响因素建立预后评分系统.
2 结果
2.1 临床特征
校正前血液肿瘤相关性高钙血症的发病率为3.9%(46/1169),校正后血液肿瘤相关性高钙血症的发病率为13.1%(153/1169),其中MM相关性高钙血症、白血病相关性高钙血症、淋巴瘤相关性高钙血症校正后的发病率分别为22.8%、7.0%、13.4%.153例血液肿瘤相关性高钙血症的中位年龄为55岁,男90例(58.8%),女63例(41.2%).MM相关性高钙血症按DS分期:Ⅰ期14例(17.3%),Ⅱ期7例(1.2%),Ⅲ期60例(74.1%).淋巴瘤相关性高钙血症按AnnArbor分期:Ⅰ期1例(3.1%),Ⅱ期7例(21.8%),Ⅲ期9例(28.1%),Ⅳ期15例(46.8%).诊断高钙血症后的中位生存时间为13个月.校正血清钙浓度中位数为2.9 mmol/L,各实验室指标特点见表1.
2.2 血清钙浓度相关性分析
以性别、年龄、WBC、Hb、PLT、ALB、GLB、Cr为变量因素对患者的血钙水平进行相关性分析,结果显示ALB、GLB、Cr、PLT与血清钙浓度存在相关性,且ALB及PLT与血清钙浓度呈负相关,GLB及Cr与血清钙浓度呈正相关,见表2.

表1 血液肿瘤相关性高钙血症的实验室指标特点
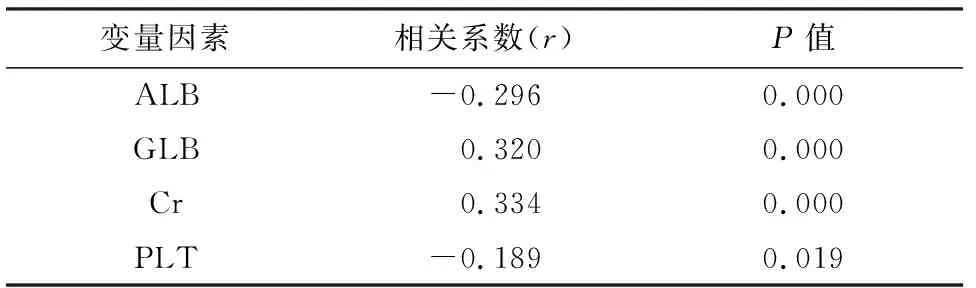
表2 血液肿瘤相关性高钙血症的血清钙浓度相关性分析
将与血清钙浓度存在相关性的4个变量因素进行多元线性回归,结果显示ALB显著负向影响血清钙浓度,影响系数为-0.191(P<0.05);GLB及Cr均显著正向影响血清钙浓度,影响系数为分别为0.173、0.279(P<0.05),见表3.基于多元线性回归结果,可得出回归方程:c血清钙系数=1.344-0.191×ALB系数+0.173×GLB系数+0.279×Cr系数.
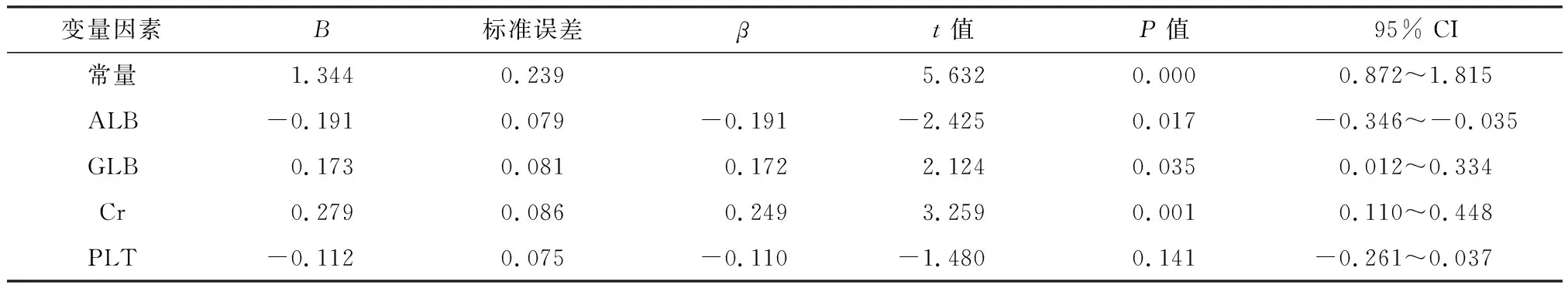
表3 血液肿瘤相关性高钙血症的血清钙浓度多元线性回归Table 3 Multiple linear regression of serum calcium concerntration in hematological malignancies associated hypercalcemia
2.3 预后影响因素分析
2.3.1 单因素分析
单因素分析结果显示血清钙、Hb、Cr为影响血液肿瘤相关高钙血症患者预后的重要因素,差异具有统计学意义(P<0.05),见表4、图1.
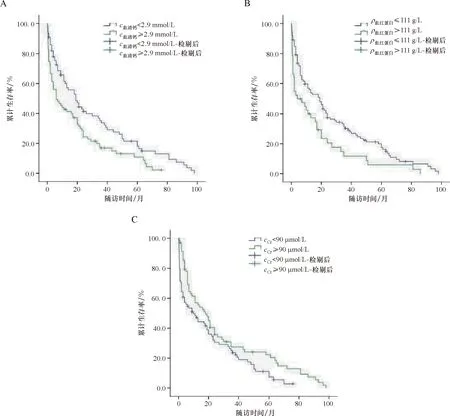
A:血清钙对血液肿瘤相关高钙血症患者生存率的影响;B:血红蛋白对血液肿瘤相关高钙血症患者生存率的影响;C:肌酐对血液肿瘤相关高钙血症患者生存率的影响.

表4 血液肿瘤相关性高钙血症患者临床特征对预后影响的单因素分析
2.3.2 多因素分析
将单因素分析中具有统计学差异的血清钙、Hb、Cr 3个影响因素引入COX回归模型分析,结果显示,血清钙及Hb为血液肿瘤相关高钙血症患者独立的预后影响因素(P<0.05),见表5.
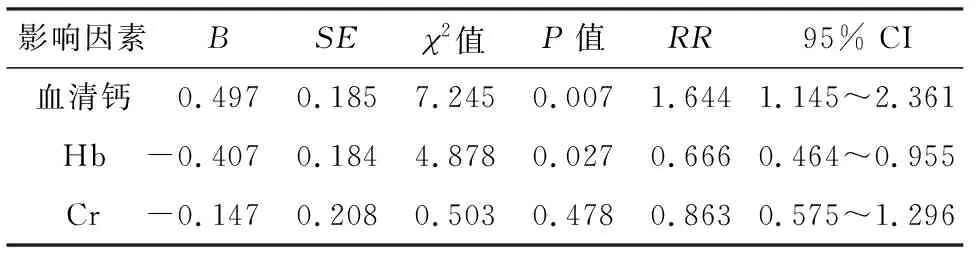
表5 血液肿瘤相关高钙血症患者临床特征对预后影响的多因素分析
2.4 预后因子评分
按多因素分析结果中的2个独立危险因素(c血清钙≥2.9 mmol/L及ρ血红蛋白<90 g/L)分组:得分=0(无独立危险因素)、得分=1(1个独立危险因素)、得分=2(2个独立危险因素).得分为0、1、2的患者的中位生存时间分别为20个月、18个月、4个月(P=0.002<0.05),见表6、图2.

表6 根据预后因子评分的中位生存时间Table 6 Median survival time by prognostic factor score
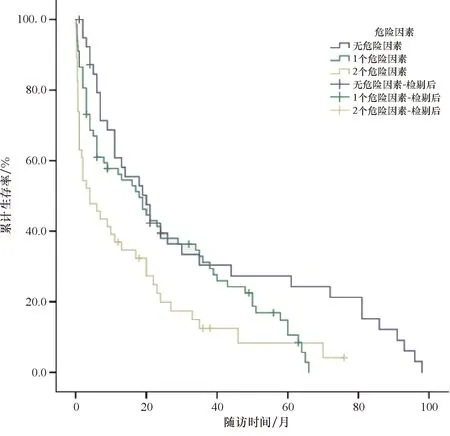
图2 预后因子评分对血液肿瘤相关性高钙血症患者生存率的影响
3 讨论
血液肿瘤相关性高钙血症发病率的报道较少见,国外一项回顾性研究[9]分析了7年间恶性肿瘤相关性高钙血症的发病率,其中血液肿瘤相关性高钙血症的总发病率为10.9%(149/1367),MM 28.1% (9/32),白血病11.5%(57/496),非霍奇金淋巴瘤13%(63/484),霍奇金淋巴瘤5.4%(15/276).在本研究中,校正前血液肿瘤相关性高钙血症的发病率为3.9%,校正后血液肿瘤相关性高钙血症的发病率为13.1%,其中校正后MM相关性高钙血症、校正后白血病相关性高钙血症、校正后淋巴瘤相关性高钙血症的发病率分别为22.8%、7.0%、13.4%.校正后的高钙血症发病率与国外大多数报道的发病率相当.大部分血液肿瘤患者由于肿瘤的消耗等原因存在低蛋白血症,尤其是MM(单克隆球蛋白的异常升高抑制白蛋白的合成),白蛋白的降低导致结合钙减少,为达到平衡,离子钙的水平成比例的增加,故实际检测的总血清钙浓度并不能真实地反映患者具有生理活性的钙的水平[10-11],易导致漏诊,低估血液肿瘤相关性高钙血症的发病率.校正后的血清钙更能反映与之相符的疾病状态下真实血清钙水平[12].
本研究发现,MM相关性高钙血症患者74.1%为DS分期III期,且大多数病例均存在贫血、血小板减少、肾功能受损、营养状态欠佳等晚期表现,该发现与现有研究结果相似[13-14].一项纳入了2 129例MM患者的回顾性病例对照研究显示,有415例(19.5%)患者在诊断时出现高钙血症,且高钙血症的发生与贫血、血小板减少、肾小球滤过率(GFR)、ISS分期、溶骨性病变等晚期疾病的特征密切相关[15].一项回顾性单中心配对研究收集了62例淋巴瘤相关性高钙血症患者,其中91.9%为III/IV期疾病[16],这与本研究结果一致,在本研究中,淋巴瘤相关性高钙血症患者也多为III/IV期.
高钙血症是恶性肿瘤的预后不良因素.本研究中,血液肿瘤相关性高钙血症的中位生存时间为13个月,MM、白血病及淋巴瘤的中位生存时间分别为20个月、6个月、20个月,较报道的非高钙血症的血液肿瘤疾病的中位生存时间短,但由于本研究为单中心回顾性研究,样本量有限,与非高钙血症的血液肿瘤疾病的生存时间对比有待于进一步的多中心大样本对照研究来证实.
本研究分析了影响血清钙浓度的相关因素,结果显示血清白蛋白显著负向影响血清钙浓度,血清球蛋白及肌酐显著正向影响血清钙浓度.血清白蛋白负向影响血清钙浓度以及血清球蛋白正向影响血清钙浓度可能的机制为:钙主要以离子钙和结合钙两种形式存在,仅离子钙具有生理作用,结合钙与离子钙之间处于一种动态平衡.大多数结合钙由白蛋白携带,所以血清白蛋白水平的改变或血清球蛋白的病理变化均可改变结合钙的含量,从而影响游离钙水平.肌酐升高常提示肾功能不全,研究显示,随着肾功能不全的进展,24 h尿钙排泄量也进行性下降,且易出现 1,25-二羟维生素 D 降低,另外在肾功能不全患者中,可出现继发性甲状旁腺功能亢进,甲状旁腺可分泌大量的 PTH 调节血钙水平[17],肌酐升高可能通过上述机制来正向影响血钙水平.但由于本文研究对象超过半数为 MM 患者,其相关性可能更倾向于 MM 相关性高钙血症患者,本研究后期将进一步扩大样本进行论证.
在血液肿瘤相关性高钙血症的预后影响因素方面,本研究采用了log-rank检验对可能影响预后的相关因素进行了单因素分析,结果显示血清钙、Hb、Cr为影响血液肿瘤相关性高钙血症患者预后的重要因素.将单因素分析中具有统计学差异的影响因素引入COX回归模型分析,结果显示,血清钙及Hb为血液肿瘤相关性高钙血症患者独立的预后影响因素(P<0.05).本研究中血液肿瘤相关性高钙血症患者的血清钙浓度中位值为2.9 mmol/L,故以血清钙浓度2.9 mmol/L为界值,得出血液肿瘤相关性高钙血症患者的血清钙浓度高于该界值则提示预后更差的结论.严重高钙血症的器官衰竭风险很高,可能导致危及生命的并发症.多项回顾性研究均显示,在MAH患者中,血清钙浓度越高,预后越差[17-18].一项纳入了131例严重高钙患者(c血清钙>3.0 mmol/L)的回顾性研究显示,在血液肿瘤相关性高钙血症亚组(44.3%)中,发生高钙血症的住院期间死亡率高达17.3%[19].本研究结果还显示中度及中度以上贫血(ρ血红蛋白<90g/L)亦为血液肿瘤相关性高钙血症独立的预后不良因素.贫血为恶性肿瘤常见的合并症,且已有多项研究表明贫血为恶性肿瘤的一个独立的预后不良因素[20-21].血液肿瘤分泌的细胞因子,包括白介素IL-6、IL-1、肿瘤坏死因子TNF-α等均可导致贫血的发生[22-23],也可通过体外局部溶骨作用导致高钙血症的发生,中重度贫血时组织氧合障碍刺激血管新生因子高表达,可加速肿瘤发展、降低化疗敏感性[24],同时与高钙血症协同损伤器官的功能.因血液肿瘤相关性高钙血症既往研究较少,尤其是预后影响因素的相关研究,本研究为单中心回顾性研究,存在一定的局限性,有待进一步扩大样本多中心研究证实预后影响因子影响的确定性及影响机制.
本研究还根据多因素分析中的独立预后影响因素(c血清钙≥2.9 mmol/L及ρ血红蛋白<90 g/L)建立了一个简单的预测模型,旨在识别预后极差的患者.结果显示预后因子评分系统中得分为0、1、2的患者的中位生存时间分别为20个月、18个月、4个月(P=0.002<0.05),患者存在的独立预后因素越多,其预后就越差.该评分系统可在一定程度上为血液肿瘤相关性高钙血症患者的预后提供参考.
综上,临床医生需对血液肿瘤相关性高钙血症引起重视,对于低蛋白血症的血液肿瘤患者必须进行血清钙浓度校正,以免低估高钙血症的发病率.血液肿瘤相关性高钙血症多发生于血液肿瘤晚期,中位生存时间短,因此有必要对具有较高死亡风险的血液肿瘤相关性高钙血症患者进行早期识别和适当管理.c血清钙≥2.9 mmol/L及ρ血红蛋白<90 g/L为影响其预后的独立不良因素,且独立预后因素越多预后越差,此类患者需早期干预,及时纠正,一方面可改善患者症状,提高患者生活质量,另一方面还可能有利于改善患者预后,延长生存时间.今后本研究将进一步行前瞻性大样本多中心对照研究来深入探索.
