MGLL在前列腺癌组织中的表达及其对癌细胞生长的调控作用
2021-05-26陈南辉钟伟枫潘斌王晓红黄志成江惠明谭万龙
陈南辉, 钟伟枫, 潘斌, 王晓红, 黄志成, 江惠明, 谭万龙
(1.南方医科大学 南方医院 泌尿外科, 广东 广州 510515; 2.梅州市人民医院 泌尿外科, 广东 梅州 514031;3.暨南大学 附属第一医院 泌尿外科, 广东 广州 510632; 4.南方医科大学 第三附属医院 肾内科, 广东 广州 510515)
前列腺癌(prostate cancer, PCa)是男性常见的恶性肿瘤之一,PCa发病率在我国逐年增高,其死亡率也随着年龄增长而上升[1].其发病起病隐匿、大多数患者确诊时已到晚期,目前临床治疗以手术及雄激素阻断为主,但激素依赖性PCa治疗大部分会发展成为去势抵抗性PCa,进一步增加治疗难度[2].由于PCa发生发展的相关机制尚未完全阐明,对于晚期PCa尚未有有效治疗手段[3-4].因此探讨PCa的发病机制,探索PCa的早期诊断标记物,对于PCa的预防和前期诊治具有重要的意义.
单酰甘油酯酶(monoacylglycerol lipase, MGLL)是一种催化单酰基甘油转化为游离脂肪酸(FFA)和甘油的脂解酶,与脂质代谢相关[5].MGLL在动脉硬化、缺血再灌注损伤等疾病模型中发挥重要作用,如水解内源性大麻素2-花生四烯酰甘油[6-7].有研究表明,MGLL被证实参与多种肿瘤细胞发生发展的调控,比如黑色素瘤[8]、乳腺癌[9]、肝癌[10]和结直肠癌[11].然而目前MGLL在PCa中的作用尚未明确,亟待研究分析.本研究利用生物信息学数据挖掘的方法,分析MGLL在癌症基因组图谱(the cancer genome atlas, TCGA)和Oncomine等癌症公共数据库中PCa中的表达情况及其对PCa病人的临床预后,而后通过Western blot及Transwell等实验在前列腺细胞癌系中对其功能进行验证.
1 材料和方法
1.1 Oncomine数据挖掘
Oncomine(https://www.oncomine.org)数据库是一个基于已发表文献的基因芯片收集数据库和集成数据挖掘平台,可根据自己的需求设定数据集筛选条件,本研究设定的条件为:(1)Cancer Type: Prostate cancer;(2)Gene:MGLL;(3)Data Type:mRNA;(4)Analysis Type:Cancer vs. Normal Analysis;(5)条件:P<0.05, fold change>2, rank=top 20%.
1.2 TCGA数据挖掘
通过基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)工具对TCGA中PCa的MGLL基因表达进行分析,包括:PCa组织差异表达、患者生存分析和相似基因检测.筛选设定条件为:(1)表达模块.选择MGLL及Match TCGA normal data;(2)生存分析模块.Survival Plots(生存图表)选择MGLL,Overall Survival (总体生存率)或者 Disease Free Survival(无病生存率);(3)Correlation 相关性模块.MGLL与FGFR1、PIK3CA、AKT2和GSK3B.
1.3 MGLL蛋白水平分析
人类蛋白质图谱(the human protein atlas,THPA)在线工具(https://www.proteinatlas.org)通过整合人体不同组织器官的蛋白质表达图谱,收集展示了多种正常及癌组织的转录组测序数据及免疫组织化学染色结果.本研究检索MGLL在PCa及正常组织中的免疫组织化学染色情况.
1.4 MGLL基因克隆及过表达
在Genebank上搜索人MGLL基因序列(NM_007283.1),设计并合成目的基因引物,并将MGLL克隆与pEGFP-C1质粒,最终经测序肯定该质粒构建成功.而后该基因过表达与人PCa细胞系DU145细胞,采用Western blot 方法检测GFP-MGLL蛋白的表达水平.采用Lipofectamine 2000 (Promega)对PCa细胞进行转染,观察细胞迁移和侵袭情况.
1.5 细胞转染与Transwell细胞迁移和侵袭
人PCa细胞系PC3及DU145细胞由暨南大学附属第一医院中心实验室提供.细胞于RPMI-1640培养液中培养,细胞融合至90%,采用Lipofectamine 2000 试剂盒转染GFP-MGLL及GFP空载体.细胞转染48 h后,收集各组细胞,用100 μL无血清重悬转入Transwell小室,进行迁移和侵袭(铺Matrigel胶),在细胞培养箱孵育24 h后取出小室,体积分数为4%多聚甲醛固定20 min,PBS洗涤1次,结晶紫染色10 min,PBS洗涤干净,于显微镜下观察细胞是否穿透小孔,并拍照记录,200倍光镜选取5个视野记录穿膜细胞个数,实验重复3次.
1.6 统计学分析
采用Rstudio 1.2.5033对筛选数据进行统计分析,两组间比较MGLL的表达差异采用t检验.全部采用在线工具分析的P值结果.生存分析为Kaplan-Meier生存分析及log-rank检验.MGLL与信号通路相关蛋白的共表达相关性采用Pearson相关分析.
2 结果
2.1 MGLL mRNA水平在正常及PCa组织间的表达差异
Oncomine数据库共检索到6个包含MGLLmRNA表达差异的队列研究,Meta分析提示,MGLL基因在PCa样本中显著低表达(P=0.021,图1).图2进一步展示了每个队列研究中MGLLmRNA的表达水平在PCa和正常组织中的表达情况,显示MGLLmRNA水平均显著下调(6个队列数据分别如下:t=-3.547,P<0.001;t=-1.178,P=0.014;t=-2.822,P=0.003;t=-2.801,P=0.005;t=-1.977,P=0.029;t=-2.337,P=0.013).
为进一步肯定MGLL 蛋白表达水平的差异,本研究通过THPA在线工具搜索并分析了MGLL在正常及PCa组织中的蛋白表达水平.结果表明,MGLL蛋白主要分布在细胞胞浆部分,在正常前列腺组织中高表达,而在癌组织中低表达或不表达(图3),与其mRNA结果趋势一致.

图1 Oncomine数据库中基于GEO数据的Meta分析结果
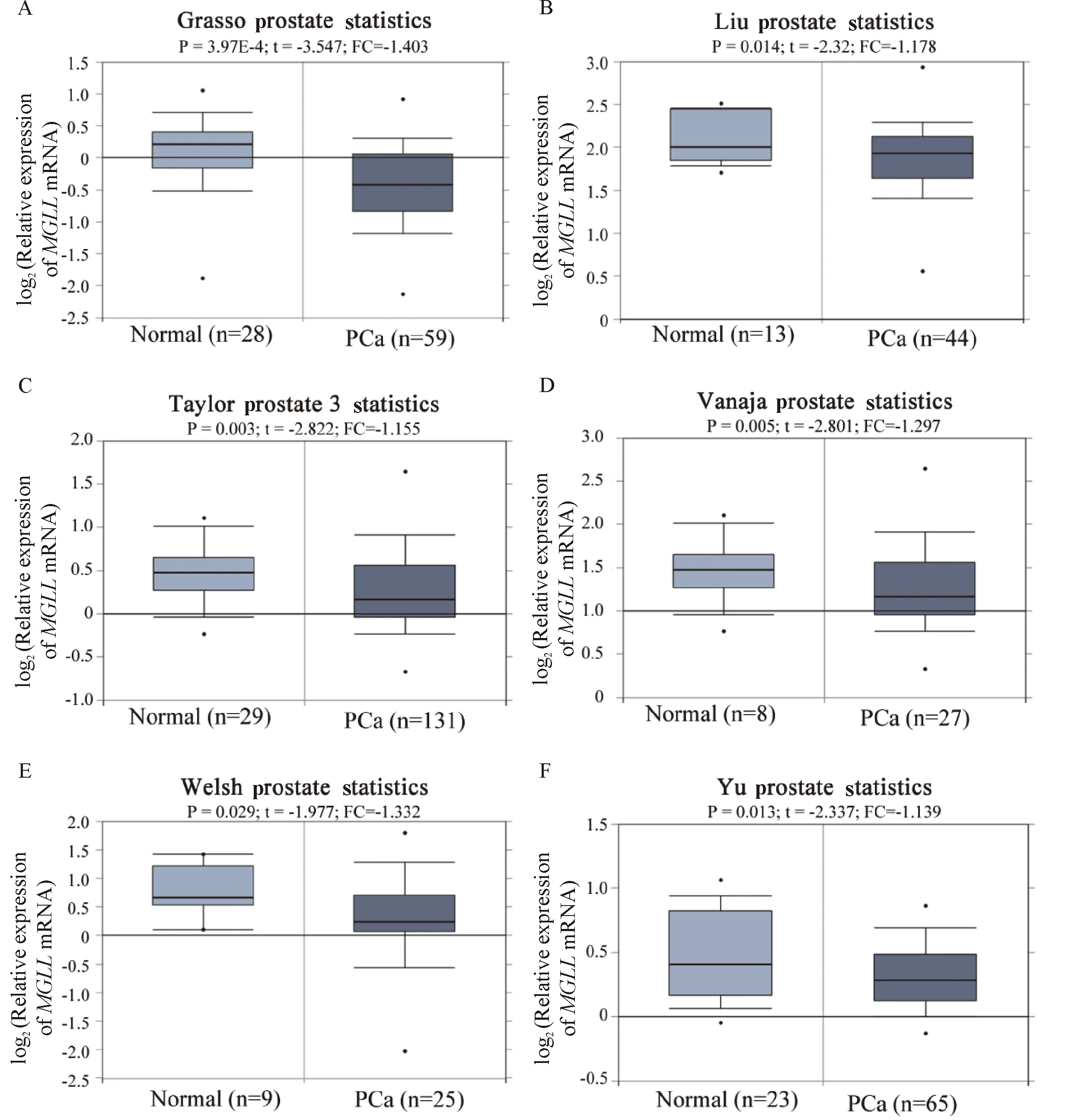
A: Grasso prostate 研究(GSE35988);B: Liu prostate研究(E-TABM-26);C: Taylor prostate 3 研究(GSE21034);D: Vanaja prostate研究(PMID: 12873976);E: Welsh prostate研究(PMID: 11507037);F: Yu prostate 研究(GSE6919).
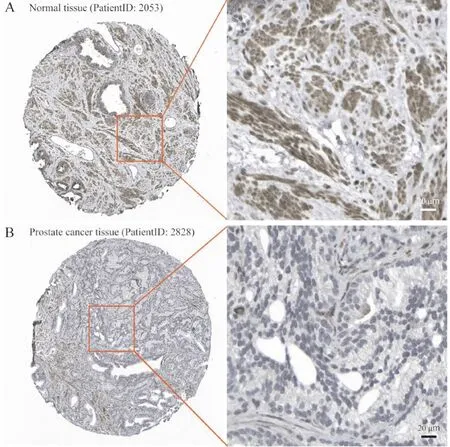
A:前列腺正常组织,来源于THPA网站(Patient id:2053).B:PCa组织,来源于THPA网站(Patient id:2828).
2.2 MGLL表达与PCa预后的相关性
GEPIA在线工具分析了TCGA数据库中的52例正常前列腺组织及492例PCa组织.图4A所示MGLL的mRNA水平同样在PCa组织中显著下调(P<0.001).进一步分析了MGLLmRNA水平与PCa患者总生存期(overall survival,OS)及无病生存期(diseasefree survival,DS)的关系,按50%中位数样本进行截断分为MGLL高表达和低表达组.如图4B和C所示,MGLL表达水平对患者的OS及DFS均存在显著影响.与高表达组相比,MGLL低表达的PCa患者中位OS和DFS均显著缩短(P=0.018;P=0.934).
2.3 MGLL与FGF/PI3K/AKT信号通路关键分子在PCa中表达的相关性
因目前MGLL与PCa发生发展的机制不清,为探索MGLL基因在PCa中发挥作用的分子机制,本研究通过TCGA数据库分析了MGLL与成纤维细胞生长因子受体FGFR1、PI3K/AKT信号通路关键分子如AKT2、GSK3B、脂酰肌醇3-激酶催化亚基 α (PIK3CA)在PCa族中的表达相关性,Pearson 相关性分析显示,MGLL与FGFR1、PIK3CA、AKT2、GSK3B的表达均呈正相关(R=0.6,P=0;R=0.36,P=0;R=0.22,P<0.001;R=0.36,P=0;R=0.5,P=0,图5).
2.4 MGLL 在PCa细胞系中的表达及其对细胞迁移和侵袭的影响
前面的分析表明MGLL可能是个抑癌因子,为进一步证实,本小组通过实验观察了MGLL在PCa细胞系中的表达情况.如图6A、B所示,RWPE-1是人正常前列腺上皮细胞,为对照细胞系;LNCap、DU145、PC3均为PCa细胞系.Western blot检测表明,MGLL在多个PCa细胞系中低表达(P<0.05).进一步构建了用于过表达的GFP-MGLL质粒,在DU145细胞中肯定了该质粒的表达情况(图6C).将该质粒于DU145及PC3细胞中过表达,而后通过Transwell实验观察MGLL对细胞系迁移和侵袭能力的影响.结果表明过表达MGLL之后,PCa细胞系的迁移(图6D)和侵袭(图6E)能力显著减弱(P<0.05),说明MGLL在PCa细胞系中低表达,上调MGLL水平可抑制PCa迁移和侵袭,MGLL为抑癌因子.
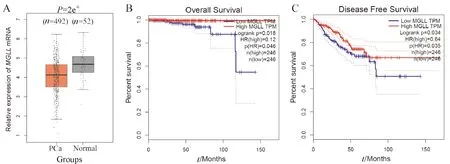
A: GEPIA中MGLL mRNA在TCGA数据库的表达情况;B: 总生存曲线;C: 无瘤生存曲线.
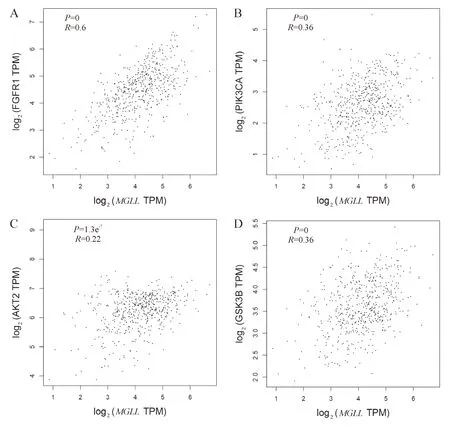
A: FGFR1与MGLL表达相关性;B: PIK3CA与MGLL表达相关性;C: AKT2与MGLL表达相关性;D: GSK3B与MGLL表达相关性.
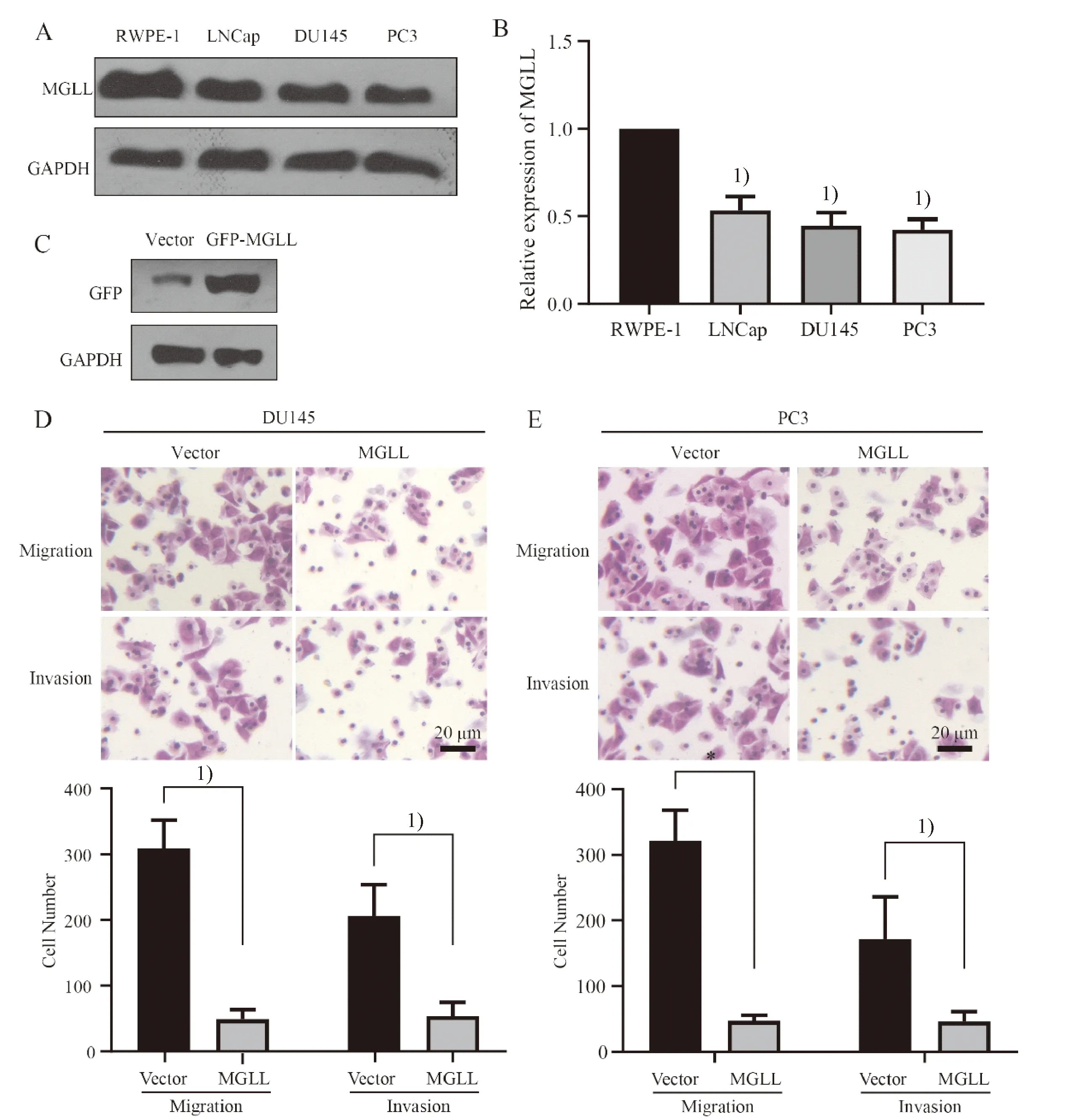
A:Western blot检测MGLL在PCa细胞系中的表达水平;B:表达水平的量化结果;C:Western blot检测GFP-MGLL在DU145细胞系中过表达情况;D,E:DU145和PC3细胞系中检测过表达MGLL对细胞迁移和侵袭能力的影响. 1)P<0.01
3 讨论
近期研究表明,代谢(尤其是脂代谢)与肿瘤的关系相当密切.MGLL又被称为甘油一脂酶,是一类丝氨酸水解酶[12].MGLL在脂肪组织、卵巢及睾丸中表达,其协同激素敏感性脂解酶将三酰甘油分解为脂肪酸及甘油,为细胞提供能量[13].最近文献指出,MGLL除了在中枢神经系统中发挥作用之外,在肿瘤发生发展过程中也发挥了重要作用.然而MGLL在不同肿瘤中的作用有差异,在有些肿瘤中是抑癌因子,有些肿瘤中是促癌因子.Nomura等[9]的研究首次提出了MGLL在一些侵袭性及原发性肿瘤中高表达,比如黑色素瘤、乳腺癌、卵巢癌等,通过脂肪酸能量代谢途径促进肿瘤的生长转移.Joyce等[14]在结直肠癌研究中发现MGLL与EMT的信号分子表达有相关性,怀疑MGLL促进肿瘤细胞的转移可能是通过EMT进行.Ye等[15]的研究显示在结直肠癌细胞中敲低MGLL,可以抑制BCL-2和Cyclin D1的表达,从而抑制癌细胞生长诱导凋亡.但Sun等[11]的研究得出相反结果,结直肠癌中过表达MGLL可通过PI3K/AKT通路抑制肿瘤的生长.MGLL在PCa发生发展中的作用机制有待进一步深入阐明.Nomura等[16]比较了雄性激素依赖和非依赖的人PCa细胞,发现MGLL通过大麻素抑制通路和脂肪素促进通路,一正一反共同调控肿瘤细胞的生长迁移.本研究通过现有的公共数据库进行挖掘,对MGLL基因在PCa样本中的表达进行分析,且通过试验验证了MGLL在PCa中的抑癌作用.
本研究分析了公共数据库前列腺正常及癌组织中MGLLmRNA和蛋白表达情况,探讨了其表达水平与临床预后的关系.TCGA和GEO的数据结果显示,与正常前列腺组织相比,MGLLmRNA水平在PCa中呈低表达.通过THPA发现MGLL蛋白水平在PCa中同样低表达,与转录水平的分析结果一致.进一步研究发现,MGLL的mRNA水平与患者的OS和DFS均存在显著相关性,MGLL高表达的PCa患者其OS和DFS显著提高.蛋白共表达相关性分析表明,MGLL与FGF/PI3K/AKT信号通路密切相关.TCGA数据库的表达分析表明,MGLL与该通路的关键分子(FGGR1、PIK3CA、AKT2、GSK3B)呈正相关.深入观察了PCa细胞系中MGLL的水平,发现MGLL低表达;而过表达MGLL则可显著抑制PCa细胞系的迁移和侵袭能力.综上MGLL是个抑制肿瘤的蛋白,且其发挥功能可能与PI3K/AKT信号通路相关,这为进一步验证MGLL参与PCa脂质代谢的分子机制提供了新的证据.
综上,本研究通过对前列腺及癌组织中MGLL的深入挖掘与分析,发现MGLL在PCa样本中低表达,并与肿瘤患者预后相关.数据库大样本分析可避免研究样本量过小而造成的误差,为PCa的基础研究提供了一定的理论依据和新的思路.
