咪康唑通过抑制PI3K/Akt/NOX4通路诱导 肺鳞癌H520细胞凋亡并增敏顺铂的机制
2021-05-25张伟楠宋少飞刘冰张陆勇
张伟楠, 宋少飞, 刘冰, 张陆勇
(1. 广东药科大学 药学院, 广东 广州 510006; 2. 广东药科大学 新药研发中心, 广东 广州 510006)
肺癌是当前世界最常见的人类恶性肿瘤之一,发病率和死亡率都居众多癌症之首.非小细胞肺癌约占肺癌总数的80%~85%,包括鳞癌、腺癌、大细胞癌[1].对于肺腺癌,针对表皮生长因子受体(epidermal growth factor receptor, EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)和c-ros原癌基因1酪氨酸激酶(c-ros oncogene 1 receptor kinase, ROS1)等驱动基因的靶向治疗药物在临床上得到广泛应用,临床获得较好的疗效[2].不同于肺腺癌,肺鳞癌现有化疗效果差,治疗方案有限,预后不良[3].因此,亟需研发有效的抗肺鳞癌药物及治疗方案.
顺铂是常用于治疗肺鳞癌的药物之一,可与DNA链交叉连接,产生细胞毒作用[4].有研究表明,顺铂因可增加肿瘤细胞内蛋白激酶B(protein kinase B, PKB或Akt)磷酸化,而使其抗癌效应降低并产生肿瘤耐药[5].在临床治疗中,与化疗相关的耐药性和毒性是影响其疗效的主要障碍.
老药新用是当前药物研发的捷径,既可保证药物的安全性,又可避免漫长的新药开发和筛选周期[6].随着药理学和基因组学的发展,研究发现许多老药在抗癌的新型靶点上具有活性.侵袭性真菌感染在严重免疫抑制的癌症患者中很常见,导致很多癌症病人死亡[7].肺鳞癌患者由于自身免疫功能受损,容易受真菌感染并有可能导致死亡[8-9].因此,合理使用抗癌药和抗真菌药物对癌症患者治疗极其关键.近年的研究表明,抗真菌药伊曲康唑能够抑制结肠癌细胞活性[10],泊沙康唑能对抗基底细胞癌的生长[11].另外,也有文献报道咪康唑能够抑制膀胱癌细胞的活性[12].但是唑类抗真菌药对肺鳞癌细胞活性有无抑制作用及其对顺铂疗效有无影响尚无研究报道.
本研究通过采用MTT法检测唑类抗真菌药对肺鳞癌H520细胞活力的抑制作用,以药物的半数抑制浓度(IC50)为指标评价不同抗真菌药的抗肺鳞癌H520细胞活性的效果,选择效果最佳的药物深入研究其体内外抗肺鳞癌细胞活性,并探讨其相关机制,为临床选用有效治疗肺鳞癌的方案提供新的实验依据.
1 材料与方法
1.1 材料
咪康唑(#S2536,CAS号:22916-47-8),硝酸布康唑(#S1833,CAS号:64872-77-1),硝酸舍他康唑(#S3161, CAS号:99592-39-9),噻康唑(#S1910, CAS号:65899-73-2),联苯卞唑(#S1854, CAS号:60628-96-8),克霉唑(#S1606, CAS号:23593-75-1),硝酸芬替康唑(#S2031, CAS号:73151-29-8),硝酸硫康唑(#S4120, CAS号:61318-91-0),硝酸异康唑(#S2534, CAS号:24168-96-5),泊沙康唑(#S1257, CAS号:171228-49-2),特康唑(#S5033, CAS号:67915-31-5),艾沙康唑(#S3722, CAS号:241479-67-4),伊曲康唑(#S2476, CAS号:84625-61-6),盐酸萘替康唑(#S4878, CAS号:130773-02-3),PI3K通路抑制剂LY294002(#S1105, CAS号:154447-36-6),NADPH氧化酶4(nicotinamide adenine dinucleotide phosphateoxidase 4,NOX4)抑制剂GKT137831(# S7171, CAS号:1218942-37-0),顺铂(#S1166, CAS 号:15663-27-1)均购于Selleck公司;胎牛血清、RPMI-1640培养基、胰酶购于Gibco公司;细胞凋亡-Hoechst染色试剂盒及Trizol购于碧云天公司;NOX4、p-Akt、Akt及β-Tubulin抗体购于Abcam公司;二抗山羊抗兔IgG购于Cell Signaling Technology公司;2,7-二氯荧光黄双乙酸盐(DCFH-DA)购于Sigma公司;Annexin V-FITC和碘化丙啶(PI)双染细胞凋亡测定试剂盒购于贝博生物公司;Rever Tra Ace逆转录酶和SYBR Green实时PCR预混液均购于TOYOBO公司;人肺鳞癌H520细胞来源于中国科学院上海细胞库;4~6周龄SPF级雌性BALB/c-nu/nu裸鼠,来源于广东省医学实验动物中心,许可证号:SCXK(粤)2018-0002.
流式细胞仪购于Thermo Scientific公司(AFC2);全波长酶标仪购于Thermo Scientific公司(1510).
1.2 实验方法
1.2.1 细胞培养
肺鳞癌H520细胞培养于RPMI-1640培养基中,培养基含有质量分数为10%的胎牛血清,置于37 ℃、体积分数为5% 的CO2标准加湿培养箱中培养.
1.2.2 MTT法检测细胞活力
用MTT法检测不同唑类抗真菌药对肺鳞癌H520细胞活力的影响.将肺鳞癌H520细胞消化并计数,以5×103/孔接种于96孔板中.细胞贴壁后,用不同唑类抗真菌药处理细胞48 h.药物干预结束后,每孔加入20 μL质量浓度为0.5 mg/mL的MTT,并在37 ℃下避光孵育4 h.吸去96孔板中液体,每孔加入二甲基亚砜150 μL,并用酶标仪在570 nm处测量每个孔的吸光度值D(570 nm).细胞活力=(D实验组-D空白组)/(D对照组-D空白组).通过GraphPad Prism 7.01软件,利用不同唑类抗真菌药下肺鳞癌H520的细胞活力计算出相应唑类抗真菌药的IC50,以筛选出效果最佳唑类抗真菌药及相应浓度.
1.2.3 DCFH-DA标记法检测活性氧水平
用DCFH-DA探针标记细胞内活性氧(reactive oxygen species,ROS)水平,检测最佳唑类抗真菌药以及与NOX4抑制剂GKT137831联用后对肺鳞癌H520细胞ROS水平的影响.将肺鳞癌H520细胞接种于60 mm培养皿中,待细胞贴壁后给予不同浓度的最佳唑类抗真菌药干预处理12 h,检测最佳唑类抗真菌药对肺鳞癌H520细胞ROS的影响.将最佳唑类抗真菌药物与浓度为20 μmol/L的 GKT137831联用,干预处理12 h,检测最佳唑类抗真菌药与GKT137831联用对肺鳞癌H520细胞ROS水平的影响.干预处理细胞后,培养皿中加入浓度为25 μmol/L的DCFH-DA,在37 ℃条件下避光孵育30 min,PBS重悬3遍,用流式细胞仪在激发波长为488 nm,发射波长为525 nm处对细胞进行分群并画门,分析不同组别细胞的平均荧光强度.
1.2.4 Hoechst染色法和Annexin V-FITC/PI双染法检测细胞凋亡
(1)Hoechst染色法检测细胞凋亡
用Hoechst染色试剂盒对细胞染色,并用荧光显微镜进行观察.将肺鳞癌H520细胞接种于含有盖玻片的6孔板中.用不同浓度的最佳唑类抗真菌药干预处理24 h后,对细胞进行固定及染色.通过荧光显微镜观察其凋亡情况,并对凋亡细胞进行统计分析.
(2)Annexin V-FITC/PI双染法检测细胞凋亡
用Annexin V-FITC/ PI双染细胞凋亡检测试剂盒染色,并通过流式细胞仪检测细胞凋亡[13].将肺鳞癌H520细胞接种于60 mm培养皿中,待细胞贴壁后给予不同浓度的最佳唑类抗真菌药干预处理24 h.药物干预结束后,用胰酶消化并收集细胞,PBS重悬2次后,加入Annexin V结合缓冲液并在避光条件下用5 μL Annexin V-FITC孵育15 min,然后加入10 μL PI避光孵育5 min,用流式细胞仪对细胞进行分群并画门,检测不同组别细胞的凋亡率.
1.2.5 RT-qPCR法检测mRNA表达
将肺鳞癌H520细胞接种于6孔板中,每孔105个细胞,待细胞贴壁后,加入不同浓度的最佳唑类抗真菌药干预处理.4 h后,使用Trizol从细胞中提取总RNA.根据说明书要求,使用ReverTra Ace逆转录酶合成互补DNA(cDNA). 使用SYBR Green实时PCR预混液在iCycler定量基因扩增仪上进行 RT-qPCR.扩增程序如下:95 ℃预变性60 s,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s,总共循环40次.以GAPDH为内参,用2-ΔΔCt来计算NOX4mRNA的相对表达量[14].本实验研究使用引物序列见表1.

表1 本研究使用的相关引物序列Table 1 Primer sequences for RT-qPCR
1.2.6 Western blotting法检测蛋白表达量
Western blotting检测细胞中p-Akt、Akt及NOX4的蛋白表达量.将肺鳞癌H520细胞接种于6孔板中,每孔105个细胞,待细胞贴壁后给予不同浓度的最佳唑类抗真菌药干预处理,药物干预结束后加入细胞裂解缓冲液与质量分数为0.5%的蛋白酶抑制剂混合物获得全细胞提取物,并通过BCA法测定蛋白质量浓度.上样后,20 V预电泳20 min,80 V电泳20 min跑浓缩胶,120 V电泳60 min跑分离胶.电泳完成后,250 mA下转膜90 min,将蛋白转移至PVDF膜.将PVDF膜置于质量分数为5%的脱脂奶粉封闭液中封闭1 h.加入稀释后的抗体p-Akt(Vp-Akt∶V抗体稀释液=1∶1 000)、Akt(VAkt∶V抗体稀释液=1∶1 000)、NOX4(VNOX4∶V抗体稀释液=1∶1 000)、β-Tubulin(Vβ-Tubulin∶V抗体稀释液=1∶1 000),4 ℃孵育过夜.用TBST洗膜3次,每次5 min.室温孵育二抗(V二抗原液∶V抗体稀释液=1∶5 000)1 h[15].通过增强的化学发光检测试剂盒检测抗体结合,使用Image J分析软件对蛋白条带的灰度值进行分析.
1.2.7 Western blotting法分析最佳唑类抗真菌药对NOX4及PI3K/Akt通路的影响
将最佳唑类抗真菌药与浓度为25 μmol/L 的PI3K/Akt通路抑制剂LY294002(LY)联用,分为对照组、最佳唑类抗真菌药组、LY组、最佳唑类抗真菌药+LY组,通过Western blotting法检测 LY294002与最佳唑类抗真菌药联用后NOX4蛋白表达量的变化,分析其对PI3K/Akt通路的影响.
1.2.8 MTT法测定协同指数
最佳唑类抗真菌药与顺铂之间的相互作用由协同指数(combination index, CI)来确定.根据最佳唑类抗真菌药和顺铂的IC50设置一系列浓度梯度的药物联用组,干预肺鳞癌H520细胞48 h,通过MTT法检测不同浓度的药物联用对肺鳞癌H520细胞的抑制率.根据Calcusyn2.0软件计算其CI值,联合作用判断依据如下:CI<1,协同作用;CI=1,相加效应;CI>1,拮抗作用.
1.2.9 裸鼠皮下成瘤实验探究最佳唑类抗真菌药体内抗肿瘤活性
将肺鳞癌H520细胞(约4×106个)皮下接种到裸鼠的右腋下处.当肿瘤体积长到80~100 mm3后将成瘤裸鼠分为4组,分别为对照组,最佳唑类抗真菌药组(50 mg/kg,2 d一次,腹腔注射给药),顺铂组(2 mg/kg,2 d一次,腹腔注射给药),最佳唑类抗真菌药+顺铂组(50 mg/kg最佳唑类抗真菌药+ 2 mg/kg顺铂,2 d一次,腹腔注射给药),每组6只.用以下公式计算肿瘤大小:肿瘤体积(mm3)=(肿瘤长度×肿瘤宽度×肿瘤宽度)×0.5,每隔一天测量一次肿瘤体积.给药28 d后,处死裸鼠收集肿瘤组织并称量肿瘤重量.最后,通过免疫组化分析肿瘤组织中p-Akt和NOX4的表达量.
1.3 统计分析
实验所得数据等计量资料均重复3次并以均数±标准差描述,应用GraphPad Prism 7.01软件,对两组间计量资料进行Student’s test检验,多组间计量资料统计采用单向方差分析(One-way ANOVA),P<0.05被认为具有统计学差异.
2 结果
2.1 唑类抗真菌药抑制肺鳞癌H520细胞活力
通过MTT法检测唑类抗真菌药在肺鳞癌H520细胞中的抑制效应.选择浓度范围为0~40 μmol/L的不同唑类抗真菌药干预肺鳞癌H520细胞48 h,结果显示,14种唑类抗真菌药对肺鳞癌H520细胞活性均有抑制作用,其中咪康唑IC50为(4.95±0.33) μmol/L,抑制效果最佳(表2).故选择咪康唑作为最佳唑类抗真菌药进行后续实验.
2.2 咪康唑对肺鳞癌H520细胞凋亡的影响
基于咪康唑的IC50值,根据药物的量效关系理论,选择一定浓度范围(0、2、4、8 μmol/L)的咪康唑干预肺鳞癌H520细胞,观察其对细胞凋亡的影响.结果显示,处理24 h后,咪康唑可呈剂量依赖性诱导肺鳞癌H520细胞凋亡(图1).
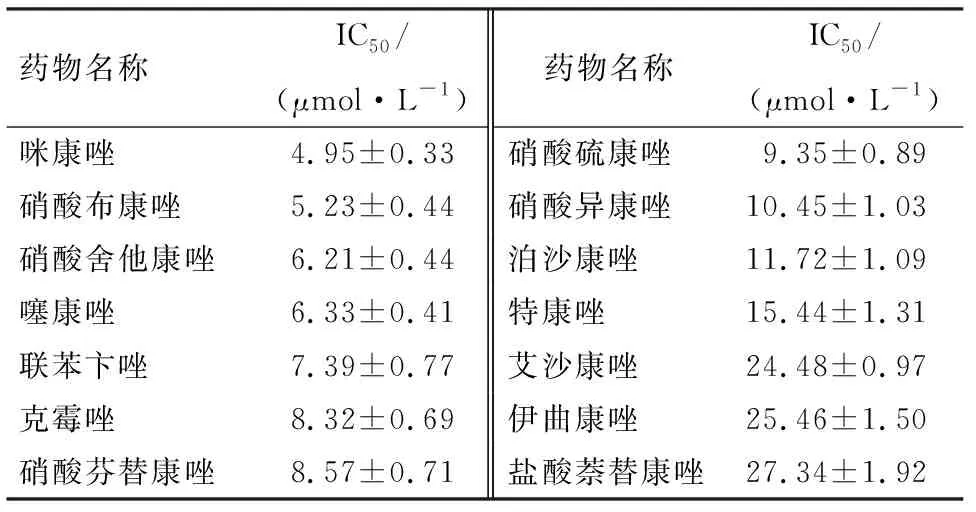
表2 不同唑类抗真菌药对H520细胞活力的影响
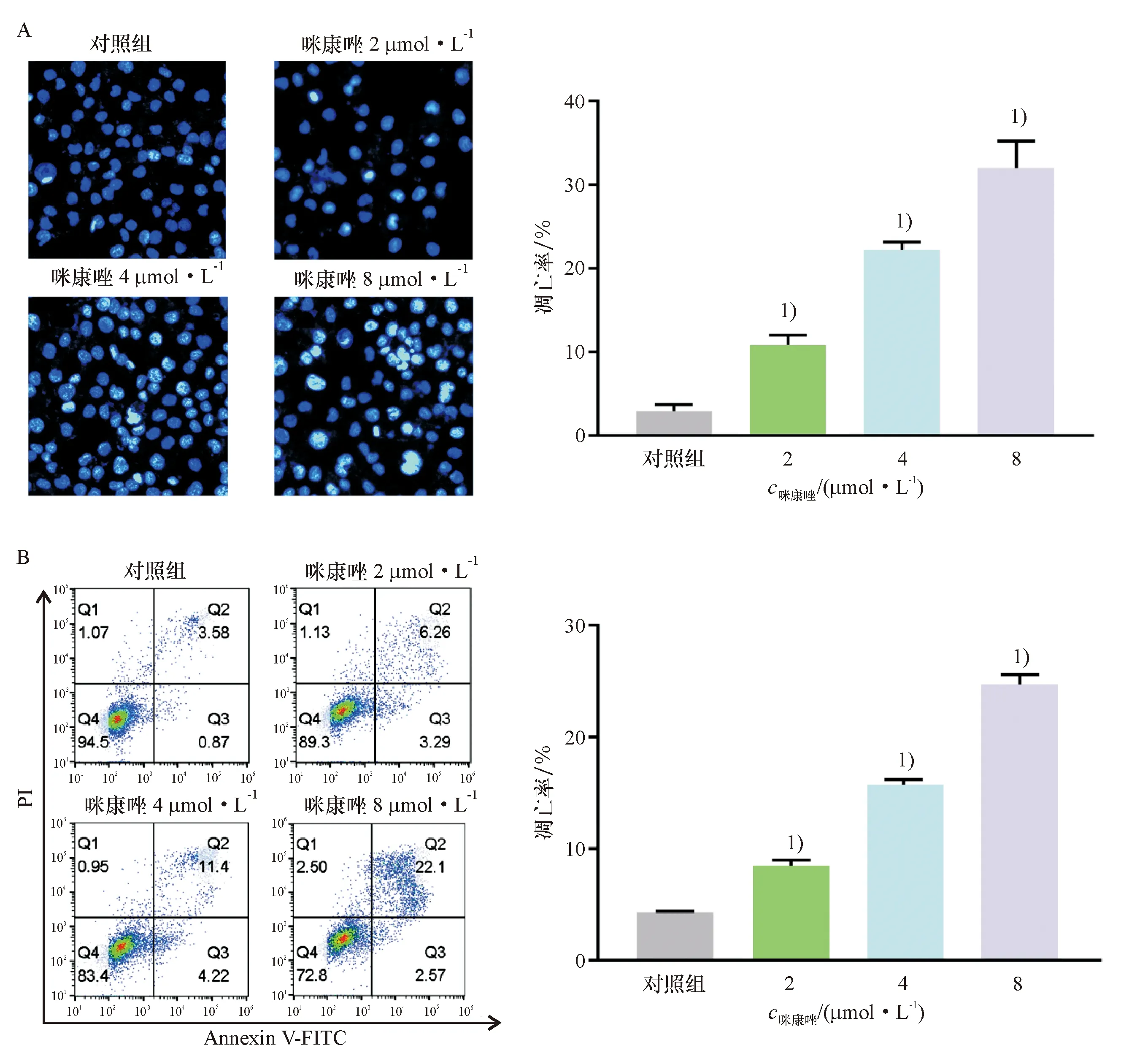
A:咪康唑干预肺鳞癌H520细胞24 h后,Hoechst染色检测细胞凋亡(×100);B:咪康唑干预肺鳞癌H520细胞24 h后,Annexin V-FITC/PI染色并用流式细胞仪检测细胞凋亡情况. 1)与对照组比较,P<0.01.
2.3 咪康唑通过降低细胞内ROS水平诱导肺鳞癌H520细胞凋亡
不同浓度(0、2、4、8 μmol/L)咪康唑干预肺鳞癌H520细胞12 h,通过流式细胞仪分析细胞中ROS水平的变化.结果显示咪康唑可剂量依赖性降低肺鳞癌H520细胞中ROS水平(图2A),并可有效降低浓度为100 μmol/L的双氧水所造成的ROS水平升高程度(图2B).后续为深入探讨咪康唑诱导肺鳞癌H520细胞凋亡的机制并有效呈现其潜在增敏化疗药物的效应,本研究选取稍低于IC50的浓度4 μmol/L作为最佳药物浓度进行下一步深入研究.结果表明,浓度为4 μmol/L的咪康唑及浓度为100 μmol/L的双氧水处理24 h后,咪康唑能够有效降低双氧水所诱导的肺鳞癌H520细胞凋亡(图2C).
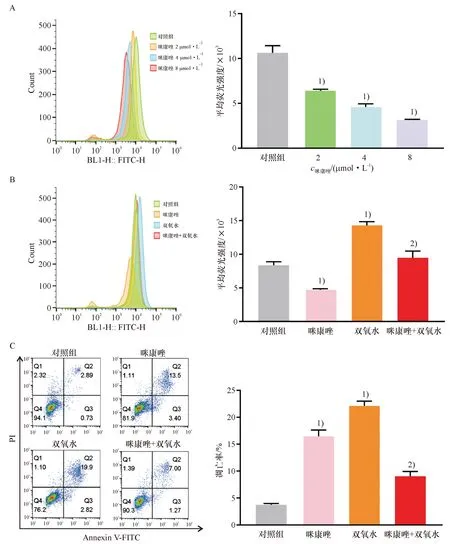
A:咪康唑处理肺鳞癌H520细胞12 h后,DCFH-DA探针标记并用流式细胞仪分析细胞内ROS水平;B:咪康唑与双氧水处理肺鳞癌H520细胞12 h后,DCFH-DA探针标记并用流式细胞仪检测细胞内ROS水平;C:咪康唑与双氧水处理肺鳞癌H520细胞24 h后,Annexin V-FITC/PI双染并用流式细胞仪检测细胞凋亡. 1)与对照组比较,P<0.01,2)与双氧水组比较,P<0.01.
2.4 咪康唑通过抑制NOX4而降低ROS水平
为进一步探讨咪康唑减少ROS的产生和诱导肺鳞癌H520细胞凋亡的机制,将不同浓度(0、2、4、8 μmol/L)的咪康唑处理肺鳞癌H520细胞4 h,采用RT-qPCR法检测NOX4 mRNA的表达.结果表明,咪康唑可剂量依赖性降低NOX4 mRNA的表达(图3A).此外,上述浓度的咪康唑处理肺鳞癌H520细胞12 h后,可显著降低NOX4蛋白表达量(图3B).
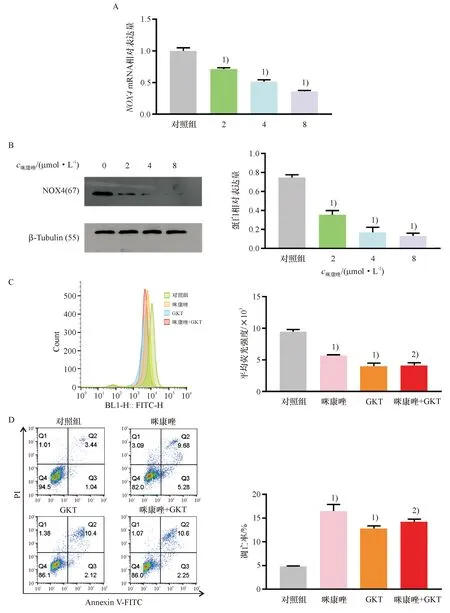
A:咪康唑处理肺鳞癌H520细胞4 h后,检测细胞中NOX4 mRNA水平的变化; B:咪康唑处理肺鳞癌H520细胞12 h后,用western blotting检测细胞中NOX4蛋白表达量的变化;C:咪康唑和GKT137831(GKT)处理肺鳞癌H520细胞12 h后,DCFH-DA标记并通过流式细胞仪检测细胞内活性氧水平;D:咪康唑和GKT137831(GKT)处理肺鳞癌H520细胞24 h后,Annexin V-FITC/PI双染并用流式细胞仪检测其对细胞凋亡的影响. 1)与对照组相比,P<0.01;2)与GKT组比较,无显著差异.
浓度为20 μmol/L的GKT137831处理肺鳞癌H520细胞12 h能有效抑制细胞内ROS水平(图3C).当浓度为20 μmol/L的GKT137831抑制NOX4活性后,浓度为4 μmol/L的咪康唑没有进一步降低ROS水平.单独使用浓度为4 μmol/L的咪康唑或浓度为20 μmol/L的GKT137831后可诱导肺鳞癌H520细胞凋亡,而咪康唑与GKT137831合用则不能进一步增加肺鳞癌H520细胞凋亡程度(图3D).上述结果表明,咪康唑可能通过抑制NOX4表达,从而减少ROS的产生,诱导肺鳞癌H520细胞凋亡.
2.5 咪康唑通过抑制PI3K/Akt通路而抑制NOX4表达
不同浓度(0、2、4、8 μmol/L)的咪康唑处理肺鳞癌H520细胞6 h,结果显示,咪康唑可剂量依赖性降低p-Akt蛋白表达量,总Akt蛋白表达量不变,表明咪康唑可抑制该通路活性(图4A).在肺鳞癌H520细胞中单独添加浓度为25 μmol/L的LY294002或浓度为4 μmol/L的咪康唑,12 h后,两者均可使NOX4蛋白含量下降,但是两药合用后,NOX4蛋白表达量与单独使用LY294002后相比,无统计学差异(图4B).以上结果提示,咪康唑可能通过抑制PI3K/Akt通路降低NOX4表达量.
2.6 咪康唑增敏顺铂并诱导肺鳞癌H520细胞凋亡
上述结果证明,咪康唑可抑制肺鳞癌H520细胞p-Akt表达量,所以推测其可抵抗顺铂所造成的p-Akt表达升高,从而增加顺铂的抗癌活性.如图5A所示,顺铂处理肺鳞癌H520细胞48 h后,可剂量依赖性抑制肺鳞癌H520细胞存活率,且IC50为(5.66±0.13) μmol/L. 4 μmol/L顺铂和2 μmol/L咪康唑及二者联用干预肺鳞癌H520细胞6 h,结果显示,单独使用咪康唑能有效抑制Akt磷酸化,而单独使用顺铂,则升高Akt磷酸化水平.两药联用后,咪康唑能有效减少顺铂所致的Akt磷酸化水平升高(图5B).
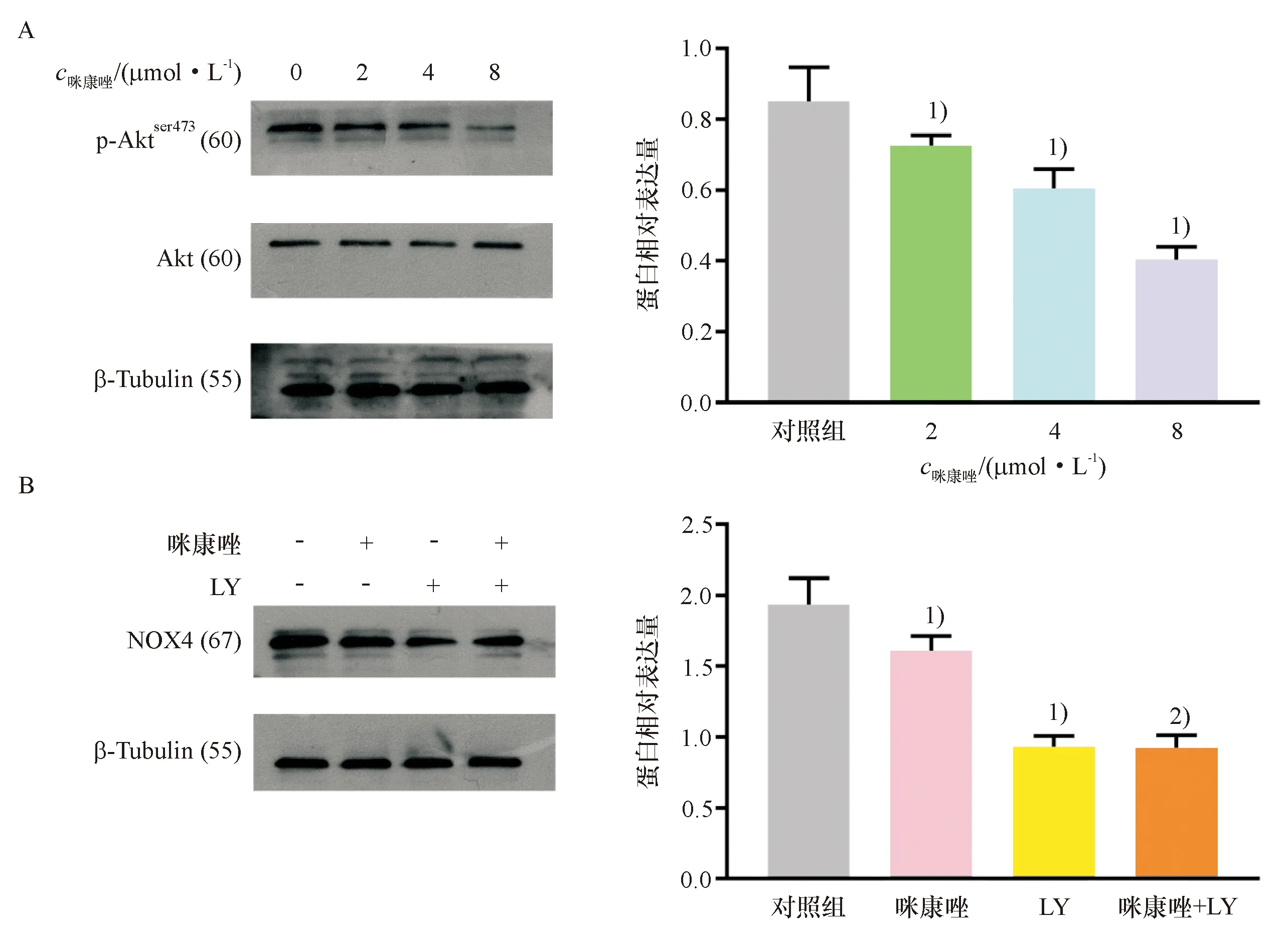
A:咪康唑处理肺鳞癌H520细胞6 h后,western blotting检测细胞中p-Akt蛋白表达的变化;B:咪康唑和LY294002(LY)处理肺鳞癌H520细胞12 h后,western blotting法检测细胞中NOX4表达的变化.1)与对照组比较,P<0.01,2)与LY组比较无显著差异.
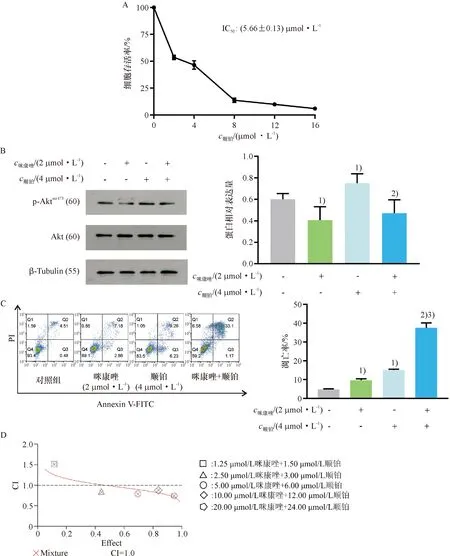
A:顺铂处理肺鳞癌H520细胞48 h后,通过MTT法检测细胞活力;B:咪康唑和顺铂处理肺鳞癌H520细胞6 h后,通过western blotting检测p-Akt蛋白表达量的变化;C:咪康唑和顺铂处理肺鳞癌H520细胞24 h后,用Annexin V-FITC/PI双染并通过流式细胞仪检测其对凋亡的影响;D:不同浓度咪康唑与不同浓度顺铂联合用药48 h后的协同指数CI.1)与对照组比较,P<0.05;2)与顺铂组比较,P<0.05;3)与咪康唑组比较,P<0.01.
药物处理24 h后,2 μmol/L咪康唑与4 μmol/L顺铂均能诱导肺鳞癌H520细胞凋亡,联合使用后,凋亡率显著高于两药单独使用时(图5C).根据咪康唑与顺铂在肺鳞癌H520细胞的IC50值,药物联用的系列浓度设定为:对照组; 1.25 μmol/L咪康唑+1.5 μmol/L顺铂组;2.5 μmol/L咪康唑+3 μmol/L顺铂组;5 μmol/L咪康唑+6 μmol/L顺铂组;10 μmol/L咪康唑+12 μmol/L顺铂组;20 μmol/L咪康唑+24 μmol/L顺铂组.联合处理肺鳞癌H520细胞48 h后可得分数效应与组合指数曲线.随着联合给药的浓度增加,药物协同指数从2.5 μmol/L咪康唑+3 μmol/L顺铂组开始均小于1,表明3~24 μmol/L顺铂联合2.5~20 μmol/L咪康唑可对肺鳞癌H520细胞增殖抑制效果存在协同效应(CI<1).
2.7 咪康唑体内抑制肿瘤生长
经过28 d给药后,3个给药组均可抑制肿瘤生长(图6 A、B、C),咪康唑与顺铂联用较单独用药抑瘤效果显著增强.使用NOX4和p-Akt抗体分别对裸鼠皮下肿瘤进行免疫组化分析的结果所示,与对照组相比,咪康唑处理组中NOX4和p-Akt表达量显著降低,且咪康唑能减少顺铂使用后p-Akt的表达量升高(图6 D、E).
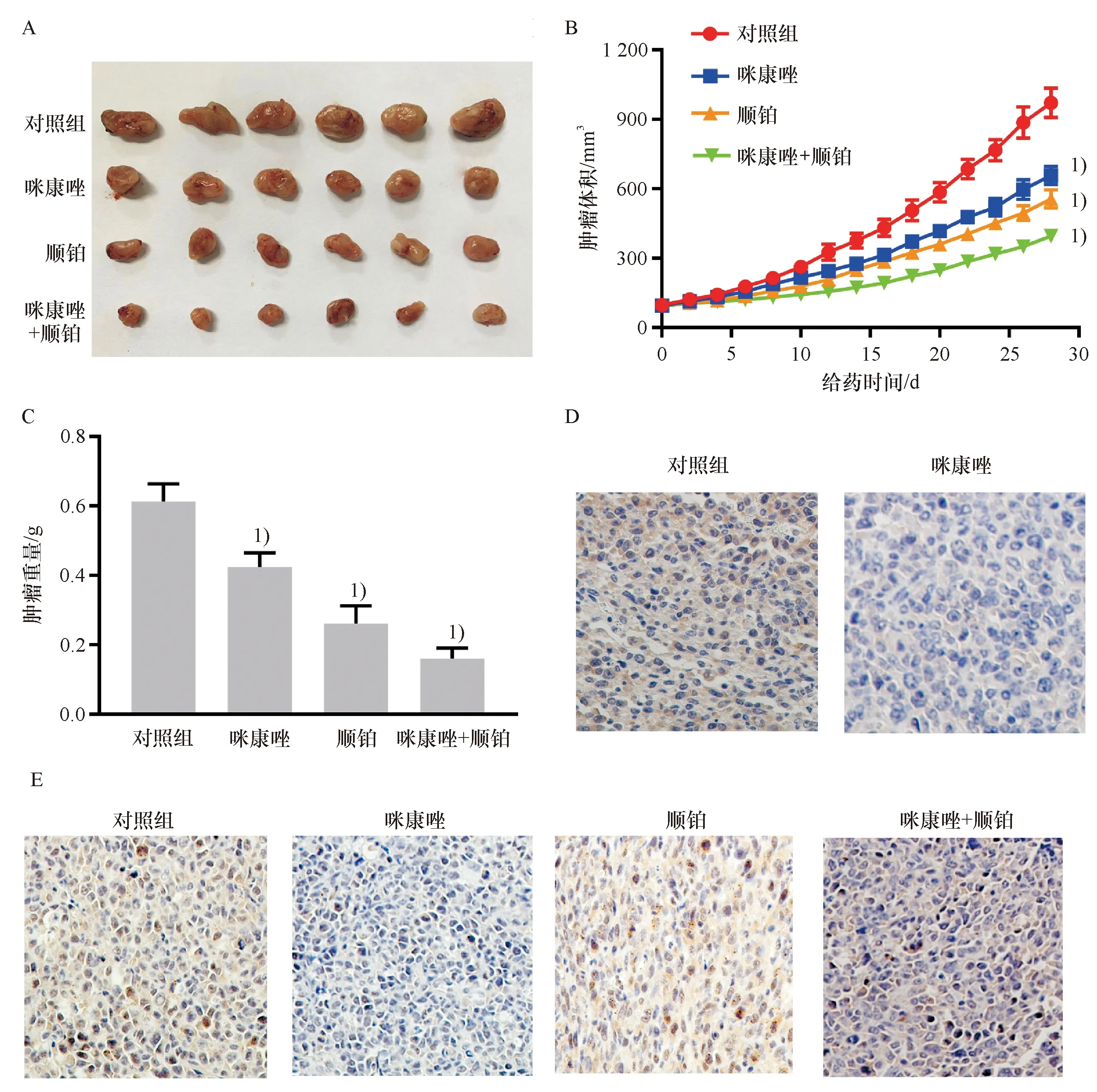
A-C:裸鼠皮下肿瘤经过咪康唑和顺铂处理28 d后的体积及重量;D:裸鼠皮下肿瘤经过咪康唑和顺铂处理28 d后,通过免疫组化检测其对NOX4蛋白含量的变化(×200);E:裸鼠皮下肿瘤经过咪康唑和顺铂处理28 d后,通过免疫组化检测其对p-Akt蛋白含量的变化(×200). 1)与对照组比较,P<0.01.
3 讨论
由于化疗时间长,免疫系统衰弱,癌症患者常发生真菌感染.因此,在临床治疗中,抗癌药与抗真菌药发挥不可或缺的作用[16].唑类药物(三唑和咪唑衍生物)广泛用于治疗浅部和深层真菌感染[17].既往研究已证实几种唑类抗真菌药在多种癌症中具有抗癌作用.在本研究中,通过筛选一系列唑类抗真菌药,发现咪康唑对肺鳞癌H520细胞的活性抑制效果最好,其IC50最低.
ROS作为信号分子参与许多癌症生物学过程.与正常细胞相比,癌细胞通常具有较高水平的ROS,这对于癌细胞增殖及凋亡抵抗起着重要作用[18].因此,通过干预ROS水平破坏氧化还原平衡可能是治疗癌症的有效途径.许多药物已被证明通过下调ROS可诱导癌细胞凋亡[19].本研究中,咪康唑通过抑制ROS的产生诱导肺鳞癌H520细胞凋亡.进一步实验发现,咪康唑能显著抑制NOX4的表达,继而导致肺鳞癌H520细胞的ROS减少,提示咪康唑可能通过抑制NOX4的表达,进一步破坏细胞内ROS平衡,最终诱导肺鳞癌H520细胞凋亡.
NOX的生物学功能主要是产生超氧化物(O2-)或过氧化氢(H2O2).它们由七个成员组成,代表不同的催化亚基: NOX1、NOX2、NOX3、NOX4、NOX5、Duox1和Duox2. NOX已被证实与许多疾病相关,尤其是癌症[20].NOX4在癌细胞中的表达受PI3K/Akt通路调控.本研究发现抑制PI3K/Akt通路是咪康唑降低肺鳞癌H520细胞中NOX4表达的原因.然而,顺铂可以增加磷酸化Akt的表达量,从而减少其细胞毒性作用[21-22].抑制PI3K/Akt活性可以增强多种肿瘤细胞对顺铂的敏感性[23-24].本研究发现,咪康唑可以抵消顺铂对肺鳞癌H520细胞PI3K/Akt活性的增强作用,且咪康唑可以增加顺铂对肺鳞癌H520细胞的毒性.因此,咪康唑有可能作为一种具有广阔发展前景的新型肺鳞癌辅助化疗药物.
本研究中,咪康唑在体内对肿瘤的抑制作用与顺铂相当,联合治疗明显优于单一药物治疗.免疫组化数据显示,咪康唑降低NOX4的表达,减少顺铂对肿瘤组织p-Akt活性的增强作用.综上所述,咪康唑可通过抑制PI3K/Akt/NOX4通路,减少细胞内ROS从而诱导肺鳞癌H520细胞凋亡并增敏顺铂.因此,咪康唑可能是肺鳞癌辅助治疗的一个有前景的候选药物.
