血肌酐与胱抑素C比值在非酒精性脂肪性肝病中的临床意义
2021-05-14李少博杨迪叶雅芬韩峻峰
李少博, 杨迪, 叶雅芬, 韩峻峰
(上海交通大学附属第六人民医院内分泌代谢科, 上海 200233)
非酒精性脂肪性肝病(NAFLD)是指排除酒精和其他明确损肝因素导致的肝脏脂肪过度堆积为特征的疾病[1],目前人群NAFLD患病率超过25%,代谢综合征人群中可高达60%~70%。NAFLD与糖脂代谢紊乱乃至心脑血管事件密切相关,并增加肝炎、肝硬化、肝癌风险[2],严重危害人类健康,但目前尚无批准用于治疗NAFLD的药物。因此,及早确定NAFLD高风险人群并针对性采取干预措施以预防疾病进展具有重要临床意义。
最近研究报道, 骨骼肌量与内脏脂肪面积之比降低是中重度肝脂肪变和进展期肝纤维化的独立危险因素[3]。一些纵向研究进一步表明,相对肌肉量减少与NAFLD风险增加密切相关[4]。肌肉减少会增加胰岛素抵抗,并加重内脏脂肪堆积,这些均是导致NAFLD发生的重要危险因素[5],因此量化肌肉量可能是早期筛查NAFLD高风险人群的有效方法。目前可以通过计算机断层扫描、生物电阻抗等多种手段量化肌肉量,但由于需要特殊的设备且价格昂贵,这些均难以作为临床常规筛查手段[6]。在此基础上,血肌酐与胱抑素C比值(creatinine-to-cystatin C ratio,CCR)作为相对肌肉量标志物的有效性得到验证[7-9]。目前关于CCR与NAFLD的关系国内外尚无报道,本研究旨在探讨CCR在早期识别NAFLD高风险人群中的临床应用价值。
1 资料和方法
1.1 研究对象
回顾性选取2019年5月至2020年9月于上海交通大学附属第六人民医院减重代谢科住院并接受腹部超声检查的超重或肥胖患者162例(BMI≥24 kg/m2),纳入同期正常BMI受试者64例(18.5~24 kg/m2),其中男性78例,女性148例,平均年龄(31.83±9.21)岁。纳入标准:年龄>18岁,资料完整,性别不限,种族不限。排除标准:① 肾功能不全(血肌酐高于105 μmol/L或肾小球滤过率低于60 mL/min)或接受血液透析;② 饮酒(男性>140 g/周,女性>70 g/周)、病毒、遗传、免疫或药物相关肝病[10];③ 缺少重要的研究数据,例如年龄、性别、血肌酐和半胱氨酸蛋白酶抑制剂C浓度等;④ 妊娠或正在使用免疫抑制剂等特殊药物;⑤ 恶性肿瘤或重要脏器严重疾病者。本研究通过本院伦理委员会批准且所有受试者均已签署知情同意书。
1.2 研究方法和分组
每名受试者均接受全面的体格检查和血清学测定。体格检查包括身高、体重、腰围、血压等,身高精确到0.1 cm,体重精确到0.1 kg,腰围为髂嵴与肋骨之间最小周长,测量精确到0.1 cm,仰卧位休息5 min后水银血压计监测血压。隔夜进食至少10 h后,肘前静脉抽取血样,室温静置半小时,然后4 000 r/min离心10 min,收集上清液,使用全自动生化分析仪器 (Beckman,美国)检测血糖、血清脂质、肝酶、肾功能等,电化学发光免疫分析法测定空腹胰岛素和C肽浓度,免疫比浊法测定血清胱抑素C水平(参考范围0.40~1.10 mg/L), 采用肌氨酸氧化酶法检测血清肌酐含量(参考范围为53.00~115.00 μmol/L)。
CCR=血清肌酐(μmol/L)/胱抑素C(mg/L)。考虑到既往研究中CCR水平的男女性别差异[11],根据性别分别行三分位分组,其中男性低分位数组(51.67~80.00),中分位数组(80.00~105.00),高分位数组(105.71~170.00);女性低分位数组(43.75~70.00),中分位数组(71.43~97.14),高分位数组(98.00~167.50)。
1.3 NAFLD的诊断
所有受试者均接受肝脏超声检查,依据中华医学会肝脏学分会制定的《非酒精性脂肪性肝病诊疗指南》中的B超标准[10],具备以下2项及以上即可诊断为脂肪肝:① 肝近场回声弥漫性增强(“明亮肝”),回声强于肾脏;② 肝内管道显示不清,血管模糊;③ 肝远场回声逐渐减弱。
1.4 统计学方法
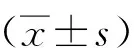
2 结果
2.1 研究对象一般临床资料
226例入组受试者中,男性78例(34.51%),女性148例(65.49%)。总受试者中NAFLD的患病率为72.12%(163/226),无论男性还是女性NAFLD患者的CCR水平均明显低于非NAFLD受试者(图1)。与此一致,CCR低分位数组NAFLD患病率显著高于中分位数组和高分位数组(P<0.01)。随着CCR水平的增加,BMI、腰围、收缩压、舒张压、空腹血糖、餐后2 h血糖(2hPG)、糖化血红蛋白(HbA1c)、空腹C肽、胰岛素抵抗指数(HOMA-IR)、三酰甘油、AST、ALT、γ-GT显著降低,而HDL-C显著增加,差异均具有统计学意义。见表1。

*:P<0.01,与非NAFLD比较图1 NAFLD人群与非NAFLD人群CCR均值比较
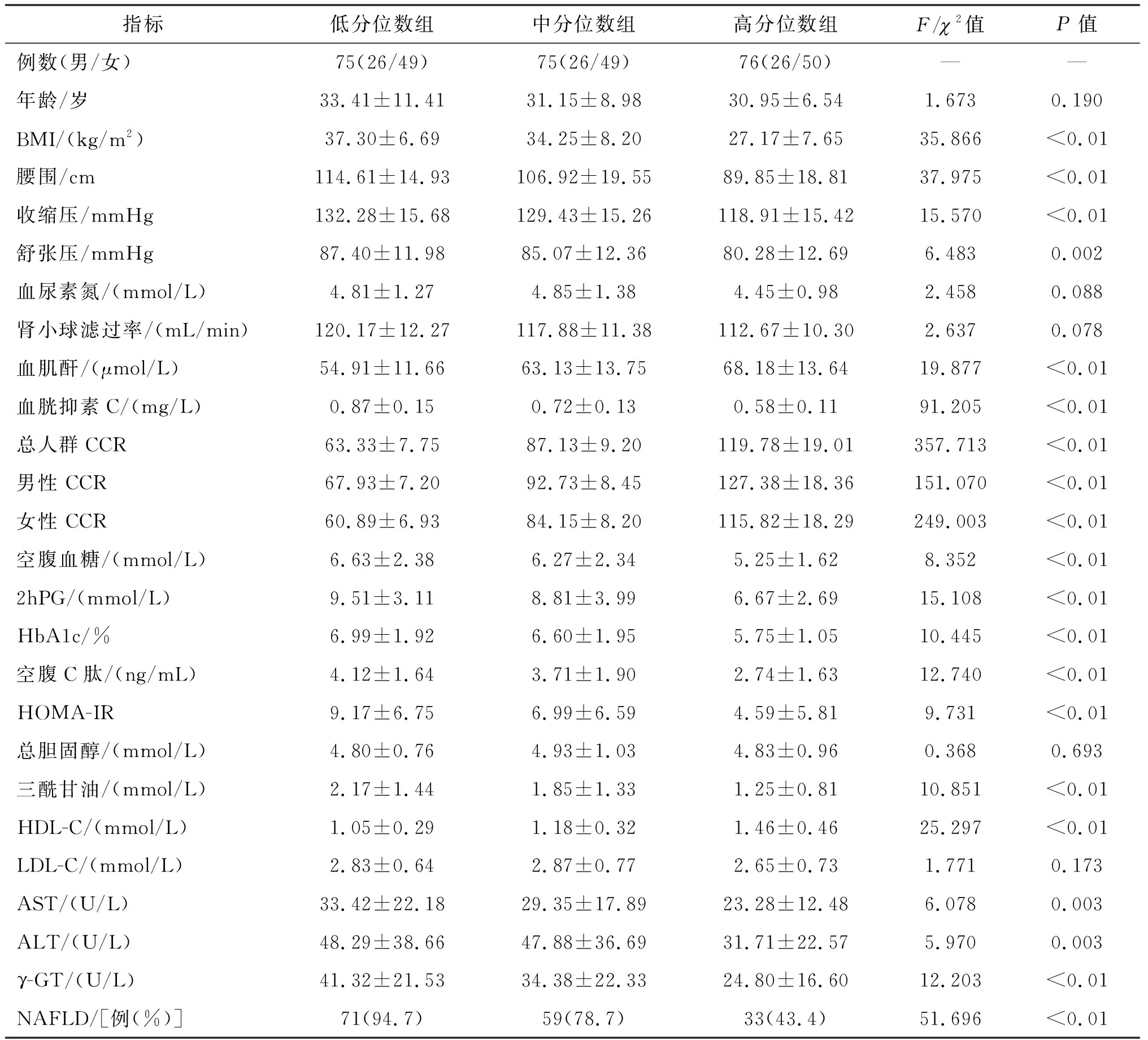
表1 研究对象按照CCR三分位数分组后的一般临床资料
2.2 CCR与NAFLD致病因素的相关性分析
无论男女,CCR水平与空腹血糖、HbA1c、HOMA-IR、AST、γ-GT、三酰甘油、尤其BMI(男性:r=-0.584,女性:r=-0.463,P<0.01)及腰围(男性:r=-0.562,女性:r=-0.514,P<0.01)呈显著负相关,与HDL-C呈显著正相关,与年龄、总胆固醇、LDL-C无明显相关。见表2。
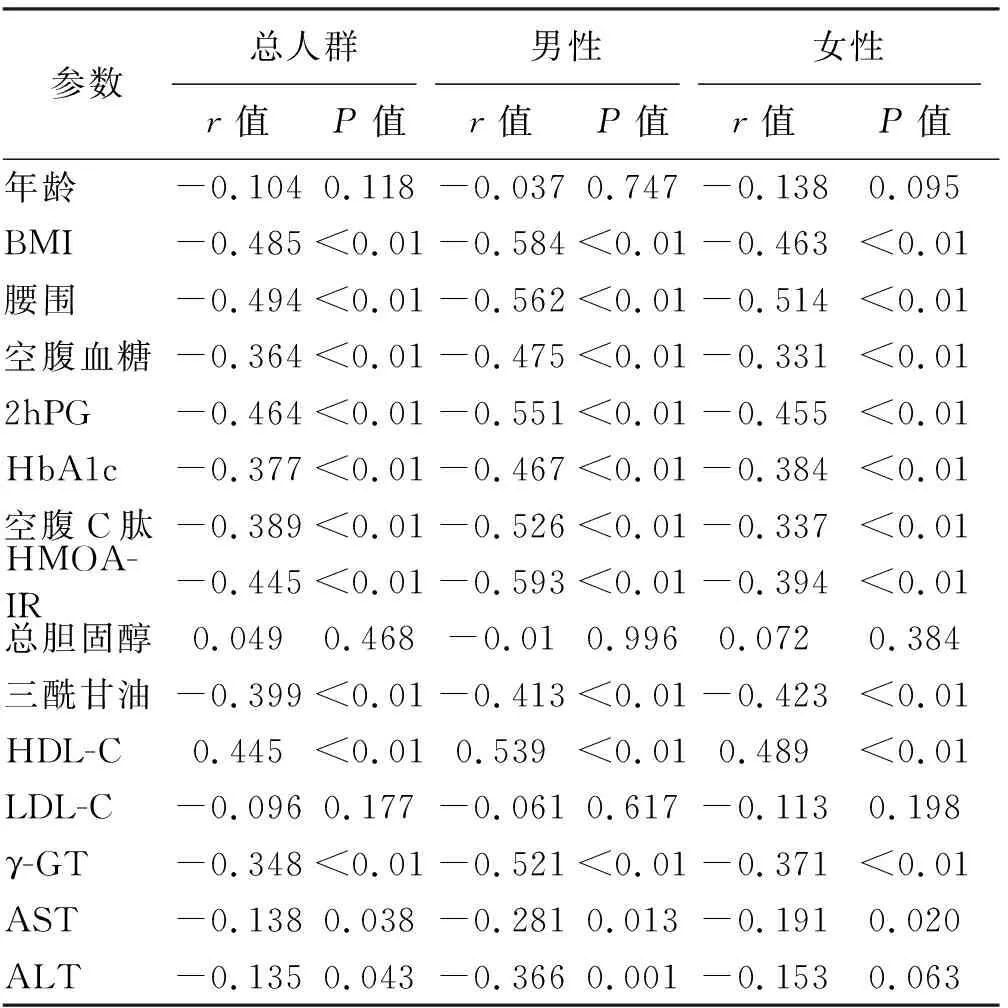
表2 CCR与NAFLD致病因素的相关性分析
2.3 CCR与NAFLD发生风险的Logistic回归分析
结合表1,以CCR高分位数组作为参照,采用Logistic回归模型分析不同CCR水平对NAFLD发生的致病风险。结果显示,在未校正模型中,中分位数组发生NAFLD的OR值4.805(95%CI:2.351~9.820),低分位数组为23.129(95%CI:7.663~69.805)。在分别调整性别、年龄、糖脂代谢指标后(模型3),中分位数组OR值为2.722 (95%CI:1.078~6.875),低分位数组OR值为5.096(95%CI:1.439~18.051),仍有显著统计学差异(P<0.05)。见表3。以上结果表明CCR低水平是NAFLD发生的重要独立风险因素。
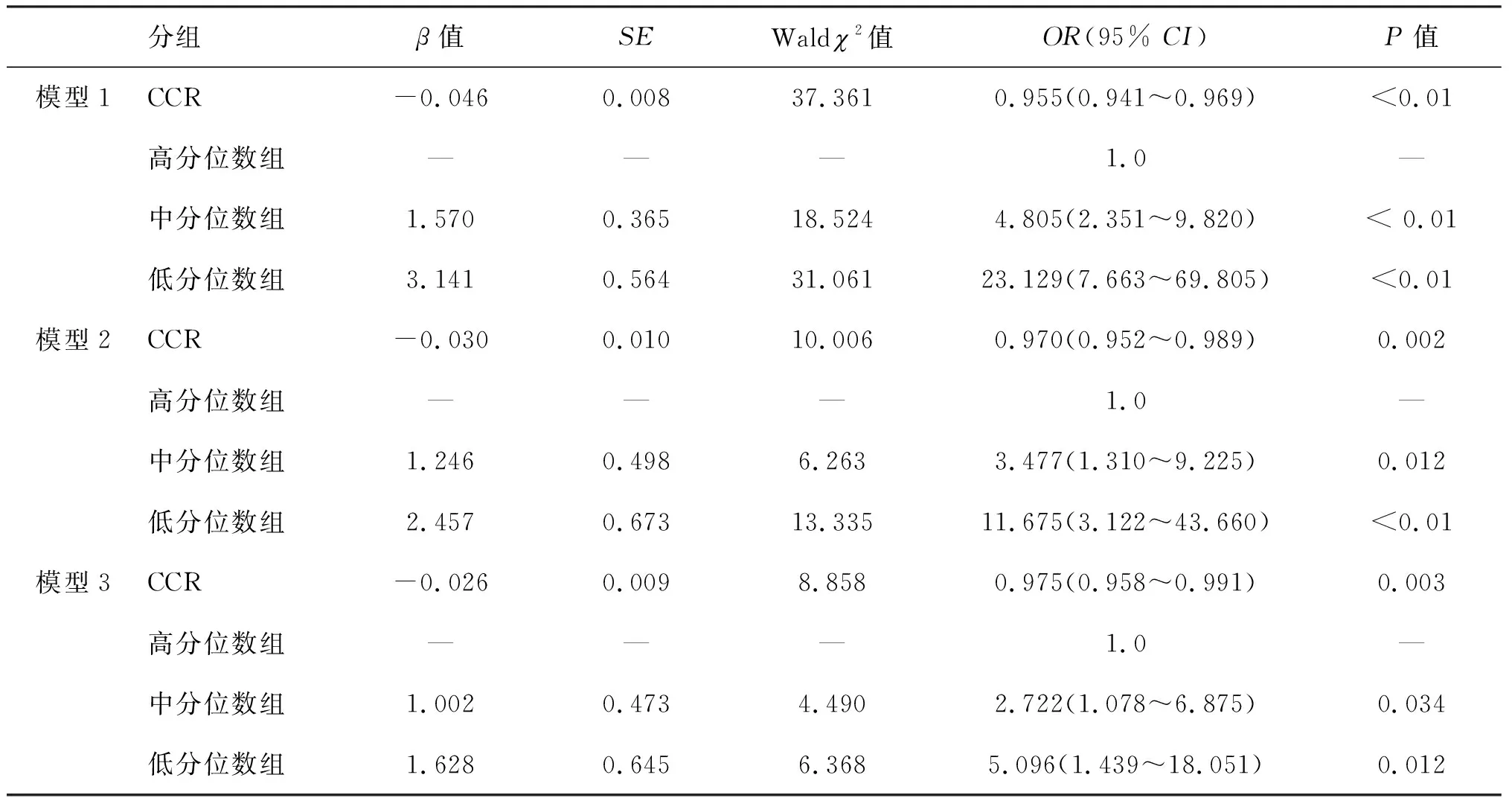
表3 CCR预测NAFLD发生风险的Logistic回归分析结果
2.4 CCR用于筛查NAFLD高风险人群的ROC曲线分析
为了明确CCR用于筛查NAFLD高风险人群的切点水平,按照不同性别进行ROC曲线分析,结果如图2。男性群体曲线下面积(AUC)为0.865 (95%CI: 0.769~0.932,P<0.01), 切点为94.44,敏感度和特异度分别为68.0%和100%;女性人群AUC为0.806(95%CI: 0.733~0.866,P<0.01), 切点为91.43,敏感度和特异度分别为73.1%和79.6%;为提升临床应用价值,当男性CCR≤58.75或女性CCR≤51.11时,用于筛查NAFLD高风险人群的敏感度可达到95%。

图2 CCR用于筛查NAFLD高风险人群的ROC曲线分析
3 讨论
本研究为探讨NAFLD和CCR之间关系的首项中国人群研究,分析结果显示较低CCR水平的人群NAFLD患病风险显著增加,即使在调整了与NAFLD有关的血清学指标后这种关联仍然十分明显,ROC曲线分析显示CCR在男性组和女性组的AUC均大于0.8,用于识别NAFLD的男性人群切点为94.44,女性为91.43,约登指数均大于0.5。这表明CCR可以作为筛查NAFLD高风险人群的简易、廉价、无创的有效血清学指标。
本研究中,CCR与BMI、腰围、HOMA-IR等肥胖指标显著负相关,CCR低三分位组的人群表现出最明显的一系列肥胖代谢特征。既往的研究报道,脂肪组织增加肥胖个体胱抑素C表达,血清分泌水平显著升高[11],本研究结果与其相一致。胱抑素C表达于所有有核细胞,由肾小球滤过,它不受肌肉量的影响。而肌酐是肌肉分解代谢产物,其生成与肌肉量呈正比,但其血清浓度随肾功能差异而变化,因此不能在临床实践中评估肌肉量[12]。在这种背景下,最近CCR被作为评价相对肌肉量的有效血清学指标,用以反映肌肉和脂肪相对比例,并在2型糖尿病老年人群中筛查肌肉减少症患者[7]。值得一提的是,在本组病例中并没有观察到年龄和CCR的相关性,这与先前的报道不一致[13],这可能是由于人群选择的异质性,本组病例以中青年人群为主。近年来,一些研究通过生物电阻抗评估身体成分,结果显示肥胖个体具有较低的骨骼肌质量与内脏脂肪面积之比,同时该比值与BMI、腰围、HMOA-IR等临床或代谢指标负相关[3, 14]。这与本研究结果相一致,因此我们推断CCR可能是反映骨骼肌质量与内脏脂肪面积之比的有效血清学替代指标。
最近来自日本的一项横断面研究报道,骨骼肌质量与内脏脂肪面积之比降低可显著增加中重度脂肪变性和晚期纤维化风险[3]。一些纵向研究进一步表明,该比值增加与肝脂肪堆积和肝损伤改善密切相关[15-16]。类似地,本研究中CCR与AST、γ-GT呈显著负相关,低水平CCR是NAFLD发生的独立危险因素,并且可以有力预测NAFLD的发生。对此可能的解释是CCR的两个主要因素肌肉和脂肪与能量代谢和胰岛素抵抗密切相关[17-18],这与本研究中CCR与HOMA-IR显著负相关相一致;其次,骨骼肌减少和内脏脂肪增加与慢性炎症反应、氧化应激和体育活动减少有关[19],这些均是NAFLD的致病机制。值得关注的是,尽管肥胖与NAFLD的发生密切相关,但中国非肥胖人群中五分之一患有NAFLD[20],进一步探究非肥胖NAFLD人群CCR特点可能有助于进一步理解其病理生理学机制。目前,饮食与运动相结合的生活方式干预仍然是NAFLD的主要治疗方法[21],需要进一步研究生活方式干预与CCR之间的关系。
相比MRI、CT、生物电阻抗等技术手段,本研究通过血液采样获得的CCR指标可以更低成本地评估相对肌肉含量,这对于重复监测患者NAFLD风险变化具有重要意义。然而,本研究仍存在一些局限性。首先,本研究基于横断面分析,只是提供了有价值的线索,尚不能确定CCR水平与NAFLD发生的因果关系,将来可进行前瞻性研究证实。其次,肉类食物摄入、运动习惯以及服用西咪替丁等药物[22],可能会增加肌酐水平。但对CCR影响轻微,不足以改变研究结果。最后,尽管诊断NAFLD的金标准是肝活检,但为有创性检查,不能反复进行,且获取组织的代表性有限。而超声作为临床广泛使用的筛查工具,积累了丰富的经验,特别是对于中重度脂肪变性具有很高的敏感性和特异性,也得到了相关指南的推荐。
总之,较低的CCR水平与NAFLD风险增加独立相关,可以作为早期识别NAFLD高风险人群的新型血清学指标。此外,本研究为明晰“肌肉在NAFLD发生中的作用”提供了新的证据,深入挖掘该领域的参与分子,有助于揭示NAFLD的潜在预防和治疗措施。
