腰椎关节突关节炎模型大鼠背根神经节中β-1,4-GalT-I和TNF-α的表达及意义
2021-05-14徐大伟崔胜宇薛鹏飞朱新辉刘巍崔志明
徐大伟, 崔胜宇, 薛鹏飞, 朱新辉, 刘巍, 崔志明
(南通大学第二附属医院骨科, 江苏 南通 226001)
腰椎关节突关节引起的疼痛是成年人下腰痛的常见原因,约占所有下腰痛的15%~45%[1]。腰椎关节突关节引起的下腰痛原因是早期因腰椎关节突关节重复性应力和(或)累积的轻度外伤,逐渐演变成关节软骨退变和关节炎症,最终导致腰腿痛[2-3]。临床研究表明,腰椎关节突关节软骨和滑膜含有炎性细胞因子,并且细胞因子水平与腿部症状的程度相关[2,4]。实验研究表明,腰椎关节突关节的炎症会增加背根神经节(dorsal root ganglia,DRG)中炎症细胞因子的表达,当炎症细胞因子与神经根接触时,神经组织发生病理性变化,表现出行为缺陷[3]。β-1,4-半乳糖基转移酶-I(β-1,4-GalT-I)是关键的炎症介质,参与疾病中炎症反应的发生和维持。当机体缺失β-1,4-GalT-I时,白细胞膜上的糖蛋白缺少β4-N-乙酰乳糖胺结构,导致急、慢性炎症反应降低,浸润到炎症部位的中性粒细胞减少[5]。有研究报道β-1,4-GalT-I参与了中枢和周围神经损伤后的炎症过程[6]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是周围炎症反应的重要介质,并且在各种神经疾病中也有合成和释放,与神经源性疼痛有关[7]。本研究旨在探讨β-1,4-GalT-I和TNF-α在腰椎关节突关节炎(lumbar facet arthritis,LFA)模型大鼠DRG中的表达变化及意义。
1 材料与方法
1.1 主要材料
雄性SD大鼠54只(南通大学实验动物中心),体重(220~275)g。弗氏完全佐剂、小鼠抗GAPDH和神经胶质纤维酸性蛋白(GFAP)单克隆抗体(美国Sigma公司),纤维蛋白胶(上海莱士公司),Von Frey纤维丝刺激针(美国Stoelting公司),PVDF膜(美国Millipore公司),山羊抗β-1,4-GalT-I单克隆抗体(美国Santa Cruz公司),兔抗TNF-α单克隆抗体(英国Abcam公司),兔抗p-ERK、p-JNK和p-P38单克隆抗体(美国Cell Signaling公司),小鼠抗神经元(NeuN)单克隆抗体(美国Chemicon公司)。
1.2 动物模型
54只雄性SD大鼠随机分为对照组和实验组。按造模后取材时间将实验组分为12 h,1 d,3 d,5 d,7 d,14 d和28 d等7个小组(每小组6只)。制备大鼠LFA模型(n=42):向大鼠腹腔内注射复合麻醉剂(0.2 mL/100 g),将大鼠俯卧位固定于实验台上。严格无菌操作下,首先在脊柱棘突正中线做一切口,沿左侧的棘上韧带切开筋膜约20 mm,再在显微镜下,切除附着于L5棘突的多裂肌,显露左侧L5-L6的关节突关节囊,在关节囊上做一个约3 mm的切口,向关节囊内注入1.2 μL弗氏完全佐剂,关节囊上的切口立刻用纤维蛋白胶密封,以防止佐剂泄漏,然后关上筋膜和皮肤切口。对照组(n=12):左侧L5-L6的关节突关节囊切开后,立即用纤维蛋白胶密封,不做其他的操作即关闭切口。大鼠室温饲养,自由饮食。于术后各相应时间点,再次麻醉大鼠,取手术侧节段对应DRG[3]。
1.3 机械性缩足阈值测定
通过确定大鼠足底对Von Frey纤维丝刺激针的缩回反应,测试大鼠对非有害机械刺激的敏感性。先将大鼠放置具有金属丝网底部的塑料笼中适应约15 min。将细丝以足够的压力施加到左侧L5神经支配的左足外侧足底上,使其弯曲并保持6 s。如果大鼠在使用给定的细丝后没有缩足,则以相同的方式测试下一档较高的细丝。当大鼠确定缩足时,则测试上一档较低的细丝,间隔几秒钟刺激1次。
1.4 蛋白质印迹测定β-1,4-GalT-I、TNF-α和MAPK信号通路相关蛋白水平
取实验组LFA大鼠(12 h,1 d,3 d,5 d,7 d,14 d和28 d)和对照组大鼠DRG组织,提取蛋白质。蛋白样品各50 μg上样,进行SDS-PAGE,分离的蛋白用PVDF膜以350 mA转膜2.5 h,所得PVDF膜用5%脱脂奶粉封闭2 h,然后加入一抗:β-1,4-GalT-I、TNF-α、p-ERK、p-JNK、p-P38和GAPDH抗体(稀释比均为1 ∶1 000),4℃孵育过夜,再用辣根过氧化物酶标记的二抗孵育,ECL发光、显影、定影。
1.5 免疫荧光双标检测β-1,4-GalT-I/TNF-α与NeuN/GFAP的共定位
于手术后第5天,用复合麻醉剂腹腔麻醉大鼠后开胸,经左心室向升主动脉插管后,先灌入洗涤液(生理盐水)200~300 mL,再灌进固定液(4%多聚甲醛)300~500 mL。取左侧L5DRG浸于固定液中,20%、30%蔗糖依次梯度脱水。包埋横切,冰冻切片机连续切片,厚度6 μm。以封闭血清37℃孵育切片2 h,分别用封闭液稀释的一抗:β-1,4-GalT-I、TNF-α抗体(1 ∶100),NeuN抗体(1 ∶600)和GFAP抗体(1 ∶200),4℃孵育过夜,PBS洗涤后,加入FITC和TRITC偶联的二抗,4 ℃孵育2 h,封片后于荧光显微镜下观察。
1.6 统计学处理
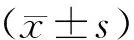
2 结果
2.1 机械性缩足阈值测定结果
机械性缩足阈值测定结果表明,各时间点机械性缩足阈值总体差异有统计学意义(F=5.138,P<0.05)。与对照组相比,实验组LFA大鼠在第3、5和7天的机械阈值明显降低(均P<0.05,图1),第5天降低最为明显。
n=6;*:P<0.05,与对照组相比图1 机械性缩足阈值测定结果
2.2 LFA大鼠DRG中β-1,4-GalT-I和TNF-α的表达
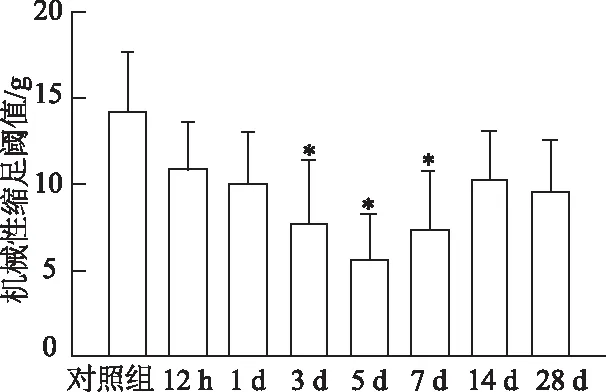
蛋白质印迹结果表明,各时间点β-1,4-GalT-I和TNF-α蛋白水平总体差异均有统计学意义(F值分别为143.802、166.235,均P<0.05)。实验组第3、5和7天β-1,4-GalT-I和TNF-α蛋白水平均较对照组明显升高(均P<0.05),并在第5天达到峰值,然后逐渐恢复到正常水平(图2)。数据结果显示,β-1,4-GalT-I和TNF-α蛋白水平在实验组LFA大鼠DRG中有一个暂时的上调,表明它们可能参与了LFA大鼠DRG的炎症反应过程。
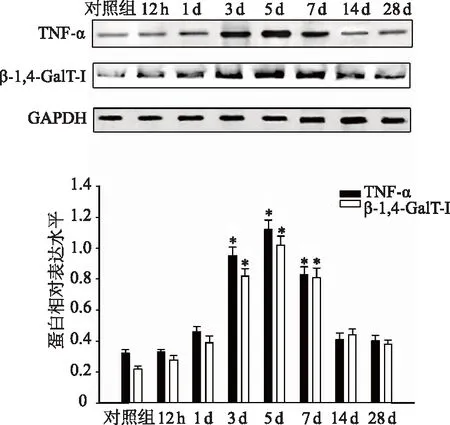
n=3; *:P<0.05,与对照组相比图2 LFA大鼠DRG中β-1,4-GalT-I和TNF-α的表达
2.3 β-1,4-GalT-I和TNF-α在LFA大鼠DRG中分布情况
根据蛋白质印迹结果,选取实验组第5天和对照组的大鼠DRG切片,运用免疫荧光共定位进一步分析β-1,4-GalT-I和TNF-α在DRG中的表达和分布情况。β-1,4-GalT-I和TNF-α在神经元细胞和神经胶质细胞中均有表达,而且β-1,4-GalT-I在LFA大鼠DRG神经元细胞(35.60±5.69)%和神经胶质细胞(43.60±5.81)%中表达较对照组神经元细胞(8.69±1.49)%和神经胶质细胞(10.36±1.95)%明显增加(图3,t值分别为7.924、9.394,均P<0.05);TNF-α与β-1,4-GalT-I的结果相似,在LFA大鼠DRG神经元细胞(45.63±7.36)%和神经胶质细胞(42.96±5.96)%中表达较对照组神经元细胞(14.96±2.39)%和神经胶质细胞(18.36±3.59)%明显增加(图4,t值分别为6.865、6.124,均P<0.05)。
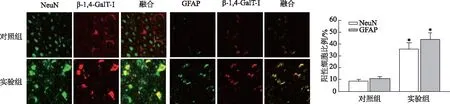
n=3; *:P<0.05,与对照组相比图3 β-1,4-GalT-I在LFA大鼠DRG中的分布(×400)
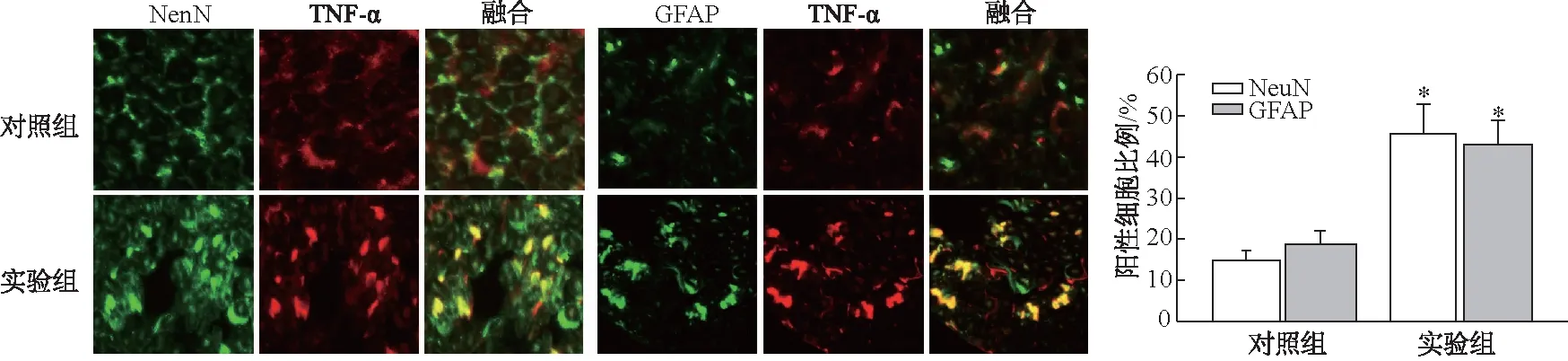
n=3; *:P<0.05,与对照组相比图4 TNF-α在LFA大鼠DRG中的分布(×400)
2.4 LFA大鼠DRG中β-1,4-GalT-I与TNF-α的共定位情况
在手术后第5天,当DRG中β-1,4-GalT-I和TNF-α的表达接近峰值时,对β-1,4-GalT-I和TNF-α进行了免疫荧光双标染色。结果显示在LFA大鼠DRG中,β-1,4-GalT-I与TNF-α存在共定位(图5)。
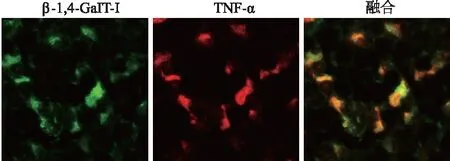
图5 LFA大鼠DRG中β-1,4-GalT-I与TNF-α的共定位(×400)
2.5 LFA大鼠DRG中的MAPK信号通路活化情况
蛋白质印迹结果表明,与对照组相比,LFA大鼠手术后第5天时DRG中的MAPK信号通路(ERK、JNK和P38)被显著激活(图6)。
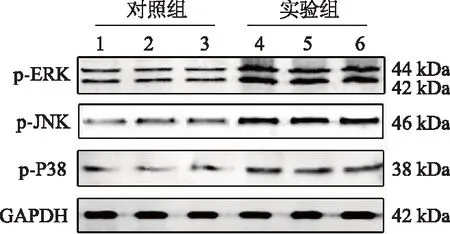
图6 LFA大鼠DRG中的MAPK信号通路活化
3 讨论
在临床研究中,许多腰椎管狭窄症的中老年患者都有影像学证据显示神经根受压,但没有神经根的疼痛症状。而且,许多接受保守治疗的患者症状会明显改善,但影像学神经受压并无变化[8]。这些现象表明,机械压迫不是引起神经根病的唯一因素。反复的应力或积累性微小创伤可以导致腰椎关节突关节炎症,引起关节积液和肿胀、滑膜增生、软骨退变,并且产生和释放TNF-α等炎症因子,炎症因子可以直接刺激关节囊感觉纤维或通过椎间孔刺激脊髓神经和渗透到DRG而导致下腰痛[2-4]。本研究中机械性缩足阈值测定结果提示腰椎关节突关节的炎症可能会导致下肢疼痛。
本研究结果表明,LFA大鼠DRG中神经元和神经胶质细胞β-1,4-GalT-I和TNF-α的表达增加。TNF-α在促进神经性疼痛的发展中起着不可或缺的作用,许多使用细胞因子抑制剂、基因敲除小鼠或直接应用细胞因子观察电生理活动和行为后遗症的研究均支持TNF-α参与神经性疼痛的发展[9-10]。Miyagi等[11]发现大鼠腰椎关节突关节损伤后DRG卫星细胞中产生的TNF-α被轴突转运至DRG神经元和脊髓背角。Tachihara等[3]发现TNF-α在关节突关节的滑膜细胞中产生,然后可能扩散并渗入硬膜外间隙,当TNF-α与神经根接触时,会引起神经损伤。此外,本研究还发现,在LFA大鼠DRG中的β-1,4-GalT-I与TNF-α存在共定位。有报道,在周围神经施万细胞中,TNF-α可以诱导β-1,4-GalT-I的产生[6],且沉默β-1,4-GalT-I可以抑制TNF-α自分泌,而β-1,4-GalT-I的过表达可以促进TNF-α的自分泌[12]。在DRG炎症过程中,β-1,4-GalT-I可能在TNF-α的表达中起重要作用,从而加剧神经根痛。β-1,4-GalT-I和TNF-α可能相互促进,形成正反馈作用,并增强TNF-α在神经痛中的作用。
本研究结果还显示,LFA大鼠DRG中MAPK信号通路被激活。MAPK信号通路在调节炎症(包括分泌TNF-α)中至关重要。先前的研究表明,在施万细胞中,β-1,4-GalT-I可以通过激活MAPK信号通路和TNF受体1促进TNF-α分泌[12]。脂多糖刺激施万细胞后通过MAPK信号通路可以调节β-1,4-GalT-I的表达[13]。MAPK信号通路参与TNF-α诱导的各种炎症介质的表达,包括各种细胞因子、趋化因子和黏附分子。研究表明,TNF-α可以激活MAPK[12]和核因子κB(NF-κB)[14]信号通路,从而诱导Snail家庭转录因子-2(SNAI2)、葡萄糖转运蛋白1、细胞间黏附分子-1和血管细胞黏附分子-1等基因和蛋白的表达;当TNF-α与TNF受体1结合时,募集一些信号蛋白到受体的胞质域,例如TNF受体1相关死亡域蛋白(TRADD)、受体相互作用蛋白1(RIP1)、Fas相关死亡域蛋白(FADD)和TNF受体相关因子2(TRAF2)[15]。这些信号蛋白的激活导致下游MAPK信号通路如JNK和P38的激活。
总之,大鼠LFA可以导致DRG中神经元细胞和神经胶质细胞β-1,4-GalT-I和TNF-α表达增加,可能与LFA引起的下肢神经症状密切相关。研究结果为LFA引起下腰痛的发病机制提供了理论依据。
