抗核抗体荧光模型与滴度在自身免疫性疾病中的临床分析
2021-05-11刘惠源扶忠超张允奇尹志华叶志中
刘惠源 扶忠超 张允奇 尹志华 叶志中
1.深圳市福田区风湿病专科医院风湿免疫实验室,广东深圳 518000;2.深圳市罗湖区人民医院风湿免疫科,广东深圳 518005
抗核抗体(anti-nuclear antibody,ANA)是自身免疫性疾病(autoimmune disease,AID)重要的生物学标志[1],常见于各种AID 中,可在发病前数年出现,还可见于恶性肿瘤、感染及健康人群中。ANA 检测的方法有多种,早在1950 年由Coons和kaplan 提出间接免疫荧光法(IIFA)检测,时至今日仍认为是“金标准”[2-3]。ENA(extractable nuclear antigen)抗体亦是AID 重要的自身抗体,对AID 的预测、诊断、病情活动均具有极其重要的临床意义[3]。如ANA 荧光模型和特异性抗体一致,更具有临床价值[4]。本研究通过分析AID 及非AID 的ANA 滴度、荧光模型等特征,旨在为临床诊疗提供诊疗依据。现报道如下。
1 资料与方法
1.1 一般资料
选取深圳市福田区风湿病专科医院2019 年6 月至2020 年6 月就诊的153 例AID 患者,其中70 例系统性红斑狼疮(systemic lupus erythematosus,SLE)、36 例类风湿关节炎(rheumatoid arthritis,RA)、9 例强直性脊柱炎( ankylosing spondylitis,AS)、8 例干燥综合征(sicca syndrome,SS)、3 例系统性硬化症(systemic sclerosis,SSc)、混合性结缔组织病(mixed connective tissue disease,MCTD)和自身免疫性肝炎(autoimmune hepatitis,AIH)各2 例,以及23 例未分化结缔组织病(undifferentiated connective tissue disease,UCTD),设为AID 组;选取同期92 名非AID 患者或健康者设为非AID 组。AID 组男18 例,女135 例,平均年龄(41.2±12.3)岁;非AID 组男10 例,女82 例,平均年龄(42.9±9.8)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准均符合美国风湿病学会或肝病学会诊断/ 分类标准。排除标准:伴基础性疾病(如高血压、糖尿病、肝炎、结核、肿瘤等)者。
1.2 仪器与与试剂
免疫荧光显微镜EUROStar ⅢPlus 及间接免疫荧光法检测试剂盒(美国沃芬公司,生产批号053387)。QUANTA-Lyser 仪器及抗ds-DNA 抗体试剂盒(美国沃芬公司,生产批号053121)。
1.3 方法
采用间接免疫荧光法检测ANA。①样本准备:标本、试剂、缓冲液;②检验操作:制备基质载玻片,孵育载玻片,清洗载玻片,加入荧光素标记的结合物,清洗载玻片;③结果判读:在显微镜下观察荧光模型,根据荧光亮度判读滴度。滴度≥1 ∶100 为阳性。采用酶联免疫法检测抗ds-DNA 抗体,按照操作说明依次加入1 ~3 号标准品、阴性、阳性对照,根据标准品检测值绘制出参数曲线,计算结果,临界值为200.0 U/ml。所有研究对象均采取空腹血清,样本均严格按照说明书进行检测。
1.4 观察指标
分析两组ANA 阳性率、ANA 模型、滴度分布情况及差异,以及系统性红斑狼疮(SLE)患者ANA滴度与dsDNA 浓度的关系。
1.5 统计学处理
应用SPSS 18.0 统计学软件进行数据分析,符合正态分布数据用()表示,计量资料比较采用t检验,非正态分布数据采用中位数(四分位数)表示。采用Spearman相关性分析比较两组的相关性,P<0.05 为差异有统计学意义。
2 结果
2.1 AID组主要荧光模型分布情况
ANA 阳性率为83.0%(127/153)。荧光模型以均质型28.1%(43/153)、核颗粒型31.4%(48/153)、混合型9.2%(14/153)为主,其中混合型主要为核颗粒/ 胞浆颗粒占35.7%(5/14),SLE 以核颗粒型为主42.8%(30/70),RA 均质、核颗粒型占63.9%(23/36),SSc 均为着丝点型。见表1。
2.2 AID患者的ANA滴度分布情况
AID 患 者ANA 滴 度(中 位 数)为1 ∶1000,除了AS、RA、UCTD 患者ANA 滴度(中位数)均为1 ∶320,其他AID 患者ANA 滴度(中位数)均≥1 ∶1000,其中SS 患者ANA 滴度(中位数)为1 ∶3200,SLE、SSc、MCTD、AIH 患者ANA 滴度(中位数)均为1:1000。见图1。

表1 AID患者ANA荧光模型分布[n(%)]

图1 不同AID 患者ANA 的滴度(中位数)
2.3 SLE患者ANA滴度与抗ds-DNA抗体的相关性分析
SLE 患者ANA 滴度(中位数)为1 ∶1000,与抗ds-DNA 抗体浓度呈正相关(r=0.538,P<0.05),抗ds-DNA 抗体阳性、阴性组ANA 滴度(中位数)分别为1:3200 和1 ∶320。见图2。
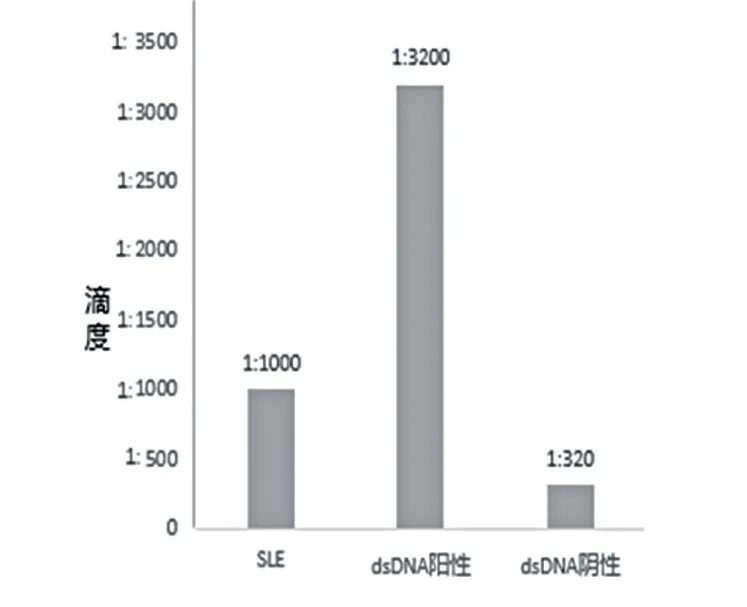
图2 SLE、抗ds-DNA 抗体阴性及阳性的滴度(中位数)
2.4 非AID者ANA荧光模型与滴度
非AID 组ANA 阳 性 率 为13.0%(12/92),AID 组ANA 阳性率为83.0%(127/153),差异有统计学意义(P<0.05)。非AID 组模型以致密颗粒型8 例为主,均质型、核颗粒型各2 例,滴度均为1 ∶100。AID 组和非AID 组ANA 滴度(中位数)分别为1 ∶1000 和1 ∶100。见图3。
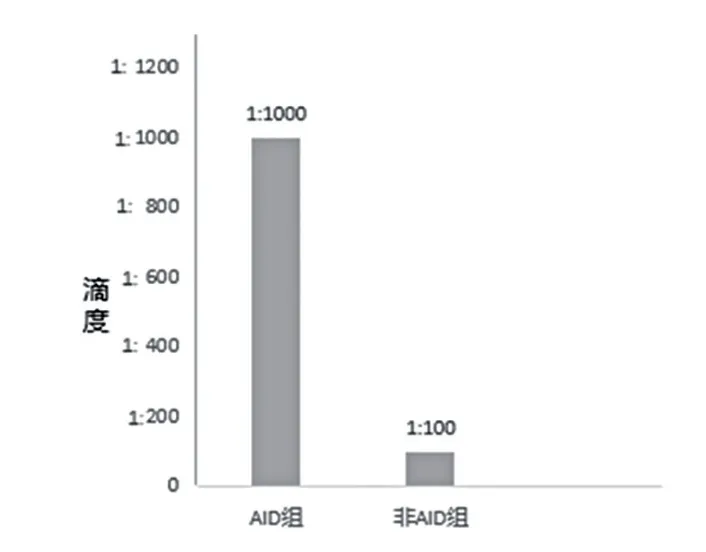
图3 AID 组与非AID 组滴度(中位数)
3 讨论
ANA 在AID 的诊断中起着重要作用,ANA 滴度被认为与临床密切相关[4],对疾病的诊断和病情的评估有重要价值[5]。荧光模型提示着特异抗原,可能是同源的自身抗体与某些疾病或疾病的表现有关。ANA 模型可能与疾病相关性比特异性抗原更大[4]。因此如果高度怀疑存在某种疾病特异性靶抗原的荧光模型,应建议临床医生进一步检测特异性抗体,有助于疾病的早期诊断和治疗[5]。
本研究通过分析不同AID 中ANA 荧光模型、滴度、抗体的差异以及非AID 人群ANA 的检出情况,为临床工作提供帮助。研究显示AID 组ANA阳性率为83.0%,与陈水绵等[6]结果相近,非AID组阳性率13.0%,差异有统计学意义(P<0.05),AID 组中均质型、核颗粒型在SLE、RA、UCTD 中的阳性率高于其他模型。SLE 模型以核颗粒型为主(42.8%),与刘卫霞等[7]报道核颗粒型占比46.7%相似。SSc 患者模型均为着丝点型。在SSc 的分类标准中抗着丝粒抗体被认为是特异性抗体,IIF 可检测的ANA 荧光模型多为着丝点型[8]。虽然特定荧光模型与某些ANA 靶抗原的特异性自身抗体、AID 及特定临床表现存在一定的相关性,但并非完全一致,不能仅从荧光模型来推断AID[1]。
不同AID 患者滴度不一样,本研究结果显示,除AS、RA、UCTD 患者ANA 滴度(中位数)均为1 ∶320 外,其他AID 患者ANA 滴度(中位数)均≥1 ∶1000,其中SS 患者ANA 滴度(中位数)为1 ∶3200,SLE、SSc、MCTD、AIH 患者ANA 滴度(中位数)均为1 ∶1000。因此,RA、AS 中的ANA 滴度对诊断的参考意义不大。UCTD 的滴度亦较低,因UCTD 可能进一步发展为其他AID,可理解为早期AID,因此可能随着病情发展,演变成SLE、SS 等AID 后其滴度亦可能改变。高滴度ANA 意味着特异性抗原被识别的机会增加[4]。Banhuk 等[9]研究显示高滴度ANA 与AID 密切相关。
ANA 滴度在预后中发挥重要作用[10],目前关于病情活动与滴度相关性研究较少报道,本研究发现SLE 患者中ANA 滴度与抗ds-DNA 抗体浓度呈正相关(r=0.538,P<0.05),可能与病情活动有关,可用于监测病情及预后。然而本研究的样本量相对较少,需进行大样本及多中心研究进一步证实。
健康人群中ANA 呈弱表达,特别是老年健康人群中[10]。本研究非AID 人群中ANA 阳性率为13.0%,与Mariz 等[11]研 究 结 果ANA 占12.9% 相近。有文献报道低滴度ANA 甚至可能出现在高达40%的健康人群中[12],Marin 等[13]研究发现在健康人群、AID 患者家属及医疗工作者共304 人中ANA可检测出荧光模型的比例为54.3%,其中35.4%为1 ∶40 低滴度,认为ANA 一般不应在没有临床适应证的情况下进行检测,有趣的是AID 患者的医生和亲属ANA 滴度往往增加。本研究显示,非AID人群中,以致密颗粒为主,均为低滴度。HEp-2 细胞致密颗粒(DFS)模型可能是ANA 相关性风湿病(AARD)的排除性标记,甚至可能发挥保护或有益的作用[14]。致密颗粒型在健康人群中更常见[11,15],而均质型只在AID 患者中观察到[11]。因此不同模型在不同个体的意义不一样。
荧光模型及滴度始终应根据临床背景进行分析[16]。不同AID 患者ANA 模型、滴度分布情况不一样,健康人群亦有一定的ANA 阳性率,如检测中出现致密颗粒型,需谨慎诊断为AID。临床医师需关注ANA 模型和滴度的价值,特殊模型可提示特殊疾病,低滴度ANA 的临床意义较小,高滴度则需积极寻找靶抗原,如无临床症状,应密切随访。
