慢性不可预见应激刺激对小鼠体重的动态变化和炎症因子水平的影响
2021-05-11袁前发徐志忠王文强朱敬敬温春燕段海珍闫晓娜
袁前发 徐志忠 王文强 朱敬敬 温春燕 段海珍 闫晓娜 何 珏
1.厦门市仙岳医院精神卫生研究室,福建厦门 361000;2.河南省新乡市中心医院康复科,河南新乡 453000;3.厦门市海沧医院急诊科,福建厦门 361000;4.福建中医药大学研究生院,福建福州 350000
抑郁症属于精神类的一种常见疾病,世卫组织将其确定为世界第四大疾病,因其具有高复发率、高致残率、高致死率等特征,因而其在全球范围内是一个负担性疾病[1-2]。抑郁症发病机制的假说主要有四种:单胺类神经递质假说[3-4]、神经营养假说[5-6]、垂体-下丘脑-肾上腺皮质轴紊乱假说[7]和细胞因子假说[8-9]。其中细胞因子假说认为抑郁症是一种免疫紊乱性疾病,强调免疫系统在发生和发展过程中的作用,某些应激刺激引起免疫系统的激活,导致细胞因子异常分泌,进而从多个层面影响中枢神经系统[10]。而细胞因子又分为前炎症细胞因子和抗炎症细胞因子,但这两种炎症细胞因子的改变是否与抑郁症的发生有必然联系暂未有明确的研究报告。同时,抑郁症模型的构建过程中大多会衡量动物体重的变化,但体重变化与抑郁症的关系并不十分明确。因此,本实验采用慢性不可预见应激刺激(chronic unpredictable mild stress,CUMS)构建抑郁症模型,在模型的构建过程中观察小鼠体重的动态变化,并检测血清中肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin- 6,IL-6)和白介素10(interleukin-10,IL-10)水平来验证是否与抑郁症发生具有关联性,最后从小鼠相关行为学实验评价此模型。
1 材料与方法
1.1 实验材料与分组
1.1.1 药品与试剂 TNF-α、IL-6 和IL-10 酶联免疫吸附法(ELISA)试剂盒,购于上海江莱生物科技有限公司,生产批号分别为JL10484、JL20268、JL18442。
1.1.2 仪器 全自动酶标仪购于美国 Bio-Rad 公司(生产型号:168-1130)。
1.1.3 实验动物 实验动物选用BALB/c 雄性小鼠,8 周龄,体重18 ~20g,由厦门大学实验动物中心提供,其购于北京维通利华实验动物技术有限公司,许可证号:SYXK(京)2016-0006,动物实验获得厦门大学实验动物伦理委员会授权。小鼠饲养于湿度 40%~50%、温度(24.0±1.0)℃的通气笼系统中。
1.1.4 实验分组 42 只无特定病原体级小鼠,适应性饲养3 d,小鼠禁食12 h 后按照体重随机分为两组,即对照组(7 只)和模型组(35 只)。
1.2 实验方法
1.2.1 小鼠抑郁模型构建[11]对小鼠进行单笼孤养,并给予每天包括固定在塑料管内、鼠笼倾斜、不筑巢、拥挤环境、明暗颠倒、白噪声,共6 种刺激方法,每日2 种,每种刺激出现1 次,同样刺激方式不同时出现,按照随机原则分布各个应激周期中。见表1。
1.2.2 体重动态监测 实验动物每隔两天监测一次体重,并通过以下计算公式计算其体重变化。体重变化=第n 天的体重-第1 天的体重(0 <n≤28)。
1.2.3 强迫游泳实验 迫使小鼠在装有 15 cm 水(水温保持 22 ~23℃)的透明塑料圆筒中游泳6 min,记录后4 min 内不动时间。不动的标准是垂直漂浮在水中,同时仅进行那些必要的动作以将头保持在水上,实验结束后,将小鼠移出并在加热灯下加热直到其身体干燥。
1.2.4 蔗糖偏好 实验小鼠适应性习惯两个饮水瓶3 d 后,将每只小鼠单独分笼,每笼中放置两个饮水瓶,一个为1%蔗糖瓶,另一个含水瓶,测量水和蔗糖溶液摄入量的体积,同时每天更换两个瓶子的位置以减少实验误差。计算公式为蔗糖偏好= V蔗糖溶液/[V蔗糖溶液+ V水]×100%。

表1 CUMS模型不同程序刺激表
1.2.5 旷场实验 小鼠放置在尺寸为 90 cm×90 cm×30 cm 的木箱(内部划分为36 个大小相同的正方形)中5 min,用 ANY-maze 软件记录和分析小鼠在测试时间内穿越中间方格的次数。实验完成后将小鼠取出,在木箱内喷洒10%的乙醇溶液清洁仪器,以消除其运动痕迹对后面测试的影响。
1.2.6 血清标本采集 采用眼眶取血,血液采集后常温静置2 h,采用3000 r/min 离心10 min,收集血清,置于-80℃低温冰箱中保存至检测。
1.2.7 TNF-α、IL-6 和IL-10 含量测定 用 ELISA试剂盒测定各组大鼠血清中TNF-α、IL-6 和IL-10 含量,所有操作按试剂盒所附说明书检测,根据 ELISA 标准曲线计算样本中3 个指标的含量。
1.3 统计学处理
应用统计学软件SPSS 20.0 对实验数据进行统计学分析,实验数据均以()表示,统计结果以Origin Pro 8 作图,组间两两比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组小鼠的体重动态变化比较
造模4 d 后,对照组和模型组小鼠体重开始出现差异,但差异无统计学意义(P>0.05)。造模第4 ~24 天时,对照组和模型组小鼠体重差异进一步加大,但差异无统计学意义(P>0.05)。造模第24 天后,模型组小鼠体重明显低于对照组,差异有统计学意义(P<0.05)。小鼠体重变化见图1。

图 1 两组小鼠的体重动态变化
2.2 两组小鼠行为学实验结果比较
小鼠行为学实验结果见图2。造模28 d 后,模型组小鼠在强迫游泳实验中不动时间显著增加,差异有统计学意义(P<0.05),见图2A;糖偏好实验中,与对照组小鼠比较,模型组小鼠糖偏好程度明显下降,差异有统计学意义(P<0.05),见图2B;旷场实验中,模型组小鼠穿越实验中心次数较对照组明显下降,差异有统计学意义(P<0.05),见图2C。

图2 两组小鼠的行为学实验结果比较
2.3 两组小鼠血清TNF-α、IL-6和IL-10含量变化比较
前炎症细胞因子TNF-α 和IL-6 与对照组比较明显升高,差异有统计学意义(P<0.05),抗炎症细胞因子IL-10 含量与对照组比较明显下降,差异有统计学意义(P<0.05)。见表2。
表 2 两组小鼠血清中TNF-α,IL-6和IL-10含量比较(±s,mmol/L)
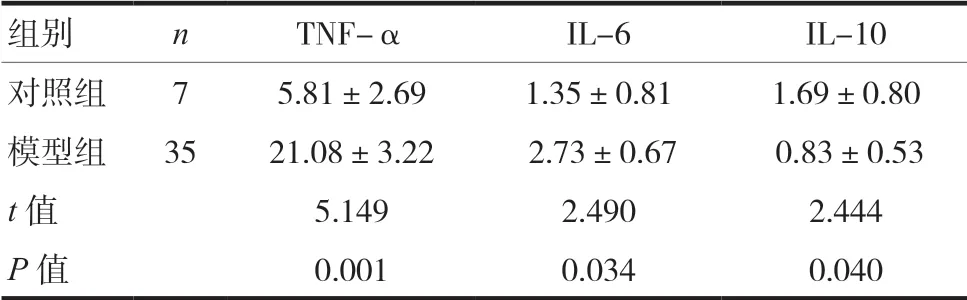
表 2 两组小鼠血清中TNF-α,IL-6和IL-10含量比较(±s,mmol/L)
组别 n TNF-α IL-6 IL-10对照组 7 5.81±2.69 1.35±0.81 1.69±0.80模型组 35 21.08±3.22 2.73±0.67 0.83±0.53 t 值 5.149 2.490 2.444 P 值 0.001 0.034 0.040
3 讨论
CUMS 是模拟抑郁症的环境诱因,其主要通过对周围环境改变诱发动物行为异常而建立的抑郁动物模型,其可以模拟人类抑郁症的主要临床症状,作用持久且稳定,因而被广泛应用[12-13]。有研究表明,CUMS 模型构建过程中,随着造模时间的延长,其体重会出现不同程度的差异[14-15]。但究其原因,各学者看法不一,部分学者认为模型组鼠体重减轻是由于出现情感抑郁,食欲不佳等原因导致体重增加变慢;另有研究认为模型组鼠体重减轻是因为在CUMS 造模过程中曾给予了禁食禁水等刺激,导致大鼠体重增长缓慢[14]。本研究中发现,0 ~4 d 时,两组小鼠体重呈现直线增长,然而随着刺激时间的延长,也就是造模处于5 ~24 d 的时候,模型组小鼠其体重增长趋势明显降低,可能是已经出现轻度抑郁,特别是第24 天时,模型组鼠较对照组鼠体重明显下降(P<0.05),提示造模末尾阶段,模型组鼠可能已经处于抑郁状态,表明抑郁过程中其体重变化可以作为一个评价抑郁状态的参考指标,为抑郁症的研究提供一定的参考依据。但本研究也有一些不足,未能在第24 天时检测行为学变化,用以进一步明确小鼠此时的抑郁状态,课题组将在后续实验中完善这一验证。
免疫炎症反应在抑郁症发病过程中发挥重要作用,炎症反应实质上是机体与致炎因子进行抗争的外在表现,而抑郁症免疫方面的研究集中在细胞因子和免疫细胞方面[16-18]。细胞因子分为前炎症细胞因子和抗炎症细胞因子,前炎症细胞因子在抑郁症中的改变和作用近年来成为相关热点研究[10];抗炎症细胞因子因其可能具有抗抑郁作用,日益受到研究者的关注[19-21]。本研究选用TNF-α、IL-6 和IL-10 进行监测,实验结果显示,在抑郁症小鼠模型中前炎症细胞因子TNF-α 和IL-6 与对照组比显著升高,抗炎症细胞因子IL-10 含量显著下降,差异有统计学意义(P<0.05)。这表明抑郁症的发生与免疫系统的失衡有关,抑郁症发生能够激活免疫系统,从而引起相关炎症因子水平的改变,为抑郁症的治疗提供了新的研究思路,虽然本研究未对炎症因子和抑郁症的相关性进行验证,但本研究论证了炎症因子在抑郁症的发生过程重要性,为抑郁症发病机制和治疗手段提供了新的研究基础,后期课题组将进一步论证炎症因子和抑郁症的相关性,并明确具体的参与过程。
综上所述,CUMS 所致小鼠抑郁模型能够较好模拟抑郁过程,小鼠体重差异最早可在造模24 d 开始出现,且随时间延长差异越显著,而且CUMS 所致BALB/c 小鼠抑郁可能与炎症因子的异常表达有关。本研究结果可为抑郁症的早期临床治疗和诊断提供相关的研究参考依据,可根据这一特征在抑郁症发病早期进行药物或治疗手段的干预,避免病程的进一步加深。
