CYP3A5基因多态性对肾移植受者他克莫司代谢的影响
2021-05-11张异蕊郭予和
张异蕊 郭予和 陈 正
1 引言
目前,他克莫司(Tacrolimus,FK506)是肾移植术后应用最广泛的免疫抑制剂,有效降低了术后排斥发生率[1-2]。然而,他克莫司治疗窗窄、个体间药物代谢动力学差异大,按照“标准剂量”给药,个体间药物浓度明显不同,临床上经常出现偏离目标浓度的现象。因此,他克莫司用药剂量必须根据治疗药物监测(Therapeutic drug monitoring,TDM)结果不断进行调整。
细胞色素P450(cytochrome P450,CYP)是一种人体内重要的药物代谢酶[3-5],其亚家族CYP3A5主要在肠道和肝表达,是他克莫司在人体内的主要代谢酶。CYP3A5的活性很大程度上取决于CYP3A5×3单核苷酸多态性,该基因6989(A/G)位点的突变可导致其翻译出无功能的蛋白质,使得CYP3A5 GG基因型携带者不能表达有酶活性的CYP3A5蛋白质,影响他克莫司在体内代谢。本研究以我院肾移植受者为对象,探讨CYP3A5基因多态性对他克莫司标准化血药浓度(Dose adjusted blood concentration,C0/D)的影响,分析 CYP3A5×3基因多态性与肾移植受者术后急性排斥反应和感染的相关性,为肾移植受者术后个体化用药提供依据。
1 资料与方法
1.1 临床资料
选取2016年1月—2017年12月在广州医科大学附属第二医院接受初次肾移植的受者为研究对象。
纳入标准:①18周岁以上;②术后免疫抑制剂方案采用他克莫司+霉酚酸酯+激素,且维持该方案至少2年。
排除标准:①术后1个月内肾功能不全;②因手术原因移植物失功;③服用利福平、红霉素等影响CYP酶活性药物;④术后发生移植肾功能延迟恢复(DGF)和失访的受者;⑤术后肝功能异常的受者;⑥患有贫血、低蛋白血症和精神性厌食症或胃肠切除术后等影响药物吸收的受者;⑦多器官联合移植受者。本研究共纳入受者190例,随访期为2年。
1.2 CYP3A5基因型分析
采用天根基因组提取试剂盒(DP318-02)提取全血的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)。采用紫外分光光度计检测DNA的纯度及浓度,确保DNA浓度在30 ng/μl左右。采用聚合酶链反应-限制性片段长度(Poly merase chain reaction-restriction fragement length polymorphism,PCR-RFLP)方 法 检 测CYP3A5×3基因多态性(试剂盒来自于天津市秀鹏生物技术开发有限公司)。PCR反应程序如表1所示,PCR扩增产物经2%琼脂糖凝胶电泳,溴化乙锭染色,于紫外凝胶成像系统下观察并判读结果。

表1 PCR循环参数
1.3 C0的测定
采集受者术后不同时间点(7天、1个月、3个月、6个月、1年和2年)清晨空腹静脉血2~4 mL,采用酶联免疫放大法(Enzyme linked immunoamplification,试剂盒来自珠海丽珠试剂有限公司)检测C0,并进行校正。以竞争药物(他克莫司代谢物)抗体结合位点为基础,样品中的他克莫司代谢物与用葡萄糖6磷酸脱氢酶标记的药物竞争抗体结合位点,未结合的酶可将辅助因子NAD转化为还原性的NADH,从而造成吸光度改变。通过分光光度计340 nm进行测量。计算3组受者术后不同时间点有效的血他克莫司浓度/剂量(C0/D)值。C0为他克莫司谷浓度(ng·ml-1),D为受者每日每公斤体质量所服用他克莫司毫克数(mg·kg-1·d-1),C0/D值单位为 ng·mL-1·d·kg。
1.4 急性排斥反应(AR)诊断
依据以下临床症状诊断排斥反应:①尿量减少、血压升高、发热、体重增加;②移植肾区变硬、胀痛、肿大;③伴有乏力、肌肉关节酸痛、纳差、腹胀、心动过速甚至精神异常等全身症状;④检查指标血清肌酐(SCr)或内生肌酐清除率(Ccr)升高;⑤移植肾多普勒彩超检查符合急性排斥反应影像学特征;⑥必要时行移植肾穿刺活检。
1.5 感染
为减少不同类型感染的影响,本研究仅纳入有明显影像学依据的肺部感染作为统计的唯一指标。包括:细菌性肺炎、病毒性肺炎、真菌性肺炎、结核感染、混合性感染、不明病原菌肺部感染(具备明确临床症状及影像学特征,但未检出任何病原菌者)。当患者出现发热及咳嗽等症状时,进行肺部CT检测、病原学检查诊断肺部感染。
1.6 统计分析
采用SPSS(19.0版)统计软件处理。各组患者年龄、BMI、HLA错配、术后不同时间点受者的他克莫司C0/D值均以均数±标准差表示,不同基因型患者性别构成比比较采用χ2检验,不同基因型受者年龄、BMI、HLA错配及术后不同时间点受者的他克莫司C0/D值比较采用单因素方差分析(不满足方差分析则用Kruskal-Wallis秩和检验)。三组间排斥反应发生率和感染发生率的比较采用行×列表的卡方检验,对于理论频数<1的采用fisher’s确切概率法,以P<0.05认为差异有统计学意义。
2 结果
2.1 受者一般资料及CYP3A5基因多态性检测结果
190例受者中,男117例,女73例,年龄为43.25±13.81岁,BMI为22.14±3.31 kg/m2、HLA错配为3.55±1.21个。其中,CYP3A5×1/×1型24例(12.7%),CYP3A5×1/×3型66例(34.7%),CYP3A5×3/×3型100例(52.6%)。3组受者年龄、性别构成比、BMI和HLA错配数比较差异均无统计学意义(P>0.05),3组受者一般资料具有可比性,见表2。

表2 CYP3A5不同基因组受者一般资料
2.2 各组受者不同时间点他克莫司C0/D值
术后7天、1个月、3个月、6个月、1年和2年时,CYP3A5×3/×3组受者的 C0/D值分别为123.21±23.84 ng·mL-1·d.kg、139.41±19.77 ng·mL-1·d·kg、131.54±21.35 ng·mL-1·d·kg、134.21±20.18 ng·mL-1·d·kg、125.36±17.70 ng·mL-1·d.kg、134.24±26.17 ng·mL-1·d·kg;CYP3A5×1/×1组受者各时间点为:46.71±17.99 ng.mL-1·d·kg、56.67±18.71 ng·mL-1·d·kg、55.33±17.72 ng·mL-1·d·kg、54.21±18.21 ng·mL-1·d·kg、48.13±15.25 ng·mL-1·d·kg、54.14±19.13 ng·mL-1·d·kg;CYP3A5×1/×3组受者各时间点为:54.25±17.82 ng·mL-1·d.kg、59.41±15.96 ng·mL-1·d·kg、61.22±16.93 ng·mL-1·d·kg、64.13±16.85 ng·mL-1·d·kg、61.32±14.75 ng·mL-1·d.kg、59.11±17.27 ng·mL-1·d·kg。CYP3A5×3/×3组受者的C0/D值各时间点均高于明显高于CYP3A5×1/×1组受者和CYP3A5×1/×3组受者,差异均具有统计学意义(P<0.05),CYP3A5×1/×1组和CYP3A5×1/×3组患者各时间点C0/D值无统计学差异(表3和图1)。
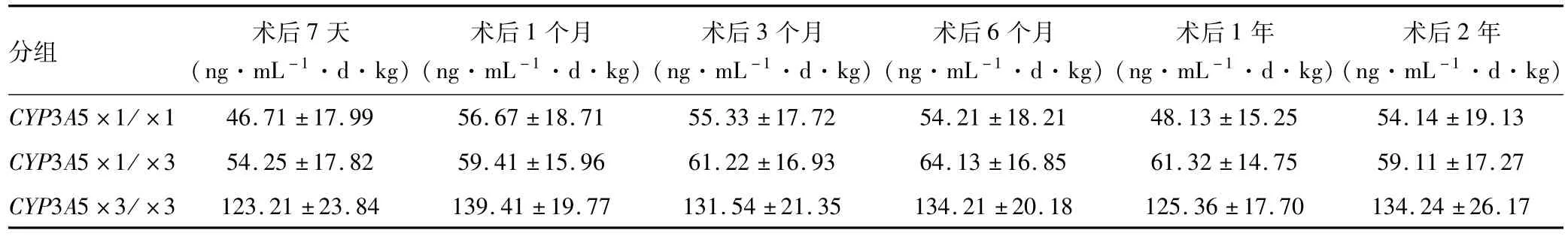
表3 CYP3A5基因多态性与剂量和浓度剂量比的关系

图1 CYP3A5不同基因型组C0/D比较
2.3 CYP3A5基因多态性与急性排斥反应的关系
3组术后2年内发生急性排斥反应共有20例,其中,CYP3A5×1/×1组7例,CYP3A5×1/×3组7例,CYP3A5×3/×3组6例。如表3显示,CYP3A5×1/×1组6例急性排斥反应发生时间为:术后7天至术后1月间1例,术后1月至术后3个月间3例,术后6月至1年间1例,术后1年至2年间2例。CYP3A5×1/×3组14例急性排斥反应发生时间为:术后1月至术后3个月间3例,术后6月至1年间2例,术后1年至2年间2例。CYP3A5×3/×3组6例急性排斥反应发生时间为:术后7天至术后1月间1例,术后1月至术后3个月间2例,术后半年至1年间1例,术后1年至2年间2例,见表4。3组急性排斥反应通过甲基等药物冲击治疗后均得到逆转,移植肾功能得到恢复。术后2年内CYP3A5×1/×1组急性排斥反应发生率高于 CYP3A5×1/×3组和CYP3A5×3/×3组(P=0.032,P<0.001),而术后2年内CYP3A5×1/×3组和CYP3A5×1/×3组急性排斥反应发生率无统计学差异(P=0.28)。
2.4 CYP3A5基因多态性与感染的关系
术后2年内发生感染共有47例,其中,CYP3A5×1/×1组6例,CYP3A5×1/×3组14例,CYP3A5×3/×3组27例。CYP3A5×1/×1组6例感染发生时间为:术后1月内1例,术后1月至术后3个月间3例,术后半年至1年间1例,术后1年至2年间1例。CYP3A5×1/×3组14例感染发生时间为:术后1月至术后3个月间9例,术后半年至1年间3例,术后1年至2年间2例。CYP3A5×3/×3组27例感染发生时间为:术后1月内3例,术后1月至术后3个月间12例,术后半年至1年间8例,术后1年至2年间4例。术后2年内各组感染总发生率无统计学差异(P>0.05)。

表4 不同CYP3A5基因组急性排斥反应发生时间
3 讨论
他克莫司(Tacrolimus,FK506)是钙调磷酸酶抑制剂,作为一种有效的免疫抑制药物,是肾移植术后免疫维持方案的基础用药之一。目前,临床上常规给予相同体重剂量的药物,并根据TDM结果对初始剂量进行调整[6]。但由于他克莫司治疗窗窄、药动学差异大,使得移植术后的受者需要较大剂量范围和较长时间的调整,部分受者由于给药剂量过低造成移植物的急性排斥导致移植失败,或者给药剂量过高导致感染及肝、肾毒性等不良反应发生急性排斥反应[7],严重影响移植手术治疗效果及受者的生存质量。因此,如何针对肾移植受者制定个体化的免疫抑制方案是目前研究的热点。
学者们通过药物基因组学研究遗传因素对药物反应的影响,发现CYP3A5蛋白是影响他克莫司代谢的关键酶,该酶活性主要受CYP3A5×3基因多态性影响[8]。CYP3A5×3(6986A>G)碱基突变可导致翻译出无功能的CYP3A5蛋白[9]。CYP3A5的表达与活性呈高度多态性,个体及种族间差异性较大。有研究[9-10]报道指出:CYP3A5×3等位基因突变频率在中国汉族、维吾尔族、哈萨克族和高加索人群中分别为72.17%、84.18%、86.16% 和91.17%。柳东夫[11]等在65例肾移植受者中发现,CYP3A5×1/×3型29例(44.62%),CYP3A5×3/×3型26例(40.0%),突变率为84.62%。本研究纳入190例受者均为汉族人群,结果显示:CYP3A5×1/×3型66例(34.7%),CYP3A5×3/×3型100例(52.6%),CYP3A5×3的突变率为87.3%,与上述报道基本一致,较高的CYP3A5×3突变率提示了CYP3A5×3基因检测的重要性。
无功能的 CYP3A5蛋白将影响药物代谢[8],携带CYP3A5×3等位基因的肾移植受者CYP3A5酶的活性低于携带CYP3A5×1等位基因的受者。研究[12]指出:携带CYP3A5×3/×3组基因的受者较携带CYP3A5×1/×1组和CYP3A5×1/×3组受者易于达到目标浓度。本研究结果显示:术后7天、1个月、3个月、6个月、1年和2年时,CYP3A5×3/×3组患者的C0/D值均明显高于CYP3A5×1/×1组和 CYP3A5×1/×3组,而 CYP3A5×1/×1组和CYP3A5×1/×3组患者各时间点C0/D值无统计学差异。上述结果提示携带CYP3A5×1等位基因者需要更高剂量的他克莫司才能达到目标浓度,特别在肾移植早期,浓度尚未稳定时,更需要根据CYP3A5基因分型选择不同的初始剂量。
由于CYP3A5×1等位基因携带者CYP3A5表达水平较高,该酶的活性较强,导致他克莫司体内代谢速度较快,生物利用度较低[13]。因此,CYP3A5×1等位基因携带者他克莫司血药浓度常常较低,容易引起免疫抑制不足,发生急性排斥反应[14]。然而,关于CYP3A5基因多态性与急性排斥反应的相关性,国内不同报道结果并不一致:有研究[15]指出:CYP3A5×1/×1组、CYP3A5×1/×3组和CYP3A5×3/×3组各组间术后2年内急性排斥反应发生率无统计学差异。另有报道[16]指出3个月内CYP3A5×1/×1组急性排斥反应的比例显著高于CYP3A5×1/×3组和 CYP3A5×3/×3组(P<0.05)。本研究结果显示:术后2年内CYP3A5×1/×1组急性排斥反应发生率高于CYP3A5×1/×3组和CYP3A5×3/×3组(P=0.032,P<0.001),CYP3A5×1/×3组和CYP3A5×1/×3组急性排斥反应发生率无统计学差异(P=0.28),提示CYP3A5×1/×1组受者容易因为免疫抑制不足而发生急性排斥反应。由于CYP3A5×1/×1组受者需要更大的剂量才能达到目标浓度,增加了发生急性排斥反应的风险[13],故 CYP3A5×1/×1受者在肾移植术后要加强急性排斥反应的监测。
感染是肾移植术后常见的并发症[17],肾移植术后预防感染与急性排斥反应影响移植受者/器官长期存活的重要因素。国外研究显示[18-19]:携带不同CYP3A5基因肾移植受者感染发生率无统计学差异。国内庞路新等[20]也有相似的研究结果。为减少不同类型感染的影响,本研究纳入有明显影像学依据的肺部感染作为统计的唯一指标。本研究结果显示:术后2年内发生感染共有47例,其中,CYP3A5×1/×1组6例,CYP3A5×1/×3组14例,CYP3A5×3/×3组27例。术后2年内各组间感染发生率无统计学差异(P>0.05),与文献报道一致。从结果可以看出,肾移植受者感染在3个月内居多,CYP3A5×1/×1组术后3个月内发生4例,CYP3A5×1/×3组术后3个月内发生9例,CYP3A5×3/×3组术后3个月内15例,这与前期免疫抑制剂药物浓度调整有关。
综上所述,本研究结果提示:CYP3A5基因多态性对肾移植术后受者他克莫司药物代谢有显著影响,可作为肾移植受者他克莫司个体化用药的指导依据。
