LINC00963靶向miR-144-5p调控脑胶质瘤细胞凋亡及放射敏感性
2021-05-07李红杨昊鞠海涛
李红 杨昊 鞠海涛
脑胶质瘤是起源于大脑和中枢神经系统胶质细胞或前体细胞的最常见的原发性恶性肿瘤,包括星形细胞瘤和少突胶质细胞瘤等病理类型[1]。目前手术联合放、化疗是脑胶质瘤的主要治疗手段[2],然而高度侵袭性胶质瘤患者中位生存期仅为12~14个月,放射抵抗是导致其预后不良的重要原因[3]。因此,探讨脑胶质瘤放射抵抗的分子机制,提高胶质瘤细胞的放射敏感性迫在眉睫。长链非编码RNA(Long non-coding rna,lncRNA)是长度超过200个核苷酸的非蛋白编码转录本,通过与基因组DNA、微小RNA(microRNA,miRNA)、mRNA和蛋白相互作用,发挥其生理和病理功能[3]。大量研究表明除参与正常发育外,lncRNA与肿瘤发生的密切相关,其可作为癌基因或抑癌基因,参与肿瘤发生、转移、放疗耐药和预后[4,5]。研究显示,LINC00963在黑色素瘤[6]、肝癌[7]等多种恶性肿瘤中表达上调发挥癌基因作用,沉默LINC00963还可提高乳腺癌细胞的放射敏感性[8]。miRNA是一种抑癌基因,miR-144-5p过表达可增强非小细胞肺癌细胞的放射敏感性[9]。生物信息学分析显示LINC00963和miR-144-5p之间可能存在相互作用,于是本研究推测LINC00963可能通过靶向miR-144-5p参与调控脑胶质瘤细胞凋亡及放射敏感性。因此,本研究通过体外细胞实验旨在探讨LINC009631和miR-144-5p对脑胶质瘤细胞放射射敏感性的影响及其分子机制。
1 材料与方法
1.1 材料 收集2016年1月至2018年1月于内蒙古肿瘤医院和内蒙古医科大学附属医院接受神经外科手术切除的胶质瘤组织标本20例,其中男14例,平均年龄47.2岁;女6例,平均年龄45.5岁。应用冰冻组织切片法和免疫组化方法病理科对采集的胶质瘤样本按照WHO 2007年分级标准鉴定,其中Ⅰ~Ⅱ级8例,Ⅲ~Ⅳ级12例。收集同期于我院因颅脑手术切除的正常人脑组织20例。脑胶质瘤U251细胞购自中国科学院上海细胞研究所;DMEM培养基和胎牛血清购自美国Hyclone公司;Trizol试剂、RIPA裂解液、LipofectamineTM 2000购自美国Invitrogen公司;TLINC00963小干扰RNA阴性对照(si-NC)、TLINC00963小干扰RNA(si-TLINC00963)、miR-144-5p模拟物阴性对照(miR-NC)、miR-144-5p模拟物(miR-144-5p mimics)、miR-144-5p抑制物阴性对照(anti-miR-NC)、miR-144-5p抑制物(anti-miR-144-5p)、空载体(pcDNA)、LINC00963过表达质粒(pcDNA-LINC00963)购自上海吉玛制药有限公司;逆转录试剂盒、SYBR green qPCR Super Mix购于大连Takara公司;兔抗B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl相关X蛋白(Bax)和活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved-caspase 3)以及GAPDH抗体购自美国Abcam公司。
1.2 细胞培养与分组 U251细胞采用体积分数为10%的胎牛血清的DMEM培养基在37℃、5% CO2的培养箱进行常规细胞培养。取对数期生长状况良好的U251细胞进行实验。细胞分组如下。si-NC组:转染si-NC;si-LINC00963组(转染si-LINC00963)、miR-NC组(转染miR-NC)、miR-144-5p组(转染miR-144-5p mimics)。为验证LINC00963是通过调控miR-144-5p进而影响U251细胞凋亡和其放射敏感性,将U251细胞分为以下两组:si-LINC00963+anti-miR-NC组(共转染si-LINC00963和anti-miR-NC)、si-LINC00963+anti-miR-144-5p组(共转染si-LINC00963和anti-miR-144-5p)。细胞转染严格按照脂质体LipofectamineTM 2000使用说明书步骤进行。
1.3 RT-qPCR检测LINC00963和miR-144-5p的表达 采用Trizol法分别提取正常脑组织、脑胶质瘤组织以及各组U251细胞的总RNA,紫外分光光度法检测总RNA浓度后,取适量RNA将其逆转为cDNA,以cDNA为模板按照SYBR green qPCR Super Mix试剂盒说明书步骤利用ABI prism 7500进行RT-qPCR扩增。引物由上海生工生物工程有限公司,序列如下。LINC00963-F:5’-GCCAAGGAGGGAGTTGTGGCTGC-3’,LINC00963-R:5’-CTGTTGCCACACCATGCAC-CACTCC-3’;miR-144-5p-F:5’-GGGGGGGGATATCATCATATAC-3’,miR-144-5p-R:5’-GTGCGTGTCGTGGAGTCG-3’;U6-F:5’-ATTGGAACGATACAGAGAAGATT-3’,U6-R:5’-GGAACGCTTCACGAATTTG-3’,GAPDH-F:5’-TGAAGGTCGGAGTCAACGGATTTG-GT-3’,GAPDH-R:5’-CATGTGGGCCATGAGGTCCACCAC-3’。按照2-ΔΔCt法获得LINC00963(以GAPDH为内参)和miR-144-5p(以U6为内参)的相对表达量。
1.4 荧光素酶报告基因实验 用starBase v2.0网站在线预测发现LINC00963与miR-144-5p之间部分互补结合的位点,推测LINC00963可靶向调控miR-144-5p表达并进行验证。含miR-144-5p结合位点的野生型荧光素酶报告基因载体(WT-LINC00963)、突变型荧光素酶报告基因载体(MUT-LINC00963)由上海吉玛制药有限公司提供。利用脂质体转染法将WT-LINC00963和miR-144-5p mimics或miR-NC共转染至U251细胞,再将MUT-LINC00963与miR-144-5p mimics或miR-NC共转染至U251细胞,转染48 h,收集各组细胞并测定其荧光素酶活性。为验证LINC00963对miR-144-5p细胞的调控作用,分别将si-NC、si-LINC00963、pcDNA以及pcDNA-LINC00963转染至U251细胞,转染48 h,RT-qPCR检测miR-144-5p的表达水平。
1.5 流式细胞术检测细胞凋亡 收集转染48 h时的各组细胞,磷酸盐缓冲液洗涤细胞后,加入适量的结合缓冲液调整细胞浓度,取100 μl的细胞悬液(约1×104cells)加入5 μl的Annexin V-FITC和5 μl的PI溶液,混匀后置于暗处孵育10 min,1 h内采用流式细胞仪检测细胞凋亡情况。
1.6 克隆形成实验检测细胞存活分数 分别以不同剂量(0、2、4、6、8 Gy)射线照射各转染组细胞2 h,继续培养48 h后更换新鲜培养液继续培养,当肉眼看见克隆形成时,弃去培养液,PBS缓冲液洗涤细胞,经甲醇固定和结晶紫染色后,显微镜下计算≥50个细胞的克隆数。克隆形成率=为克隆数/接种细胞数,细胞存活分数=实验组克隆形成率/对照组克隆形成率,放射增敏比=沉默(过表达)前细胞存活分数/抑制(过表达)后细胞存活分数。利用GraphPadPrism 7软件拟合单击多靶模型曲线,计算准阈剂量(Dq)、平均致死剂量(D0)、存活分数(SF2)、放射增敏比(SER)。
1.7 Western blot检测Bcl-2、Bax和cleaved-caspase3的表达 采用RIPA裂解液分别提取各组细胞的总蛋白,BCA法进行蛋白定量。按照配胶、上样、凝胶电泳、湿法转膜等步骤将已分离的细胞蛋白转移至硝酸纤维素膜,采用5%的脱脂牛奶中室温条件下封闭膜2 h,洗膜后,采用稀释的兔抗Bcl-2、Bax和cleaved-caspase3以及GAPDH抗体室温孵育膜2 h,洗膜后,加入稀释的山羊抗兔IgG室温条件孵育膜1 h,洗膜后,采用化学发光试剂于暗室显色,凝胶系统拍照,以GAPDH为内参,用Quantity One软件分析目的条带的吸光度值。所有实验均设置3个平行实验或复孔,并重复3次。

2 结果
2.1 LINC00963和miR-144-5p在脑胶质瘤组织中的表达 采用RT-qPCR检测,相较于正常脑组织,脑胶质瘤组织中LINC00963的表达水平显著升高,miR-144-5p的表达水平显著降低(P<0.05)。见表1。

表1 LINC00963和miR-144-5p在脑胶质瘤组织中的表达
2.2 LINC00963靶向调控miR-144-5p的表达 利用StarBase在线进行靶基因预测发现LINC00963与miR-144-5p之间存在互补结合的核苷酸序列,双荧光素酶报告基因实验显示,相较于miR-NC和WT-LINC00963共转染组,miR-144-5p mimics和WT-LINC00963共转染组U251细胞的荧光素酶活性显著降低(P<0.05);相较于miR-NC和MUT-LINC00963共转染组,miR-144-5p mimics和MUT-LINC00963共转染组U251细胞的荧光素酶活性变化无统计学意义。RT-qPCR实验显示,相较于si-NC组,si-LINC00963组U251细胞miR-144-5p的表达水平显著升高;相较于pcDNA组,pcDNA-LINC00963组U251细胞miR-144-5p的表达水平显著降低(P<0.05)。见图1,表2、3。

图1 LINC00963的序列中含有与miR-144-5p互补的核苷酸序列

表2 双荧光素酶报告实验

表3 LINC00963调控miR-144-5p的表达
2.3 干扰LINC00963表达对脑胶质瘤U251细胞凋亡和放射敏感性的影响 相较于si-NC组,si-LINC00963组U251细胞LINC00963的表达水平显著降低,Bcl-2蛋白的表达水平显著降低,Bax和cleaved-caspase3蛋白的表达水平显著升高,细胞凋亡率显著增加(P<0.05)。采用不同剂量(0、2、4、6、8 Gy)射线分别照射si-NC组和si-LINC00963组U251细胞,细胞存活分数呈剂量依赖性降低,且si-LINC00963组细胞存活率显著低于si-NC组(P<0.05)。见图2,表4、5。

图2 干扰LINC00963表达对脑胶质瘤U251细胞凋亡和放射敏感性的影响;A 凋亡相关蛋白表达;B 细胞凋亡流式图;C 不同剂量照射后U251细胞的存活曲线

表4 干扰LINC00963表达对脑胶质瘤U251细胞凋亡的影响

表5 单击多靶模型参数
2.4 miR-144-5p过表达对脑胶质瘤U251细胞凋亡和放射敏感性的影响 相较于miR-NC组,miR-144-5p组U251细胞miR-144-5p的表达水平显著升高,Bcl-2蛋白的表达水平显著降低,Bax和cleaved-caspase3蛋白的表达水平显著升高,细胞凋亡率显著增加(P<0.05)。采用不同剂量(0、2、4、6、8 Gy)射线分别照射miR-NC组和miR-144-5p组U251细胞,细胞存活分数呈剂量依赖性降低,且miR-144-5p组细胞存活率显著低于miR-NC组(P<0.05)。见图3,表6、7。

图3 miR-144-5p过表达对脑胶质瘤U251细胞凋亡和放射敏感性的影响;A 凋亡相关蛋白表达;B 细胞凋亡流式图;C 不同剂量照射后U251细胞的存活曲线

表6 miR-144-5p过表达对脑胶质瘤U251细胞凋亡的影响

表7 单击多靶模型参数
2.5 抑制miR-144-5p表达逆转了干扰LINC00963表达对脑胶质瘤U251细胞凋亡和放射敏感性的作用 相较于si-NC组,si-LINC00963组U251细胞miR-144-5p的表达水平显著升高,Bcl-2蛋白的表达水平显著降低,Bax和cleaved-caspase3蛋白的表达水平显著升高,细胞凋亡率显著增加;相较于si-LINC00963+anti-miR-NC组,si-LINC00963+anti-miR-144-5p组U251细胞miR-144-5p的表达水平显著降低,Bcl-2蛋白的表达水平显著升高,Bax和cleaved-caspase3蛋白的表达水平显著降低,细胞凋亡率显著降低(P<0.05)。采用不同剂量(0、2、4、6、8 Gy)射线分别照射si-NC组、si-LINC00963组、si-LINC00963+anti-miR-NC组、si-LINC00963+anti-miR-144-5p组U251细胞,细胞存活分数呈剂量依赖性降低,且si-LINC00963组细胞存活率显著低于si-NC组,si-LINC00963+anti-miR-NC组细胞存活率显著低于si-LINC00963+anti-miR-144-5p组(P<0.05)。见图4~6,表8、9。
3 讨论
胶质瘤是最常见的侵袭性脑肿瘤,更是癌症相关死亡率高的原因之一[10]。放疗作为脑胶质瘤患者术后辅助治疗的重要手段,然而由于放疗抵抗的出现严重影响脑胶质瘤患者的治疗效果,甚至导致肿瘤复发。lncRNA和miRNA作为肿瘤多种生物学过程的调控因子,是近年来肿瘤放疗抵抗研究的热点。本研究LINC00963和miR-144-5p对脑胶质瘤细胞凋亡和放疗敏感性的影响和分子机制。

图4 抑制miR-144-5p表达逆转干扰LINC00963表达对脑胶质瘤U251细胞凋亡相关蛋白表达

图5 抑制miR-144-5p表达逆转干扰LINC00963表达对脑胶质瘤U251细胞的存活曲线

图6 抑制miR-144-5p表达逆转干扰LINC00963表达对脑胶质瘤U251细胞凋亡流式图

表8 抑制miR-144-5p表达逆转了干扰LINC00963表达对脑胶质瘤U251细胞凋亡的作用
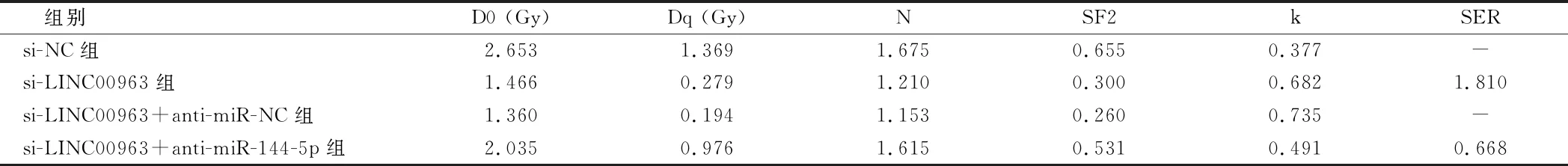
表9 单击多靶模型参数
本研究结果显示脑胶质瘤组织中LINC00963的表达较正常脑组织显著升高,miR-144-5p的表达较正常脑组织显著降低。采用双荧光素酶报告基因和RT-qPCR验证二者之间靶向调控关系显示,miR-144-5p是LINC00963的靶基因,且LINC00963可负性调控miR-144-5p表达。LINC00963是一种癌基因,研究显示LINC00963在前列腺癌[11]、骨肉瘤[12]和皮肤鳞状细胞癌[13]中表达上调,下调LINC00963可抑制肿瘤细胞的增殖、迁移和侵袭,促进细胞凋亡。此外,下调LINC00963还可提高乳腺癌细胞的放疗敏感性[8]。本研究采用RNA干扰技术干扰LINC00963表达后发现U251细胞的凋亡率显著升高。在分子水平上干扰LINC00963还可抑制Bcl-2表达,同时诱导Bax和cleaved-caspase3表达。Bcl-2主要位于线粒体膜的外侧,是抗凋亡家族的主要成员,其通过阻断线粒体中细胞色素c释放,抑制cleaved-caspase3活化,在应对各种刺激时发挥关键作用,然而Bax则发挥相反的作用[14]。进一步研究显示干扰LINC00963表达还可降低一定剂量辐射下U251细胞的存活分数,提高U251细胞的放射敏感性。以上研究揭示了LINC00963在脑胶质瘤细胞放射疗抵抗中的重要作用。
miR-144-5p是miR-144/451簇的成员之一,研究显示miR-144-5p低表达与肾细胞癌患者的不良预后显著相关,过表达显著降低了癌细胞的迁移和侵袭能力[15];miR-144-5p在膀胱癌组织中表达下调,上调miR-144-5p抑制膀胱癌细胞的增殖[16];miR-144-5p还可抑制食管癌细胞的侵袭和迁移,引起细胞周期S-G2期和G2-M期阻滞[17]。与上述研究结论类似,miR-144-5p在脑胶质瘤中也发挥抑癌基因作用。过表达miR-144-5p后U251细胞的凋亡率显著增加,抗凋亡蛋白Bcl-2的表达显著降低,促凋亡蛋白Bax和cleaved-caspase3的表达显著升高,并降低一定剂量辐射下U251细胞的存活分数,提高U251细胞放射敏感性。进一步研究显示,抑制miR-144-5p表达逆转干扰LINC00963表达对脑胶质瘤U251细胞凋亡和放射敏感性的影响。以上研究说明LINC00963通过靶向miR-144-5p在脑胶质瘤放疗中发挥中作用。
综上所述,LINC00963在脑胶质瘤中表达上调,miR-144-5p表达下调。干扰LINC00963通过上调miR-144-5p可诱导脑胶质瘤凋亡并提高其放射敏感性。因此,LINC00963是脑胶质瘤的潜在治疗靶点,干扰LINC00963联合放疗可能是一种有效的脑胶质瘤治疗策略。
